| |
| Med Sci (Paris). 2009 December; 25(12): 1169–1172. Published online 2009 December 15. doi: 10.1051/medsci/200925121169.Ingénierie de charpentes protéiques comme alternative aux anticorps De la recherche au développement clinique Thierry Wurch,* Peter Lowe, Alain Beck, and Nathalie Corvaia Centre d’immunologie Pierre Fabre, F74164 Saint-Julien-en-Genevois, France |
Les scaffolds protéiques en développement clinique À ce jour, neuf scaffolds protéiques ont franchi le stade critique des essais cliniques chez l’homme [
1]. Parmi eux, cinq structures1 sont directement dérivées des anticorps et ne seront pas développées dans cet article : ART621, a domain antibody (dAb) (→) ; MT103, BiTE ; ALX-0081, nanobody ; TRU-015 (SMIPTM, a small modular immunopharmaceutical) contre le CD-20 (→) et ESBA105 (scFv). Les quatre scaffolds décrits plus en détail ci-dessous sont construits sur des charpentes totalement indépendantes des anticorps et correspondent à la fibronectine de type III (Adnectin CT-322), au domaine Z de la protéine A de Staphylococcus aureus (Affibody ABY-025), au domaine A du récepteur des LDL (low density lipoproteins) (avimer AMG-220), au domaine dit « Kunitz » de la lipoprotéine associée à un inhibiteur de coagulation (LACI Kunitz domain, DX-88).
(→) voir P. Chames et D. Baty, page 1159
(→) voir G. Cartron et J.F. Rossi, page 1085
|
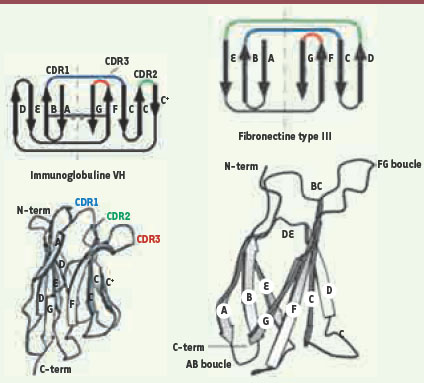
Le scaffold protéique sur lequel a été conçu AngioceptTM (CT-322) est l’Adnectine, développé par le laboratoire pharmaceutique Adnexus2 (Waltham, MA, US, rachetée en septembre 2007 par Bristol-Myers-Squibb). Les adnectines, protéines de structure repliée en sept feuillets bêta (sandwich beta), sont dérivées du dixième domaine de la fibronectine humaine de type III et possèdent une taille de 94 acides aminés (AA). La structure Adnectine possède notamment trois boucles qui connectent les feuillets bêta et présentent des homologies structurales avec les domaines hypervariables des immunoglobulines (Figure 1). Les AA de ces boucles ont ensuite été réassemblés de façon aléatoire dans des banques de haute diversité, ensuite utilisées pour créer des protéines de liaison contre différentes cibles comme le TNF (tumor necrosis factor)-α, l’ubiquitine et le VEGFR2 (vascular endothelial growth factor receptor 2) [
2,
3]. La molécule CT-322, agent anti-angiogénique, est dirigée contre cette dernière cible : elle est capable d’inhiber l’activation de VEGFR2 par ses ligands, les VEGF-A, VEGF-C et VEGF-D (→). L’affinité de CT-322 pour sa cible est de 10 nM [
4]. Angiocept correspond à une protéine de 10 kDa, produite dans E. coli. Afin d’augmenter sa demi-vie, la molécule CT-322 a été associée au polyéthylène glycol (PEG), ce qui a eu pour résultat une augmentation de sa biodisponibilité (AUC passant de 14.6 à 193 hr*µg/ml) [
5] (→). La molécule a démontré une forte efficacité anti-tumorale (réduction de la taille des tumeurs de 40 à 90 %) dans des modèles précliniques chez la souris nude greffée avec différents types de tumeurs humaines (mélanome, glioblastome, poumon, côlon) [
6]. Une étude clinique de phase I avec escalade de doses a débuté en 2006 ; elle évalue la toxicité et la tolérance à AngioceptTM administrée en monothérapie à des patients atteints de tumeurs solides et de lymphomes non hodgkiniens. Le produit est bien toléré jusqu’à une dose de 2 mg/kg/semaine, définie comme la dose maximale tolérée. Au-delà, certaines toxicités de grade 3 sont observées (protéinurie, dysfonction ventriculaire [
7]). Des arguments cliniques reflétant la modulation des voies de signalisation associées au VEGF ainsi qu’une stabilisation de la maladie ont été observées [7]. Une étude clinique de phase II3 est en cours dans le traitement de glioblastomes multiformes : AngioceptTM est utilisée soit en monothérapie, soit en combinaison avec l’irinotécan.  | Figure 1.
Structure Adnectine : trois boucles qui connectent les feuillets bêta et présentent des homologies structurales avec les domaines hypervariables des immunoglobulines. CDR : complementary determining regions. (© image du site Research Corporation Technologies [RCTech] - http://www.rctech.com/licensing/gxt-scaffolds.php), proposant une licence d’application de la technologie développée par le Pr S. Koide sur l’ingénierie du scaffold fibronectine III. © l’attribution des boucles de la structure 3D du domaine fibronectine provient de la figure 1 de l’article original de Koide et al. (Proc Natl Acad Sci USA, February 5, 2002, vol. 99, n°3, pp. 1253-1258). |
(→) voir N. Cézé et al. page 1099
(→) voir G. Paintaud, page 1057
|
Le scaffold protéique de type Affibody4 est dérivé du domaine Z de la protéine A de Staphylococcus aureus [
8]. Le cœur de structure est composé de 5 domaines de type triple hélice alpha de 58 AA chacun. La protéine ne comporte aucun pont disulfure, elle est aisément produite dans E. coli. Sur la base de données structurales, treize positions clés ont été choisies sur deux des trois triple hélices et modifiées de manière aléatoire pour générer des banques de moyenne diversité par une approche de phage display. L’origine bactérienne de la protéine A pouvant être à l’origine d’une forte immunogénicité de la structure Affibody chez l’homme, cette structure a été initialement développée comme agent d’imagerie notamment pour le diagnostic de cancer. ABY-025 est dirigé contre le récepteur HER2/neu (ERBB2), cible thérapeutique du trastuzumab (→). Un essai de phase I de développement clinique utilisant cet agent de radio-marquage va débuter en Allemagne pour le diagnostic du cancer du sein. Le premier lot de qualité GMP (good manufacturing procedure) a été produit et les études réglementaires de toxicologie n’ont pas montré d’effets secondaires délétères aux plus fortes doses évaluées. Les études précliniques ont démontré une accumulation de [125I]ABY-025 dans la tumeur et une rapide élimination par les reins [
9].
(→) voir A. Bodmer et al., page 1090
|
L’un des scaffolds protéiques les plus exotiques actuellement en développement clinique correspond aux « avimers », développés par la société Avidia (reprise par Amgen5 fin 2006). Le concept des avimers (contraction de avidity multimers) repose sur l’oligomérisation de scaffolds pour augmenter l’affinité apparente du multimère. La structure de base des avimers correspond au domaine A présent dans de nombreux récepteurs membranaires comme le récepteur aux LDL. Ce domaine d’environ 30-35 AA comporte 6 résidus cystéine indispensables à son repliement correct [
10]. Des librairies de domaines A sont constituées, obtenus par mutagenèse aléatoire de type exon shuffling, et conservant uniquement les résidus impliqués dans la conformation 3D de ce domaine. Après plusieurs tours de sélection, différents domaines A, reconnaissant chacun un épitope différent sur la protéine ciblée, sont associés par fusion génique pour former un avimer de forte affinité pour sa cible. Cette technique est appelée « marche sur un domaine » (domain walking). Ainsi, des avimers comportant jusqu’à 24 ponts disulfures peuvent être produits en système bactérien avec des productivités atteignant 1 g/l [10] (→). AMG-220 (= C326) est un scaffold avimer dirigé contre la cytokine interleukine (IL)-6. Il correspond à un trimère de domaines A obtenu après plusieurs tours de sélection de monomères pour obtenir une affinité picomolaire pour l’IL-6 [10]. L’addition d’un quatrième domaine se liant aux IgG humaines permet d’augmenter la demi-vie de ces scaffolds qui peut ainsi atteindre 7 jours chez l’homme [10]. Une étude clinique de phase I avec escalade de dose a débuté fin 2006 pour évaluer la toxicité, l’immunogénicité ainsi que les paramètres pharmacocinétiques et pharmacodynamiques de C326 chez des patients atteins de la maladie de Crohn6. Depuis le rachat de Avidia par Amgen, aucune nouvelle information n’est disponible concernant le développement clinique de ce scaffold.
(→) voir O. Cochet et M. Chartrain, page 1078
|
Domaine Kunitz DX-88 (ecallantide) L’ecallantide, ou DX-88 (Dyax Corp7,, États-Unis) est le scaffold protéique dont le développement clinique est le plus avancé. C’est un inhibiteur puissant et spécifique de la kallicréine plasmatique humaine (Ki : 44 pM). En se liant à la kallicréine pour l’inhiber, ce produit bloque aussi la production de bradykinine. L’ecallantide est une protéine recombinante dérivée du premier domaine de Kunitz8 de la protéine humaine LACI (lipoprotein-associated coagulation inhibitor) ; elle est obtenue par évolution dirigée et sélection par phage display [
11]. L’ecallantide comporte 60 AA et est produit par la levure Pichia pastoris (→). L’ecallantide a été évalué lors de plusieurs essais cliniques dans deux indications thérapeutiques : l’angiœdème héréditaire9 (AOH) et le pontage aorto-coronarien par greffe. L’AOH est une pathologie inflammatoire aiguë autosomale rare (prévalence 1/10 000 - 1/50 000 au niveau mondial), causée par une dysfonction de l’inhibiteur de la C1 estérase, un inhibiteur naturel de la kallicréine et autres sérine-protéases plasmatiques. Quatre essais de phase I et trois essais de phase II totalisant 134 patients ont démontré l’efficacité clinique de l’ecallantide, puisque les symptômes de la crise sont améliorés significativement dans les quatre heures [
12]. Le produit a été globalement bien toléré hormis un cas de réaction anaphylactique durant l’une des phases II. Deux études importantes de phase III ont conforté la bonne tolérance et la forte efficacité thérapeutique de l’ecallantide. Dans l’indication concernant le pontage coronarien par greffe, une étude de phase I/II a été achevée : aucun effet délétère sérieux n’a été reporté, et le traitement a permis de réduire significativement les besoins en transfusion post-pontage. Le DX-88 est développé par Cubist Pharmaceuticals (US) qui a obtenu un contrat de licence en 2008 pour son application dans cette indication.
(→) Voir O. Cochet et M. Chartrain, page 1078
|
Les importants progrès obtenus ces dernières années durant le développement des scaffolds protéiques dessinent aujourd’hui plus précisément les contours de l’ère post-anticorps. Leur efficacité clinique et leur bonne tolérance vont certainement bénéficier au développement des biomolécules actuellement au stade de la validation préclinique. À ce jour, les principaux domaines thérapeutiques ciblés sont l’oncologie et les pathologies inflammatoires, à l’image des anticorps. Mais leur petite taille favorise la pénétration dans les tumeurs solides, voire le ciblage intracellulaire, et peut donc favoriser le développement de cette classe thérapeutique émergente dans des indications pour lesquelles le format anticorps serait moins adapté. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Wurch T, Lowe P, Caussanel V, et al. Development of novel protein scaffolds as alternatives to whole antibodies for imaging and therapy: status on discovery research and clinical validation. Curr Pharm Biotechnol 2008; 9 : 502–9. 2. Koide A, Bailey CW, Huang X, et al. The fibronectin type III domain as a scaffold for novel binding proteins. J Mol Biol 1998; 284 : 1141–51. 3. Koide A, Abbatiello S, Rothgery L, et al. Probing protein conformational changes in living cells by using designer binding proteins: application to the estrogen receptor. Proc Natl Acad Sci USA 2002; 99 : 1253–8. 4. Parker MH, Chen Y, Danehy F, et al. Antibody mimics based on human fibronectin type three domain engineered for thermostability and high-affinity binding to vascular endothelial growth factor receptor two. Protein Eng Des Sel 2005; 18 : 435–44. 5. Mamluk R, Carvajal IM, Bates JM, et al. Preclinical development of a potent VEGFR-2 antagonist based on a novel protein scaffold (AdNectin). Proc Amer Assoc Cancer Res 2005; 46 : Abstract nr 3037. 6. Carvajal IM, Bates JM, Sort S, et al. A Novel inhibitor for VEGFR-2 ; emerging advantages of blocking the VEGFR-2 receptor in the VEGF pathway. Proc Am Assoc Cancer Res 2006; 47 : 972 (abstract). 7. Sweeney CJ, Chriorean EG, Mita MM, et al. Phase I study of CT-322, first Adnectin protein therapeutic and potent inhibitor of VEGFR-2, in patients (pts) with advanced solid tumors (ST). J Clin Oncol 2008; 26 : 3523 (abstract). 8. Nilsson FY, Tolmachev V. Affibody molecules: new protein domains for molecular imaging and targeted tumor therapy. Curr Opin Drug Discov Dev 2007; 10 : 167–75. 9. Orlova A, Magnusson M, Eriksson TL, et al. Tumor imaging using a picomolar affinity HER2 binding affibody molecule. Cancer Res 2006; 66 : 4339–48. 10. Silverman J, Liu Q, Bakker A, et al. Multivalent avimer proteins evolved by exon shuffling of a family of human receptor domains. Nat Biotechnol 2005; 23 : 1556–61. 11. Markland W, Ley AC, Ladner RC. Iterative optimization of high-affinity protease inhibitors using phage display. 2. Plasma kallikrein and thrombin. Biochemistry 1996; 35 : 8058–67. 12. Williams A, Baird LG. DX-88 and HAE: a developmental perspective. Transfus Apher Sci 2003; 29 : 255–8. |