| |
| Med Sci (Paris). 2009 August; 25(8-9): 666–668. Published online 2009 August 15. doi: 10.1051/medsci/2009258-9666.La cytokine hématopoïétique M-CSF Intérêt thérapeutique dans la maladie d’Alzheimer ? Vincent Boissonneault and Serge Rivest* Endocrinologie moléculaire, Centre de recherche du CHUL Département d’anatomie et de physiologie, Faculté de médecine, Université Laval, 2705, boulevard Laurier, Québec (Québec), G1V 4G2 Canada MeSH keywords: Sujet âgé, Maladie d'Alzheimer, Animaux, Animal génétiquement modifié, Humains, Lysosomes, Facteur de stimulation des colonies de macrophages, Microglie |
Dans les pays industrialisés, la maladie d’Alzheimer est une des causes majeures de démence chez l’être humain. On observe principalement deux types d’anomalies à l’examen post-mortem des cerveaux de patients atteints de cette maladie : la présence de dépôts extracellulaires du peptide β-amyloïde (Aβ), aussi connus sous le nom de plaques séniles, et la formation d’agrégats intracellulaires de la protéine tau hyperphosphorylée, et ce, dans le cortex et dans l’hippocampe. La dysfonction synaptique neuronale qu’entraînent les plaques d’Aβ est associée au déficit d’apprentissage et mémoriel observé dans cette maladie. Ces lésions évoluent vers la mort des neurones qu’accompagne une aggravation de la maladie. Les mécanismes exacts qui provoquent cette mort cellulaire demeurent encore mal compris et sont source de controverses malgré les avancées importantes des connaissances dans ce domaine. |
Microglies et maladie d’Alzheimer Les microglies sont des cellules myéloïdes hautement ramifiées qui interviennent dans l’immunité innée du système nerveux central (SNC). Dans le cortex et l’hippocampe, chez les patients atteints de la maladie d’Alzheimer comme chez les souris transgéniques utilisées comme modèles de la maladie, ces cellules myéloïdes entourent les dépôts d’Aβ et leurs ramifications les infiltrent, suggérant qu’elles ont une part active dans le processus de la maladie. Une polémique subsiste toujours quant au rôle, néfaste ou bénéfique, de ces microglies dans la progression de cette maladie. De nombreux travaux tendent à démontrer que les cellules microgliales, une fois activées, ont la capacité d’ingérer l’Aβ présente dans le milieu extracellulaire et de l’acheminer vers les lysosomes, compartiment spécialisé dans la dégradation [
1–
4]. Nous avons précédemment établi chez des souris transgéniques développant la pathologie Aβ que lors de la progression de la maladie, une nouvelle population de microglies, provenant de la moelle osseuse et infiltrant le SNC, était présente aussi bien dans le cortex que dans l’hippocampe [
5,
6]. |
Effet d’un traitement par le M-CSF de souris transgéniques modèles de la maladie d’Alzheimer Partant de cette observation, nous avons décidé de stimuler la différenciation cellulaire des cellules myéloïdes vers la production de monocytes, les précurseurs des microglies. À cette fin, nous avons utilisé une cytokine hématopoïétique nommée M-CSF (Macrophage colony-stimulating factor) [
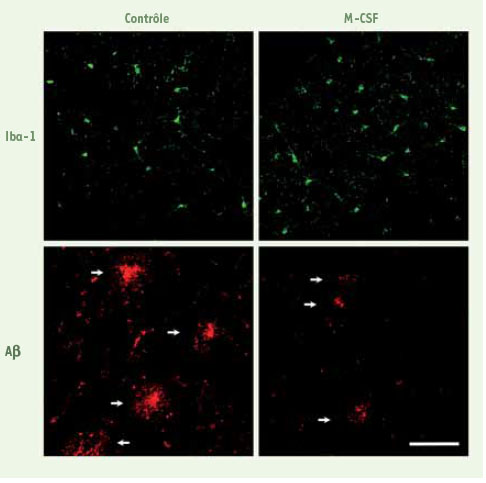
7]. Les souris traitées par le M-CSF étaient des animaux transgéniques ayant deux gènes prédisposant au développement des plaques d’Aβ : l’APPSwe (β-amyloid precursor protein) portant une mutation bien connue pour déclencher la production de l’Aβ, ainsi que le gène codant la préseniline-1 (PS1) portant aussi une mutation favorisant la production du peptide nuisible. Ces animaux développent rapidement - dès les 6 premiers mois - des plaques séniles et un déficit mémoriel (mémoire spatiale) et cognitif (évitement passif). Ces souris ont été traitées dès le deuxième mois, avant l’apparition des dépôts d’Aβ et des troubles comportementaux, par une administration hebdomadaire de M-CSF pendant 4 mois. Pour les souris traitées comme pour les souris contrôles, l’effet du traitement a été mesuré en utilisant le test du labyrinthe d’eau en forme de T (T-water maze), un procédé reconnu pour quantifier le déficit d’apprentissage et mémoriel dans les modèles murins de la maladie d’Alzheimer. Un effet marqué de la cytokine a été observé. Ainsi, après 4 mois de traitement par M-CSF, les souris ont manifesté une capacité à accomplir la tâche égale à celle des souris saines non transgéniques. À l’opposé, les souris APPSwe/PS1 ayant reçu le placebo ont accusé une détérioration de leurs capacités d’apprentissage et de rétention de l’information. De pair avec cette prévention de l’apparition du déficit comportemental, nous avons observé une augmentation (plus du double) du nombre de microglies dans le cortex et l’hippocampe des souris traitées par M-CSF (Figure 1). Pour vérifier l’origine de ce surplus de cellules microgliales, nous avons adopté une stratégie de greffe de moelle osseuse : des souris APPSwe/PS1 receveuses ont été irradiées pour détruire leurs cellules souches hématopoïétiques, puis greffées avec les cellules médullaires d’une souris donneuse exprimant la protéine GFP (green fluorescent protein). Ces animaux ont ensuite été traités par M-CSF puis leurs fonctions cognitives testées comme décrit précédemment. On notait dès le départ une certaine infiltration de cellules GFP dans le SNC des souris APPSwe/PS1, mais le M-CSF provoquait une infiltration massive par des cellules GFP-positives différenciées en microglies, suggérant qu’une bonne partie de ces microglies chez les animaux traités provenait des cellules souches hématopoïétiques du donneur. Ce constat ne permet cependant pas d’exclure une prolifération locale des cellules microgliales au sein du SNC sous l’action du M-CSF.  | Figure 1.
Augmentation du nombre de microglies et diminution des dépôts d’Aβ consécutif au traitement avec le M-CSF. Les deux premières images (marquage avec Iba-1) montrent la différence du nombre de microglies (vert) entre les souris ayant reçu ou non du M-CSF. En rouge, comparaison de la densité, du volume et du nombre de plaques d’Aβ (rouge, flèches blanches) entre les deux groupes (reproduction de [ 7] avec la permission de Oxford University Press). |
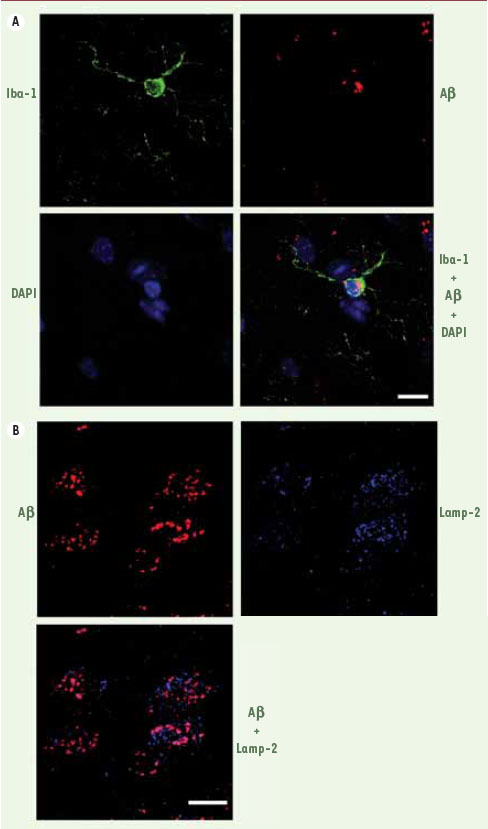
Cette infiltration de microglies chez les animaux traités a non seulement été associée à une diminution du nombre des plaques d’Aβ, mais encore à une diminution de leur volume et de leur densité. Ces cellules semblent intervenir dans la restriction de ces amas extracellulaires : en effet, un plus grand nombre de microglies associées à chaque agrégat a été observé chez les souris traitées par le M-CSF que chez les souris contrôles. De surcroît, une proportion élevée de microglies qui n’étaient pas associées aux plaques séniles ont prouvé leur capacité d’ingérer l’Aβ (Figure 2A). L’étude de la localisation de ces débris ingérés a révélé que le lysosome est le compartiment cible (Figure 2B). Donc, sous l’action du M-CSF, les microglies non seulement internalisent l’Aβ, mais aussi le dirigent vers un organite propre à la dégradation. Ces résultats concordent avec de récents travaux qui ont démontré qu’en présence de M-CSF, les lysosomes des cellules microgliales atteignent un degré d’acidité optimum pour la dégradation de l’Aβ [
8].  | Figure 2.
Devenir cellulaire de l’A β dans les microglies des souris traitées avec le M-CSF. A. Triple marquage pour les microglies (vert ; Iba-1), l’Aβ (rouge) et les noyaux (bleu ; DAPI). L’Aβ est présente dans le corps de la microglie. B. Colocalisation (mauve) de l’Aβ(rouge) et des lysosomes (bleu ; Lamp-2) dans une microglie (reproduction de [ 7] avec la permission de Oxford University Press). |
Forts de ce franc succès du M-CSF dans la prévention de l’apparition du déficit cognitif, nous avons décidé de tester cette molécule chez des souris manifestant déjà des troubles du comportement et porteuses de dépôts d’Aβ. Des souris APPSwe/PS1 âgées de 6 mois ont reçu une injection hebdomadaire de M-CSF pendant 3 mois à la même dose que dans les expériences précédentes. L’analyse comportementale démontre que l’état des souris traitées par un placebo se détériore au cours des 3 mois, contrairement à celui des souris traitée par M-CSF, qui se stabilise et, dans un tiers des cas, s’améliore [7]. Ces résultats préliminaires suggèrent donc que le M-CSF pourrait être utilisé non seulement comme moyen de prévention mais aussi comme une approche thérapeutique possible pour limiter les lésions provoquées par la maladie d’Alzheimer. |
Quel rôle pour le M-CSF en pratique ? L’utilisation du M-CSF comme moyen thérapeutique ouvre un avenir prometteur pour la mise au point de nouvelles approches destinées à traiter les patients atteints de la terrible affliction qu’est la maladie d’Alzheimer. En effet, cette cytokine possède non seulement le potentiel de prévenir l’apparition du déficit mémoriel associé à la maladie, mais aussi la capacité de stabiliser l’état cognitif une fois la pathologie installée. Ce constat offre un espoir considérable pour les patients aux stades précoces de la maladie. Qui plus est, contrairement aux voies qui ont recours à la greffe de cellules souches pour tenter de renverser l’installation des plaques séniles, notre méthode présente l’avantage de n’utiliser que les cellules du patient telles qu’elles sont. Elle évite donc de mettre en œuvre des procédures complexes et parfois risquées. Il nous reste maintenant à élucider les mécanismes par lesquels le M-CSF exerce son effet bénéfique et à optimiser le traitement pour pouvoir l’appliquer bientôt à l’humain. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Chung H, Brazil MI, Soe TT, Maxfield FR. Uptake, degradation, and release of fibrillar and soluble forms of Alzheimer’s amyloid beta-peptide by microglial cells. J Biol Chem 1999; 274 : 32301–8. 2. Morgan D, Diamond DM, Gottschall PE, et al. A beta peptide vaccination prevents memory loss in an animal model of Alzheimer’s disease. Nature 2000; 408 : 982–5. 3. Paresce DM, Chung H, Maxfield FR. Slow degradation of aggregates of the Alzheimer’s disease amyloid beta-protein by microglial cells. J Biol Chem 1997; 272 : 29390–7. 4. Rogers J, Strohmeyer R, Kovelowski CJ, Li R. Microglia and inflammatory mechanisms in the clearance of amyloid beta peptide. Glia 2002; 40 : 260–9. 5. Simard AR, Rivest S. Les cellules souches de la moelle osseuse au secours de la maladie d’Alzheimer. Med Sci (Paris) 2006; 22 : 822–4. 6. Simard AR, Soulet D, Gowing G, et al. Bone marrow-derived microglia play a critical role in restricting senile plaque formation in Alzheimer’s disease. Neuron 2006; 49 : 489–502. 7. Boissonneault V, Filali M, Lessard M, et al. Powerful beneficial effects of macrophage colony-stimulating factor on beta-amyloid deposition and cognitive impairment in Alzheimer’s disease. Brain 2009; 132 : 1078–92. 8. Majumdar A, Cruz D, Asamoah N, et al. Activation of microglia acidifies lysosomes and leads to degradation of Alzheimer amyloid fibrils. Mol Biol Cell 2007; 18 : 1490–6. |