| |
| Med Sci (Paris). 2009 August; 25(8-9): 678–680. Published online 2009 August 15. doi: 10.1051/medsci/2009258-9678.BMP6, un acteur clé dans la régulation du métabolisme du fer Marie-Paule Roth* and Hélène Coppin Inserm U563, CHU Purpan, place du Docteur Baylac, 31300 Toulouse, France MeSH keywords: Peptides antimicrobiens cationiques, Protéine morphogénétique osseuse de type 6, Homéostasie, Humains, Fer |
L’absorption par la muqueuse intestinale du fer contenu dans le bol alimentaire constitue la seule voie d’entrée de ce nutriment dans l’organisme. Le fer est capté par les cellules épithéliales du duodénum, transféré du pôle apical des entérocytes vers le pôle basal qu’il traverse grâce à la ferroportine pour passer dans la circulation sanguine. Les pertes en fer sont limitées dans les conditions physiologiques et sont principalement dues à l’élimination des cellules intestinales et cutanées sénescentes. L’homéostasie du fer dépend donc essentiellement de la régulation de l’entrée du fer dans l’organisme [
1]. La découverte de deux acteurs clés dans l’adaptation de l’absorption intestinale du fer aux besoins de l’organisme, l’hepcidine en 2001 [
2,
3] et tout récemment la molécule qui régule sa production, BMP6 [
4,
5], permet désormais de mieux comprendre les mécanismes permettant le maintien de l’homéostasie du fer [
11,
12]. |
L’hepcidine et la régulation du fer L’hepcidine se fixe à la ferroportine à la surface des entérocytes et des macrophages. Elle provoque ainsi l’internalisation et la dégradation de la ferroportine [
6], bloquant le fer dans ces cellules et le rendant indisponible. Dans le foie, la transcription du gène codant l’hepcidine (HAMP) est ajustée aux besoins de l’organisme. Dans les conditions physiologiques, le niveau d’hepcidine augmente lorsque le fer est en excès et au contraire diminue en cas de carence en fer ou d’hypoxie. Cette régulation ne fonctionne plus de façon appropriée chez les patients atteints d’hémochromatose, une maladie génétique qui conduit à une accumulation de fer, principalement dans le foie, et à des complications parfois sévères (cirrhose, hépatocarcinome). Les hémochromatoses à début précoce sont dues à des mutations dans le gène HAMP ou dans le gène HFE2, codant l’hémojuvéline, et sont plus sévères que les formes à début plus tardif dues à des mutations dans d’autres gènes impliqués dans la voie de régulation de l’hepcidine, comme HFE ou TFR2 (transferrin receptor 2). |
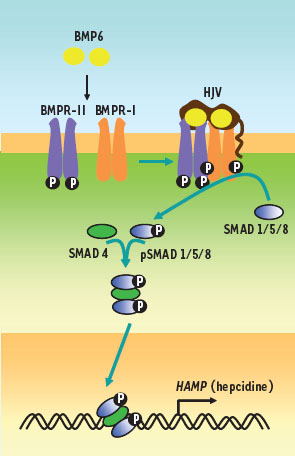
La voie de signalisation BMP-SMAD La mise en évidence du rôle de l’hémojuvéline (HJV ou RGMc), la protéine impliquée dans l’hémochromatose juvénile, a permis une avancée significative dans l’élucidation de la cascade de régulation conduisant à la production d’hepcidine. Il s’agit en effet d’une protéine appartenant à la famille des molécules de guidage axonal (RGM, repulsive guidance molecule) [
13]. HJV est fortement exprimée dans le foie, le muscle squelettique et le cœur. Cependant, comme les autres molécules RGM, HJV est un corécepteur des protéines morphogénétiques osseuses (BMP) [
7], révélant ainsi un lien jusque-là insoupçonné entre le fer et les cytokines de la famille du TGF-β1 (transforming growth factor β). L’interaction des BMP et de leurs récepteurs à activité tyrosine kinase conduit à la phosphorylation des effecteurs cytoplasmiques SMAD1/5/8 et à la formation d’un complexe entre les SMAD1/5/8 phosphorylés et SMAD4. Ce complexe est alors transloqué dans le noyau où il active le promoteur du gène de l’hepcidine (Figure 1). Plusieurs observations récentes sont venues conforter le rôle de la voie de signalisation BMP-SMAD dans la régulation du métabolisme du fer. Tout d’abord les souris génétiquement modifiées pour ne plus produire, soit l’hémojuvéline [
8], soit SMAD4 dans le foie [
9], ont toutes une production d’hepcidine effondrée et une surcharge en fer massive. Ensuite, de nombreuses molécules BMP sont capables d’induire l’expression d’hepcidine in vitro dans des lignées cellulaires hépatiques. Cependant la nature exacte du régulateur endogène restait à découvrir.  | Figure1.
La voie de signalisation BMP-SMAD et la synthèse d’hepcidine. L’interaction de BMP6, de ses récepteurs à activité tyrosine kinase (BMPR-I et BMPR-II) et du corécepteur HJV (hémojuvéline) conduit à la phosphorylation des effecteurs cytoplasmiques SMAD 1/5/8 et à la formation d’un complexe entre les SMAD1/5/8 phosphorylées et SMAD4. Ce complexe est alors transloqué dans le noyau où il active le promoteur du gène de l’hepcidine. |
|
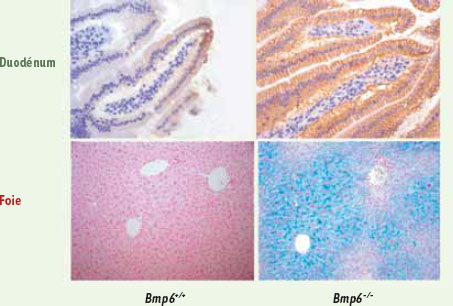
Le rôle spécifique de BMP6 Notre équipe a comparé le transcriptome hépatique de souris nourries avec une alimentation carencée ou au contraire riche en fer et a montré que seule l’expression du gène Bmp6 était induite par le fer comme la phosphorylation des protéines SMAD1/5/8 et l’expression de l’hepcidine [
10]. BMP6 pouvait donc être le régulateur endogène recherché. Pour le prouver, nous avons étudié des souris invalidées pour Bmp6 et nous avons montré que ces souris développaient une surcharge en fer massive dans le foie, le pancréas, le cœur et le rein, mimant ainsi une hémochromatose sévère. L’expression du gène de l’hepcidine est effondrée chez ces souris, et la ferroportine n’est par conséquent plus dégradée, laissant le fer traverser massivement l’entérocyte et sortir abondamment du macrophage [5] (Figure 2). Simultanément, une autre équipe a montré que les souris traitées par un anticorps neutralisant anti-BMP6 produisaient moins d’hepcidine que les souris non traitées, tandis que l’injection de protéine BMP6 recombinante augmentait de façon significative la transcription du gène de l’hepcidine et diminuait le taux de fer sérique [4]. De façon intéressante, les souris qui ne produisent pas de BMP6 ne présentent pas les anomalies du développement qui caractérisent les souris déficientes pour les autres BMP. Par contre, elles ont une surcharge en fer sévère qui n’est pas corrigée par les autres BMP, ce qui démontre la fonction majeure et non redondante de BMP6 dans la régulation du métabolisme du fer.  | Figure 2.
Anomalies du métabolisme du fer chez la souris Bmp6−/−. Les souris invalidées pour le gène Bmp6 (Bmp6
−/−) présentent, par rapport aux souris sauvages (Bmp6
+/+), une expression très importante de la ferroportine au pôle basolatéral des entérocytes (mise en évidence par immunohistochimie) et une surcharge en fer intrahépatique massive (le fer est visualisé en bleu par la coloration de Perls). |
|
Les études qui viennent d’être publiées montrent le rôle fondamental de BMP6 dans la régulation de l’absorption intestinale du fer et suggèrent qu’il serait utile de développer des agonistes ou des antagonistes de BMP6 qui pourraient être utilisés pour réguler le niveau d’hepcidine soit chez les patients atteints d’hémochromatose qui en ont trop peu, soit chez ceux présentant une anémie inflammatoire liée à un excès d’hepcidine. Des mutations dans le gène BMP6 pourraient être impliquées dans les formes précoces d’hémochromatose juvénile encore non étiquetées. Elles pourraient également, ajoutées à l’homozygotie classique pour la mutation C282Y du gène HFE, expliquer la sévérité de certaines hémochromatoses. Notre équipe est en train de tester cette dernière hypothèse sur un grand nombre de patients dont le recrutement se poursuit actuellement. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Camaschella C. BMP6 orchestrates iron metabolism. Nat Methods 2009; 41 : 386–8. 2. Nicolas G, Bennoun M, Devaux I, et al. Lack of hepcidin gene expression and severe tissue iron overload in upstream stimulatory factor 2 (USF2) knockout mice. Proc Natl Acad Sci USA 2001;98 : 8780–5. 3. Pigeon C, Ilyin G, Courselaud B, et al. A new mouse liver-specific gene, encoding a protein homologous to human antimicrobial peptide hepcidin, is overexpressed during iron overload. J Biol Chem 2001; 276 : 7811–9. 4. Andriopoulos B Jr, Corradini E, Xia Y, et al. BMP6 is a key endogenous regulator of hepcidin expression and iron metabolism. Nat Genet 2009; 41 : 482–7. 5. Meynard D, Kautz L, Darnaud V, et al.Lack of the bone morphogenetic protein BMP6 induces massive iron overload. Nat Genet 2009;41 : 478–81. 6. Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science 2004;306 : 2090–3. 7. Babitt JL, Huang FW, Wrighting DM, et al. Bone morphogenetic protein signaling by hemojuvelin regulates hepcidin expression. Nat Genet 2006;38 : 531–9. 8. Huang FW, Pinkus JL, Pinkus GS, et al. A mouse model of juvenile hemochromatosis. J Clin Invest 2005;115 : 2187–91. 9. Wang RH, Li C, Xu X, et al. A role of SMAD4 in iron metabolism through the positive regulation of hepcidin expression. Cell Metab 2005; 2 : 399–409. 10. Kautz L, Meynard D, Monnier A, et al. Iron regulates phosphorylation of Smad1/5/8 and gene expression of Bmp6, Smad7, Id1, and Atoh8 in the mouse liver. Blood 2008; 112 : 1503–9. 11. Beaumont C. Mécanismes moléculaires de l’homéostasie du fer. Med Sci (Paris) 2004; 20 : 68–72. 12. Viatte L. Les nouveaux partenaires de la ferritine. Med Sci 2009; 25 : 557–9. 13. Matsunaga E, Chédotal A. RGM et néogénine : un jeune couple prometteur. Med Sci (Paris) 2004; 20 : 951–2. |