| |
| Med Sci (Paris). 2009 August; 25(8-9): 699–704. Published online 2009 August 15. doi: 10.1051/medsci/2009258-9699.Le neutrophile : ennemi ou ami ? Aline Dumas* and Marc Pouliot Centre de recherche en rhumatologie et immunologie du CHUQ Département d’anatomie-physiologie, CHUL, Faculté de médecine, Université Laval, 2705, boulevard Laurier, bureau T1-49, Québec (Québec), G1V 4G2 Canada |
Les polynucléaires neutrophiles (PN) sont des agents de premier plan de l’immunité innée, particulièrement lors de la réaction inflammatoire ; ils sont souvent les premiers leucocytes à migrer en grand nombre vers le site enflammé. La réaction inflammatoire est le plus souvent protectrice car elle participe à la défense naturelle de l’organisme et à la réparation des tissus lésés. Malheureusement, si elle est inadaptée ou mal régulée, l’inflammation peut devenir nocive. Ainsi le neutrophile est mis en cause dans la pathogenèse de nombreuses maladies inflammatoires chroniques, comme la polyarthrite rhumatoïde et, en particulier, pour les altérations qu’il cause aux tissus et la dégradation des articulations qui en résulte. Les traitements anti-inflammatoires classiques parviennent à atténuer les symptômes de l’inflammation comme la fièvre, la douleur et l’enflure mais aucun ne permet la guérison. Plusieurs indices suggèrent qu’ils n’empêchent pas l’action destructrice des neutrophiles et pourraient même aggraver la progression des dommages. De meilleures stratégies pourraient consister à augmenter l’efficacité des systèmes de régulation endogènes à l’origine de la sécrétion de molécules anti-inflammatoires. Après un bref rappel des fonctions pro-inflammatoires du neutrophile, cet article mettra l’accent sur les capacités qu’ont ces cellules d’arrêter le processus d’inflammation et l’état de la recherche sur les mécanismes en cause. |
Le polynuléaire neutrophile, une première ligne de défense pour l’organisme Fonctions de base des PN : élimination des agents infectieux L’action anti-infectieuse du neutrophile repose sur ses capacités de migration transendothéliale, de phagocytose, « d’explosion oxydative » et de dégranulation [
1]. De manière physiologique, les PN transitent dans la circulation sanguine en « roulant » sur les cellules endothéliales de la paroi vasculaire (processus de rolling). En réponse à la détection de produits bactériens (peptides formylés, lipopolysaccharides) ou sous l’influence de molécules attractives [leucotriène (LT)B 4, la chimiokine CXCL8 ou IL(interleukine)-8, fragments du complément, etc.], le PN exprime à sa surface des molécules d’adhérence qui vont lui permettre de traverser la paroi endothéliale et de migrer vers le site enflammé. Il reconnaît spécifiquement des motifs présents à la surface des micro-organismes (bactéries, virus), ce qui déclenche leur phagocytose. La dégradation des pathogènes ainsi ingérés s’effectue par deux mécanismes concomitants : la production de formes réactives de l’oxygène (ROS : reactive oxygen species) par la NADPH oxydase et la libération, par les granules des PN, de protéines enzymatiques (myéloperoxydase, élastases, lysosyme, gélatinase) et antimicrobiennes (lactoferrine, bactericidal/permeability-increasing protein (ou BPI), défensines) [
2,
37]. Récemment, un nouveau mécanisme bactéricide mis en œuvre par les PN a été décrit : l’expulsion de filaments appelés NET ( neutrophil extracellular traps) ou « filets », fibres composées de chromatine et de protéases qui emprisonnent et tuent des microbes hors de la cellule. En plus de leurs propriétés antimicrobiennes, ces filets peuvent servir d’entrave physique, empêchant ainsi la diffusion des microbes [
3]. Il a aussi été suggéré que le neutrophile pourrait participer à l’immunité adaptative en adoptant, en réponse à des stimulus spécifiques, une fonction de cellule présentatrice d’antigène affectant l’action des cellules immunitaires [
4]. Fonctions sécrétoires des PN : amplification de la réponse inflammatoire Les PN sont la source de nombreux médiateurs de l’inflammation : des cytokines [IL-1β, TNF-α ( tumor necrosis factor-α)], des chimiokines [CXCL8, CCL3 et 4 (MIP-1α et β)], des facteurs de croissance [G-CSF ( granulocyte colony-stimulating factor), GM-CSF ( granulocyte/macrophage colony-stimulating factor)] et des médiateurs lipidiques [LTB 4, thromboxane (TX)A 2, prostaglandine (PG)E 2]. Ces médiateurs peuvent agir de manière paracrine ou autocrine (Figure 1). Les PN peuvent ainsi orchestrer la suite de la réponse immunitaire en influençant les cellules environnantes et en attirant d’autres leucocytes vers ce site. Cette production de médiateurs inflammatoires est en grande partie influencée par des agents stimulants, les cytokines et les endotoxines bactériennes (LPS) comptant parmi les inducteurs les plus efficaces [
5]. Elle peut aussi être réprimée par des cytokines dites anti-inflammatoires comme l’IL-10, l’IL-13, ou l’IL-1RA ( receptor antagonist) [
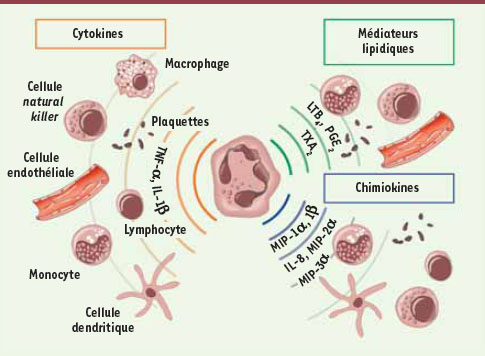
6].  | Figure 1.
Agents peptidiques et lipidiques sécrétés par le neutrophile. Le neutrophile, en condition inflammatoire, sécrète des cytokines, des chimiokines et des médiateurs lipidiques qui agissent sur les neutrophiles eux-mêmes et sur l’ensemble des autres cellules inflammatoires. Il orchestre ainsi la réponse immunitaire en influençant les cellules environnantes et en attirant d’autres leucocytes. NK : natural killer, IL : interleukine, TNF : tumor necrosis factor, PGE2 : prostaglandine E2, LTB4 : leucotriène B4
, TXA2 : thromboxane A2. |
Le TNF-α et l’IL-1β sont deux des principales cytokines pro-inflammatoires sécrétées par le neutrophile. Par leur action autocrine, elles amplifient plusieurs fonctions du neutrophile comme l’adhérence aux cellules endothéliales ou la production de ROS. Elles agissent aussi sur de nombreux types cellulaires et permettent, entre autres, le recrutement et l’activation des macrophages et des cellules dendritiques [
7]. De fait, elles sont la cible de certains traitements des maladies inflammatoires auto-immunes qui visent à bloquer leur action [
8]. La chimiokine CXCL8 est sécrétée par les PN en grande quantité mais peut également être produite par les monocytes, les fibroblastes et les cellules endothéliales, épithéliales ou synoviales. Toutefois, CXCL8 cible presque exclusivement le neutrophile et déclenche sa migration dirigée, sa dégranulation, ainsi que l’explosion oxydative [
9]. Les médiateurs lipidiques produits par le neutrophile sont, quant à eux, issus du métabolisme de l’acide arachidonique provenant des membranes cellulaires. La voie métabolique de la COX-2 (cyclo-oxygénase inductible) aboutit à la formation de PGE2 et de TXA2 [
10] tandis que celle de la 5-LO (5-lipoxygénase) produit le LTB4, un puissant chimioattractant et activateur des leucocytes [
11]. La TXA2 a des effets pro-inflammatoires : il active les plaquettes et promeut leur agrégation, ainsi que la production de TNF-α et d’IL-1β par les monocytes. La PGE2 est dotée, selon le contexte cellulaire, de fonctions pro ou anti-inflammatoires. Elle peut provoquer fièvre, hyperalgésie, vasodilatation, et favoriser l’extravasation des fluides (œdème) contribuant ainsi à l’inflammation. En revanche, la PGE2 peut réduire l’activation des phagocytes (PN et monocytes) en bloquant leur production de TNF-α et d’IL-1β et en inhibant la plupart de leurs fonctions inflammatoires via une augmentation d’AMP (adénosine monophosphate) cyclique intracellulaire [
12,
13]. |
Polynucléaires neutrophiles et résolution du processus inflammatoire Si la réaction inflammatoire est une réponse primordiale pour défendre l’organisme, sa régulation et sa résolution sont tout aussi essentielles afin d’éviter des dommages excessifs et permettre la restauration de l’intégrité structurale et fonctionnelle des tissus [
14]. Les PN, en tant que chefs d’orchestre de l’inflammation, jouent également un rôle dans son arrêt. On considère comme un premier signe de résolution de l’inflammation le remplacement, au site inflammatoire, des neutrophiles par des macrophages. Ce « changement de la garde » dépend en partie de la relève des chimiokines de la famille CXC (CXCL8, CXCL2) par la chimiokine CCL2 (MCP-1, monocyte chemotactic protein-1) notamment, qui favorise le recrutement des monocytes aux dépens de celui des PN. Ce changement implique le complexe formé par l’IL-6 et sIL-6R, son récepteur soluble - l’IL-6 est sécrétée par les cellules stromales activées, notamment les cellules endothéliales - et le sIL-6R par les neutrophiles, et l’oncostatine M, également produite par les neutrophiles [
15,
16]. La transition est aussi favorisée par l’élimination des neutrophiles via l’apoptose. La reconnaissance et la phagocytose de leucocytes apoptotiques par les macrophages provoquent la libération de signaux anti-inflammatoires comme l’IL-10 et le TGF-β (transforming growth factor) [
17]. Ces premières étapes du mécanisme d’arrêt de l’inflammation surviennent 24 à 48 heures après le déclenchement d’une réponse inflammatoire. Toutefois, les PN jouent également un rôle anti-inflammatoire actif et précoce dont l’adénosine est le pivot. Adénosine et inflammation L’adénosine est un nucléoside présent dans toutes les cellules ; elle agit comme autacoïde (hormone locale) dans de très nombreuses fonctions tissulaires et exerce notamment un rôle protecteur et inhibiteur dans des systèmes infectieux. L’adénosine est relarguée par les cellules dans le milieu extracellulaire. Sa concentration dans les vaisseaux sanguins est faible car elle est rapidement internalisée par les globules rouges [
18], ce qui n’est pas le cas dans les tissus interstitiels. Au site inflammatoire, l’accumulation d’adénosine peut être importante en raison de la libération d’ATP (hydrolysé en adénosine par les 5’-nucléotidases) par les cellules endommagées ou ischémiques et de l’augmentation du nombre de neutrophiles. L’adénosine peut alors agir sur les quatre sous-types de récepteurs qui lui sont spécifiques [
19]. Les PN sont particulièrement sensibles à l’adénosine : l’activation du récepteur de type A 2A, qu’ils expriment, inhibe leurs principales fonctions et l’expression de ce récepteur augmente dans les PN en réponse à un stimulus inflammatoire [
20]. Aucun autre mécanisme de régulation de l’inflammation in vivo n’est capable de compenser l’absence de ce récepteur : ce phénomène est illustré chez la souris A2AR−/−
qui développe des lésions tissulaires majeures en réponse à des concentrations infimes de stimulus inflammatoires. Ces résultats montrent bien le caractère essentiel et non redondant de l’adénosine dans la limitation de l’inflammation via l’activation du récepteur A 2A [
21]. Un changement phénotypique L’adénosine inhibe l’adhérence des PN à la paroi endothéliale [
22], ainsi que l’explosion oxydative et la dégranulation [
23]. L’activation du récepteur A 2A par ce nucléoside provoque un changement majeur dans le profil de sécrétion des médiateurs lipidiques par les PN (Figure 2). D’une part, il bloque la libération de l’acide arachidonique de la membrane plasmique et la translocation de la 5-LO vers la membrane nucléaire, empêchant ainsi la synthèse de LTB 4 [
24]. D’autre part, il potentialise l’expression de la COX-2 (transcrit et protéine), in vitro et in vivo [
25,
26]. Dans le modèle d’inflammation de la poche d’air dorsale 1, les PN qui s’accumulent en réponse à une injection de LPS (lipopolysaccharide) expriment deux fois moins de COX-2 lorsque les expériences sont réalisées avec des souris A2AR−/−
qu’avec des souris sauvages. Ainsi le neutrophile, d’abord reconnu comme source majeure de LTB 4, devient, à la suite de l’activation du A 2AR, une cellule productrice plutôt de PGE 2, en réponse à de l’acide arachidonique exogène [
27]. Compte tenu des effets immunomodulateurs de la prostaglandine PGE 2 (soit l’inhibition de la production d’anions superoxydes, la dégranulation, la synthèse de LTB 4 et de cytokines), l’augmentation de l’expression de COX-2 dans le neutrophile est, dès lors, un phénomène clairement anti-inflammatoire. 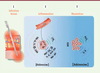 | Figure 2.
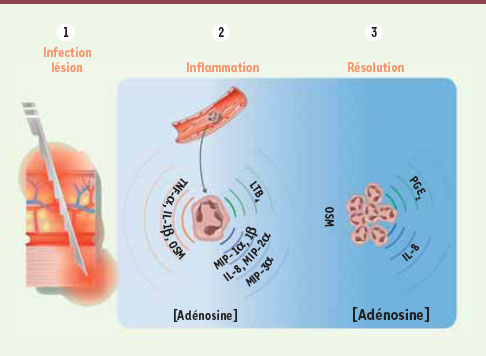
Le changement phénotypique déclenché par l’adénosine dans les neutrophiles. Lors d’une infection ou d’une lésion (1), les premiers neutrophiles qui migrent au site lésé sont des médiateurs importants de l’inflammation (2). Après quelques heures, l’augmentation du nombre de neutrophiles au site inflammatoire s’accompagne d’une accumulation locale importante d’adénosine (3). Ces fortes concentrations d’adénosine provoquent dans le neutrophile une inhibition de ses fonctions anti-infectieuses, une inhibition de la sécrétion des cytokines pro-inflammatoires et des leucotriènes (LTB4), mais également une augmentation de la sécrétion de prostaglandine (PGE2) et d’oncostatine M (OSM) notamment. Ces neutrophiles présentent alors un profil anti-inflammatoire. |
L’adénosine produit aussi un effet majeur sur la sécrétion de cytokines et de chimiokines par le neutrophile activé [
28] : elle inhibe quasi complètement, via A2AR, l’expression et la sécrétion de TNF-α par les neutrophiles stimulés par le LPS. Sont également inhibées CCL3, CCL4, CXCL2 (MIP-2α) et CCL20 (MIP-3α), chimiokines de la famille des MIP (macrophage inflammatory peptides), dans des proportions de 50 à 90 %. L’adénosine semble avoir peu d’effet sur CXCL8, ce qui est en accord avec le peu d’effet du nucléoside sur le mouvement des neutrophiles. Les cibles principales du récepteur A2A dans les PN activés sont donc le TNF-α et les chimiokines de la famille des MIP. Ceci a été confirmé in vivo par le fait que la sécrétion de ces chimiokines est exacerbée chez les souris A2AR−/−
. En accord avec ces observations, dans le modèle des poches d’air dorsales appliqué aux souris A2AR−/−
, on observe une augmentation des ARNm codant TNF-α, CCL3 et CCL4 dans les PN neutrophiles infiltrés dans la poche après une injection de LPS. L’activation du récepteur A2A peut également inhiber la sécrétion de matrix metalloproteinases (MMP), protéines qui participent à la dégradation matricielle, par exemple MMP9 [
29]. En outre, si l’adénosine prévient la sécrétion de cytokines pro-inflammatoires majeures, elle augmente en contrepartie la production de cytokines ayant des propriétés anti-inflammatoires, telles que l’oncostatine M, qui peut inhiber la synthèse de TNF-α en réponse au LPS [
30]. Ainsi les effets anti-inflammatoires de l’adénosine sur le neutrophile ne se traduisent pas uniquement par une inhibition des voies pro-inflammatoires ; il se produit un réel changement dans le profil sécrétoire et phénotypique des PN qui adopte dès lors un profil « d’arrêt » de l’inflammation. Voies intracellulaires influencées par le récepteur A2A
Les voies intracellulaires relayant les activités anti-inflammatoires du récepteur A 2A ne sont pas encore bien décrites. Un des mécanismes possibles semble mettre en jeu l’activation de sérines/thréonines phosphatases qui, à leur tour, inactivent des enzymes importantes dans la cellule [
31]. Le récepteur A 2A est positivement couplé à l’adénylate cyclase et donc à une augmentation de l’AMP cyclique intracellulaire [ 19] ; cela semble constituer l’événement majeur causé par l’adénosine [ 26,
32,
33]. En effet, l’augmentation de l’AMP cyclique intracellulaire, indépendamment de l’activation du récepteur, mime les effets inhibiteurs de l’adénosine, notamment l’augmentation de l’expression de COX-2 [ 26]. La signalisation enclenchée par l’AMP cyclique passe en général par l’activation du facteur de transcription CREB ( cAMP responsive element binding protein) via sa phosphorylation par la protéine kinase A ; CREB pouvant activer directement la transcription de gènes en se fixant sur leur région promotrice contenant un CRE ( cAMP response element) ou en inhiber indirectement d’autres en bloquant le facteur de transcription NF-κB ( nuclear factor-κB) qui contrôle la transcription de nombreuses cytokines pro-inflammatoires (TNF-α, par exemple) [
34]. L’AMP cyclique active également les enzymes p38, PI3K et ERK1/2 [
35]. À noter que ces protéines kinases activent également les voies de signalisation des agonistes pro-inflammatoires, LPS et fMLP ( formyl-Met-Leu-Phe), qui amorcent la synthèse de COX-2 [
36]. L’adénosine via l’augmentation de l’AMP cyclique potentialise ces voies pour augmenter la synthèse de COX-2 et induire alors une synthèse et une sécrétion accrues de PGE 2. La PGE 2 libérée provoque à son tour une augmentation d’AMP cyclique dans le neutrophile ; elle alimente ainsi une boucle que l’on pourrait nommer la boucle d’inhibition du neutrophile. La PGE 2 inhibe non seulement les principales fonctions du neutrophile mais encore la synthèse de LTB 4. Ainsi, cette boucle favorise la synthèse de PGE 2 anti-inflammatoire au détriment de la synthèse de LTB 4 pro-inflammatoire. La Figure 3 résume les mécanismes connus provoqués par l’augmentation de l’AMP cyclique dans le neutrophile. 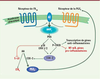 | Figure 3.
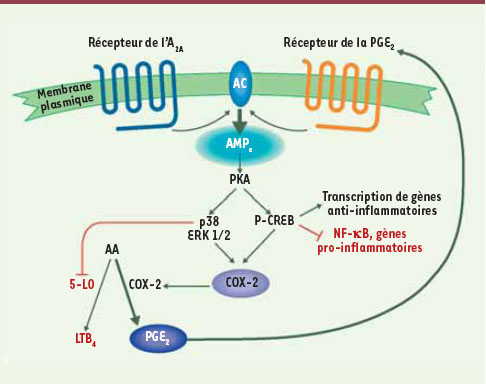
Voies de signalisation aboutissant à l’inhibition des facteurs pro-inflammatoires dans les neutrophiles. L’augmentation de l’AMP cyclique, conséquente à l’activation du récepteur A2A, active les p38 et ERK ½, ainsi que le facteur de transcription CREB en le phosphorylant (P-CREB). Ces mécanismes aboutissent à l’inhibition du facteur de transcription NFκB et à l’activation de la transcription d’autres gènes via le P-CREB, ainsi qu’à l’augmentation des ARNm et de la protéine COX-2, favorisant la synthèse et la sécrétion accrues de PGE2, favorisant encore l’augmentation de l’AMP cyclique. La production de LTB4 est, quant à elle, inhibée via la p38 notamment. Cette boucle explique le changement LTB4/PGE2, ainsi que l’inhibition de la transcription des facteurs pro-inflammatoires dans le neutrophile après l’activation du récepteur A2A. AMPc : adénosine monophosphate cyclique, AA : acide arachidonique, 5-LO : 5-lipoxygénase, AC : adénylate cyclase. |
En plus du changement LTB4/PGE2, c’est un tout nouveau programme génétique qui se met en route après l’activation du récepteur A2A dans le neutrophile. Des travaux en cours dans notre laboratoire étudient, par la technique de puce à ADN et de PCR en temps réel, l’ensemble des gènes modulés par suite de l’activation du récepteur A2A dans le neutrophile humain activé. L’activation du récepteur A2A modifie l’expression d’une vingtaine de gènes reliés aux mécanismes inflammatoires. Ces gènes codent pour des facteurs de transcription, des protéines régulatrices, des récepteurs et des cytokines. L’expression d’un certain nombre de ces gènes est augmentée soulignant encore une fois une réponse active de la cellule et non pas une simple inhibition. |
Le neutrophile, outre les fonctions pro-inflammatoires bien connues qui lui sont attribuées, dispose des outils nécessaires pour limiter l’amplitude et la durée d’une réponse inflammatoire et ainsi enclencher les premières étapes conduisant à un arrêt de l’inflammation. L’exploitation de ces capacités anti-inflammatoires est peut-être la clé de nouvelles stratégies pour le traitement des maladies inflammatoires. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Witko-Sarsat V, Rieu P, Descamps-Latscha B, et al. Neutrophils: molecules, functions and pathophysiological aspects. Lab Invest 2000; 80 : 617–53. 2. Segal AW. How neutrophils kill microbes. Annu Rev Immunol 2005; 23 : 197–223. 3. Gougerot-Pocidalo MA, El Benna J, My-Chan Dang P, et al. Quand les polynucléaires neutrophiles attrapent les agents pathogènes dans leurs filets. Med Sci (Paris) 2007;23 : 464–5. 4. Chakravarti A, Allaeys I, Poubelle PE. Neutrophile et immunité : est-ce inné ou acquis ? Med Sci (Paris) 2007; 23 : 862–7. 5. Cassatella MA. The production of cytokines by polymorphonuclear neutrophils. Immunol Today 1995; 16 : 21–6. 6. Cassatella MA. Neutrophil-derived proteins: selling cytokines by the pound. Adv Immunol 1999; 73 : 369–509. 7. Dinarello CA. Proinflammatory cytokines. Chest 2000; 118 : 503–8. 8. O’Dell JR. Anticytokine therapy: a new era in the treatment of rheumatoid arthritis ? N Engl J Med 1999; 340 : 310–2. 9. Baggiolini M, Dewald B, Moser B. Interleukin-8 and related chemotactic cytokines--CXC and CC chemokines. Adv Immunol 1994; 55 : 97–179. 10. St-Onge M, Flamand N, Biarc J, et al. Characterization of prostaglandin E2 generation through the cyclooxygenase (COX)-2 pathway in human neutrophils. Biochim Biophys Acta 2007;1771 : 1235–45. 11. Hicks A, Monkarsh SP, Hoffman AF, et al. Leukotriene B4 receptor antagonists as therapeutics for inflammatory disease: preclinical and clinical developments. Expert Opin Investig Drugs 2007; 16 : 1909–20. 12. Ham EA, Soderman DD, Zanetti ME, et al. Inhibition by prostaglandins of leukotriene B4 release from activated neutrophils. Proc Natl Acad Sci USA 1983; 80 : 4349–53. 13. Oh-ishi S, Utsunomiya I, Yamamoto T, et al. Effects of prostaglandins and cyclic AMP on cytokine production in rat leukocytes. Eur J Pharmacol 1996; 300 : 255–9. 14. Lawrence T, Gilroy DW. Chronic inflammation: a failure of resolution ? Int J Exp Pathol 2007; 88 : 85–94. 15. Hurst SM, McLoughlin RM, Monslow J, et al. Secretion of oncostatin M by infiltrating neutrophils: regulation of IL-6 and chemokine expression in human mesothelial cells.J Immunol 2002; 169 : 5244–51. 16. Hurst SM, Wilkinson TS, McLoughlin RM, et al. Il-6 and its soluble receptor orchestrate a temporal switch in the pattern of leukocyte recruitment seen during acute inflammation. Immunity 2001; 14 : 705–14. 17. Huynh ML, Fadok VA, Henson PM. Phosphatidylserine-dependent ingestion of apoptotic cells promotes TGF-beta1 secretion and the resolution of inflammation. J Clin Invest 2002;109 : 41–50. 18. Bours MJ, Swennen EL, Di Virgilio F, et al. Adenosine 5’-triphosphate and adenosine as endogenous signaling molecules in immunity and inflammation. Pharmacol Ther 2006;112 : 358–404. 19. Hasko G, Linden J, Cronstein B, et al. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases. Nat Rev Drug Discov 2008; 7 : 759–70. 20. Fortin A, Harbour D, Fernandes M, et al. Differential expression of adenosine receptors in human neutrophils: up-regulation by specific Th1 cytokines and lipopolysaccharide.J Leukoc Biol 2006; 79 : 574–85. 21. Ohta A, Sitkovsky M. Role of G-protein-coupled adenosine receptors in downregulation of inflammation and protection from tissue damage. Nature 2001; 414 : 916–20. 22. Cronstein BN, Naime D, Ostad E. The antiinflammatory mechanism of methotrexate. Increased adenosine release at inflamed sites diminishes leukocyte accumulation in an in vivo model of inflammation. J Clin Invest 1993; 92 : 2675–82. 23. Cronstein BN, Rosenstein ED, Kramer SB, et al. Adenosine: a physiologic modulator of superoxide anion generation by human neutrophils. Adenosine acts via an A2 receptor on human neutrophils. J Immunol 1985; 135 : 1366–71. 24. Flamand N, Boudreault S, Picard S, et al. Adenosine, a potent natural suppressor of arachidonic acid release and leukotriene biosynthesis in human neutrophils. Am J Respir Crit Care Med 2000; 161 : S88–94. 25. Cadieux JS, Leclerc P, St-Onge M, et al. Potentiation of neutrophil cyclooxygenase-2 by adenosine: an early anti-inflammatory signal. J Cell Sci 2005; 118 : 1437–47. 26. Pouliot M, Fiset ME, Masse M, et al. Adenosine up-regulates cyclooxygenase-2 in human granulocytes: impact on the balance of eicosanoid generation. J Immunol 2002; 169 : 5279–86. 27. Surette ME, Krump E, Picard S, et al. Activation of leukotriene synthesis in human neutrophils by exogenous arachidonic acid: inhibition by adenosine A(2a) receptor agonists and crucial role of autocrine activation by leukotriene B(4). Mol Pharmacol 1999; 56 : 1055–62. 28. McColl SR, St-Onge M, Dussault AA, et al. Immunomodulatory impact of the A2A adenosine receptor on the profile of chemokines produced by neutrophils. Faseb J 2006; 20 : 187–9. 29. Ernens I, Rouy D, Velot E, et al. Adenosine inhibits matrix metalloproteinase-9 secretion by neutrophils: implication of A2a receptor and cAMP/PKA/Ca2+ pathway. Circ Res 2006; 99 : 590–7. 30. Wahl AF, Wallace PM. Oncostatin M in the anti-inflammatory response. Ann Rheum Dis 2001; 60 (suppl 3) : 75–80. 31. Revan S, Montesinos MC, Naime D, et al. Adenosine A2 receptor occupancy regulates stimulated neutrophil function via activation of a serine/threonine protein phosphatase. J Biol Chem 1996; 271 : 17114–8. 32. Flamand N, Surette ME, Picard S, et al. Cyclic AMP-mediated inhibition of 5-lipoxygenase translocation and leukotriene biosynthesis in human neutrophils. Mol Pharmacol 2002; 62 : 250–6. 33. Thibault N, Burelout C, Harbour D, et al. Occupancy of adenosine A2a receptors promotes fMLP-induced cyclic AMP accumulation in human neutrophils: impact on phospholipase D activity and recruitment of small GTPases to membranes. J Leukoc Biol 2002; 71 : 367–77. 34. Lukashev D, Ohta A, Apasov S, et al. Cutting edge: physiologic attenuation of proinflammatory transcription by the Gs protein-coupled A2A adenosine receptor in vivo. J Immunol 2004; 173 : 21–4. 35. Schulte G, Fredholm BB. Signalling from adenosine receptors to mitogen-activated protein kinases. Cell Signal 2003; 15 : 813–27. 36. Pouliot M, Gilbert C, Borgeat P, et al. Expression and activity of prostaglandin endoperoxide synthase-2 in agonist-activated human neutrophils. Faseb J 1998; 12 : 1109–23. Pierce A, Legrand D, Mazurier J. La lactoferrine : une protéine multifonctionnelle. Med Sci (Paris) 2009; 25 : 361–9. |