| |
| Med Sci (Paris). 2009 August; 25(8-9): 733–738. Published online 2009 August 15. doi: 10.1051/medsci/2009258-9733.Traitements des accidents vasculaires cérébraux en phase aiguë et prévention secondaire Didier Leys* and Charlotte Cordonnier EA 2691 (troubles cognitifs vasculaires et dégénératifs), Université Lille 2 Service de neurology et pathologie neurovasculaire, CHU de Lille, Hôpital Roger Salengro, 59037 Lille, France |
Traitements en phase aiguë des AVC La prise en charge en phase aiguë, qui a pour objectif de réduire le risque de décès ou de dépendance lorsque l’AVC est installé, comporte des mesures non spécifiques, applicables à tous les types d’AVC, et des mesures spécifiques dépendant de la nature ischémique ou hémorragique identifiée par l’imagerie faite en urgence [
1]. Les mesures détaillées ci-dessous ne concernent pas les accidents ischémiques transitoires (AIT) où la problématique est de mettre en place le plus précocement possible une prévention secondaire adaptée. Mesures non spécifiques Principes généraux L’AVC est une urgence médicale et certaines mesures s’imposent au premier médecin qui prend en charge le patient indépendamment de la nature ischémique ou hémorragique de la lésion. Ces mesures générales sont de trois ordres.
-
Rechercher d’emblée une urgence vitale
Il peut s’agir d’une affection grave simulant un AVC (traumatisme, intoxication, trouble métabolique), d’une étiologie mettant elle-même en jeu le pronostic vital (infarctus du myocarde, dissection aortique), ou d’une complication de l’AVC déjà présente lors du premier contact médical (inhalation, rhabdomyolyse, hypothermie).
-
Assurer le maintien des paramètres physiologiques
L’hypoxie, l’hyper- ou l’hypoglycémie, l’hyperthermie, la baisse du débit cardiaque, l’hypovolémie et les déséquilibres hydro-électrolytiques sont des facteurs aggravant la souffrance cérébrale. Il faut donc les dépister et les traiter par tout moyen approprié. Seule l’élévation initiale de la pression artérielle doit être respectée pendant les premiers jours dans l’ischémie cérébrale et d’une façon générale avant que la nature de l’AVC ne soit identifiée par une imagerie cérébrale : la perte momentanée de l’autorégulation du débit sanguin cérébral expose en effet à une baisse de débit sanguin cérébral en cas de baisse de pression artérielle [
2]. Les seules exceptions à cette règle sont la présence d’une défaillance ventriculaire gauche menaçante, une encéphalopathie hypertensive ou la pratique d’une thrombolyse [ 2]. Dans ces cas exceptionnels, les voies sublinguales et intramusculaires sont proscrites et la préférence est donnée aux traitements oraux ou intraveineux continus [ 2].
-
Prévenir les complications
Cette prévention (dont celle des escarres) nécessite un apport calorique suffisant, au besoin par sonde nasogastrique, une mobilisation précoce, une kinésithérapie et un matelas approprié [ 2]. Les troubles de déglutition nécessitent la pose d’une sonde nasogastrique. Une héparine de bas poids moléculaire doit être prescrite en prévention des thromboses veineuses si un déficit moteur d’un membre inférieur est présent, dès le début dans l’ischémie cérébrale, ou après un délai de 24 à 48 heures dans l’hémorragie. Un traitement antiépileptique peut être nécessaire en cas de crises comitiales. Une rééducation précoce est nécessaire, avec un lever précoce s’il n’y a pas de sténose carotidienne serrée [ 2].
Modalités pratiques : les unités neurovasculaires Les unités neurovasculaires permettent de mettre en route ces mesures non spécifiques. L’instauration de ces mesures entraîne une diminution de la mortalité de 20 % qui concerne les quatre modalités de décès (neurologique, cardiovasculaire, complications de décubitus et décès liés à d’autres causes) [
3]. Cette diminution de la mortalité ne s’accompagne pas d’une augmentation du nombre de patients dépendants (avec perte d’autonomie) [ 3]. Environ 25 patients doivent être traités pour prévenir un décès et 20 patients pour permettre un retour à domicile avec conservation de l’autonomie [ 3]. Le bénéfice de cette diminution de mortalité, indépendant de l’âge, du sexe et de la gravité initiale, se maintient à 10 ans [
4] et n’est pas associé à une augmentation des récidives ou des handicaps à long terme [ 4]. L’effet favorable de ces unités neurovasculaires est sans doute en partie dû à la prise en charge standardisée et spécialisée des patients qui permet des diagnostics plus précis et plus précoces, des investigations plus appropriées et une meilleure prévention des complications [ 3]. Le bénéfice apporté par ces unités a été démontré avant l’introduction des traitements thrombolytiques. La possibilité pour tout patient présentant un AVC d’y être admis est un objectif prioritaire rappelé dans les recommandations européennes sur la prise en charge des AVC [ 2]. Mesures spécifiques Ces mesures dépendent de la nature ischémique ou hémorragique de l’AVC, déterminée par l’imagerie par résonance magnétique (IRM) ou le scanner réalisés en urgence. Ischémie cérébrale
-
Thrombolyse intraveineuse
Le rtPA (recombinant tissue plasminogen activator) administré par voie intraveineuse, augmente la proportion de patients qui sont indépendants à trois mois s’il est prescrit dans les quatre heures trente après le début des signes [
5,
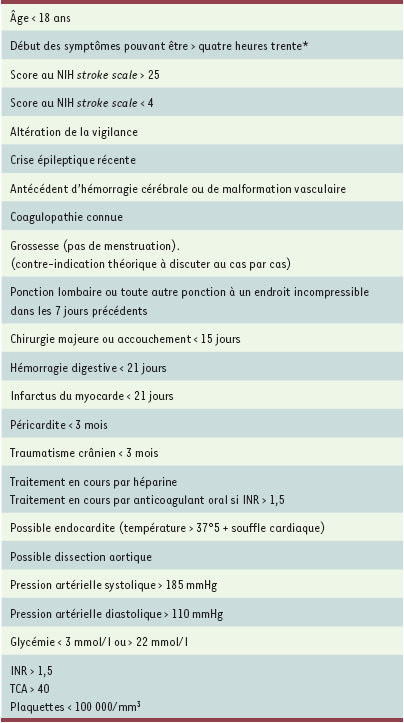
6]. On doit en administrer une dose de 0,9 mg/kg, dont 10 % sont administrés par voie intraveineuse directe et le reste via une seringue autopulsée sur une heure. Le bénéfice de la thrombolyse diminue très fortement au cours du temps et le facteur essentiel d’efficacité et de tolérance est le facteur temps [5]. Le risque de complication hémorragique est majoré en cas de traitement par rtPA, sans toutefois en effacer le bénéfice [5]. Le risque hémorragique augmente avec l’âge, la pression artérielle, l’étendue des lésions reflétant la sévérité du déficit neurologique, l’hyperglycémie et le délai [5]. Les contre-indications au traitement par rtPA sont listées dans le Tableau I.  | Tableau I.
Contre-indications à la thrombolyse intraveineuse dans l’ischémie cérébrale. * Dans le libellé actuel de l’autorisation de mise sur le marché, la limite est encore à trois heures, mais les résultats de ECASS3 incitent à repousser cette limite à quatre heures trente. |
Les registres SITS-MOST (Safe implementation of thrombolysis in stroke monitoring study) [
7] et SITS-ISTR (Safe implementation of thrombolysis in stroke international stroke thrombolysis register) [
8] ont montré que : (1) la proportion de patients ayant une évolution favorable à trois mois, la mortalité à trois mois et le nombre d’hémorragies cérébrales symptomatiques à trente-six heures étaient comparables à ce qui avait été observé dans le groupe rtPA des essais randomisés, et que (2) le profil de tolérance était bon chez les patients traités entre trois heures et quatre heures trente après le début des symptômes [8]. L’administration de rtPA aux patients admis dans les trois heures suivant le début des signes et n’ayant pas de contre-indications telles que celles listées dans le Tableau I est recommandée [2]. L’European Stroke Organisation devrait modifier prochainement cette recommandation pour étendre le délai d’administration du rtPA à quatre heures trente. Les données sur la sélection des patients guidée par IRM, la thrombolyse assistée par ultrasons, la thrombolyse intra-artérielle, la thrombectomie mécanique, le traitement intra-artériel et les molécules diminuant le taux de fibrinogène1 sont encore à un stade préliminaire.
-
Traitements antithrombotiques
Au cours de la phase aiguë, l’aspirine (160 à 300 mg) permet d’éviter 9 récidives ou décès pour 1 000 patients traités [
9,
10]. Les contre-indications étant rares, cet effet faible à l’échelon individuel est important en termes de santé publique [1] en raison du nombre de patients concernés. Quand l’administration de rtPA n’est pas possible ou pas nécessaire, l’administration de 300 mg d’aspirine doit être la plus précoce possible [2]. Les autres antiplaquettaires n’ont jamais été testés en phase aiguë et ne sont donc pas recommandés à ce stade [2]. L’étude IST [10] n’a pas montré d’effet bénéfique de l’administration précoce d’héparine, y compris s’il existe une fibrillation auriculaire. La méta-analyse des essais d’héparine de bas poids moléculaire ou équivalent [
11], ainsi que l’étude TAIST [
12], postérieure à cette méta-analyse, ont montré une réduction d’incidence de phlébites et d’embolies pulmonaires, mais au prix d’un excès d’hémorragies cérébrales. Dans la fibrillation auriculaire, les résultats sont identiques [
13]. Il n’y a donc pas de base scientifique à une prescription large d’héparine en phase aiguë de l’ischémie cérébrale, y compris dans la fibrillation auriculaire, où l’anticoagulation peut être différée de quelques jours. La réduction du risque de récidive ischémique précoce est contrebalancée par un excès d’hémorragies [12].
Les indications de la chirurgie en phase aiguë de l’ischémie cérébrale sont très limitées. Elles comportent d’une part la dérivation ventriculaire ou la chirurgie par abord direct dans les infarctus pseudo-tumoraux du cervelet, et d’autre part l’hémicraniectomie décompressive dans les infarctus étendus (145 cm3 d’anomalie de diffusion ou plus en IRM, ou équivalent en scanner) du territoire de l’artère cérébrale moyenne chez des sujets de moins de soixante ans [
14]. Cette chirurgie doit être effectuée avant que l’effet de masse ne soit patent et permet d’éviter un décès pour deux malades opérés, sans augmenter la proportion de patients en état de dépendance totale [14]. Hémorragie cérébrale
-
Traitement antihypertenseur
une réduction de la pression artérielle en phase aiguë permet en théorie d’éviter la croissance du volume de l’hémorragie et de réduire le risque de nouveau saignement, mais aussi de diminuer la pression de perfusion cérébrale. Les recommandations sur la prise en charge de l’élévation de la pression artérielle en phase aiguë sont empiriques en l’absence d’essais cliniques randomisés [
15]. Chez les patients ayant une hypertension artérielle préalable, il est recommandé de maintenir la valeur de pression artérielle en dessous de 180/105 mmHg et d’avoir pour objectif une pression artérielle de 170/100 mmHg [
16]. En l’absence d’hypertension artérielle préalable, il est recommandé de maintenir la valeur de pression artérielle en dessous de 160/95 mmHg avec un objectif de 150/90 [ 16]. Le labetalol et l’enalapril - mis à part l’urapidil intra-veineux - sont les traitements les plus utilisés [ 16].
-
Traitement de l’hypertension intracrânienne
En théorie, l’évacuation chirurgicale de l’hémorragie permet de réduire l’hypertension intracrânienne, mais les essais randomisés n’ont pas montré de bénéfice dans les hémorragies cérébrales qui ne sont pas liées à une malformation vasculaire [
17].
-
Traitement hémostatique
Chez les patients dont la coagulation est normale, le facteur VII recombinant peut en théorie favoriser la coagulation au site de rupture vasculaire mais il peut aussi favoriser les thromboses. Malgré un essai de phase 2b prometteur [
18], ce traitement n’a pas fait preuve d’efficacité lors d’un essai de phase 3 [
19]. Chez les patients présentant une hémorragie cérébrale alors qu’ils sont sous traitement anticoagulant oral, il est recommandé de normaliser l’INR ( international normalized ratio)
2 en urgence dès que celui-ci est supérieur à 1,4 en administrant du plasma frais congelé ou des complexes prothrombiniques (PPSB) ; mais il n’y a pas à ce jour d’essai randomisé comparant ces différentes approches.
|
Elle repose sur trois stratégies complémentaires :
-
une prise en charge optimale des facteurs de risque vasculaires (tous types d’AVC, et AIT) ;
-
un traitement antithrombotique (AIT et infarctus cérébraux) ;
-
un traitement de la cause présumée (tous types d’AVC et AIT).
Correction des facteurs de risque Hypertension artérielle En prévention secondaire, le perindopril (4 mg/jour) avec ou sans indapamide (2 à 2,5 mg/jour) réduit le risque absolu d’AVC de 1 % par an [
20], et celui de tout événement vasculaire de 1,3 % par an [ 20]. La pression artérielle doit donc être diminuée en prévention secondaire même quand elle est normale avant ou à distance de l’infarctus cérébral, de préférence par un inhibiteur de l’enzyme de conversion de l’angiotensine, un diurétique, ou les deux, mais la valeur optimale à atteindre n’est pas connue et il convient d’être prudent en cas d’occlusion carotidienne ou de sténose serrée [ 2]. Hypercholestérolémie Plusieurs essais randomisés comparant une statine à un placebo avaient montré une réduction de 30 % du risque d’AVC chez les patients traités par statine pour une pathologie coronaire ou une hypercholestérolémie. En prévention secondaire, l’atorvastatine (80 mg/jour) réduit le risque de nouvel AVC, malgré une très légère augmentation des hémorragies cérébrales et un risque faible de rhabdomyolyse [
21]. Tabagisme Si parmi les 2 400 patients ayant un AVC ou un AIT dans une population d’un million d’habitants un sevrage était observé chez les fumeurs, 84 (3,5 %) récidives d’AVC seraient évitées par an [ 1]. Autres facteurs de risque Chez le diabétique, une prise en charge optimale de tous les autres facteurs de risque est recommandée [ 2]. Les estrogènes (contraception orale ou traitement hormonal substitutif) ne sont pas recommandés après un infarctus cérébral ou un AIT [ 2]. L’obésité, la consommation excessive d’alcool, l’élévation de l’hématocrite et l’hyperhomocystéinémie sont des facteurs de risque d’infarctus cérébral, mais l’effet préventif de leur correction n’est pas établi [ 2]. Traitements antithrombotiques Ils ne sont indiqués que dans les ischémies cérébrales ou les AIT. Antiplaquettaires
-
En l’absence de cardiopathie emboligène
L’aspirine a fait la preuve de son efficacité dans cette indication, dans plusieurs essais, les posologies allant de 50 à 1 300 mg par jour [
22] : elle réduit le risque de mort par accident vasculaire, d’accident ischémique cérébral constitué et d’infarctus du myocarde. En Europe, la dose la plus utilisée en milieu neurologique est de 50 à 325 mg par jour car la tolérance est meilleure. Le clopidogrel (75 mg/jour) [
23] et l’association de l’aspirine (50 mg) et du dipyridamole retard (400 mg) [
24] sont tous deux un peu plus efficaces que l’aspirine en prévention secondaire et leur comparaison directe n’a pas montré de supériorité significative de l’une des deux stratégies [
25]. L’association clopidogrel-aspirine n’est pas supérieure au clopidogrel seul, en raison d’un risque hémorragique supérieur [
26], mais elle est indiquée en cas de stent coronaire récent ou de syndrome coronaire aigu récent [2]. En pratique, en dehors de la phase aiguë et dans les pays où cela est possible, il est préférable d’avoir recours au clopidogrel seul ou à l’association de l’aspirine (50 mg) et du dipyridamole retard (400 mg) en première intention, le choix dépendant de la tolérance, des pathologies associées et du coût [2].
-
En présence d’une fibrillation auriculaire non valvulaire
Les anticoagulants ont une supériorité nette sur l’aspirine [
27] en prévention secondaire, cette dernière n’étant, de ce fait, qu’une alternative à l’anticoagulation en cas de contre-indication majeure [2]. Anticoagulants oraux
-
En présence d’une cardiopathie emboligène (fibrillation auriculaire)
Chez des patients qui avaient eu un AIT ou un accident mineur dans les trois mois précédents, les anticoagulants (INR cible de 2 à 3) permettent une réduction de 50 % du risque de décès d’origine vasculaire, d’AVC non fatal, d’infarctus du myocarde non fatal et d’embolie systémique, et le risque de tout AVC est réduit de 12 % à 4 % par an [27]. Ainsi, les anticoagulants oraux sont-ils recommandés à chaque fois que cela est possible [2].
Un traitement anticoagulant par voie orale est généralement recommandé chez les patients ayant présenté une ischémie cérébrale associée à un déficit congénital ou acquis des inhibiteurs de la coagulation, à un syndrome des antiphospholipides ou à une dissection extracrânienne, mais cette attitude est empirique et ne repose sur aucun essai randomisé [2]. Les quelques études consacrées aux accidents athérothrombotiques n’ont pas montré de bénéfice des antivitamines K qui exposent à un risque hémorragique important lorsque l’INR est supérieur à 3, le patient âgé de plus de soixante-quinze ans et en présence d’une leucoaraïose (anomalies de la substance blanche diffuses et confluentes observées à l’imagerie cérébrale). Traitement de la cause de l’AVC Chirurgie carotide Les deux déterminants majeurs du risque d’infarctus cérébral homolatéral à une sténose carotide sont : d’une part son caractère symptomatique, défini sur des arguments cliniques, et d’autre part un degré élevé de sténose. Celui-ci fut quantifié par angiographie dans les deux études randomisées de prévention secondaire [
28,
29]. Malgré des différences dans la sélection des patients, des sténoses, des chirurgiens, dans la méthode de mesure des sténoses et dans les critères de jugement, leurs résultats sont parfaitement concordants [ 28, 29] : (1) le bénéfice de la chirurgie apparaît quels que soient le sexe et le type d’événement qualifiant, pour une sténose symptomatique de plus de 70 % (mesure NASCET 3) ; (2) un bénéfice plus faible est également observé pour une sténose symptomatique de 50 à 70 % (mesure NASCET), sauf chez la femme ou lorsque l’événement qualifiant est rétinien ; (3) la chirurgie n’apporte pas de bénéfice pour les sténoses inférieures à 50 % (mesure NASCET) ; (4) le bénéfice de la chirurgie est maximal quand elle est effectuée dans les deux semaines qui suivent l’événement et devient nul après trois à six mois [
30]. Angioplastie carotide Malgré des avantages théoriques et l’absence d’incision cervicale, aucun essai n’a à ce jour pu prouver la non-infériorité de l’angioplastie sur la chirurgie, et une étude a même montré un taux d’événements ischémiques ipsilatéraux supérieurs en cas d’angioplastie [
31] avec ensuite une équivalence sur le long terme entre angioplastie et chirurgie [
32]. En attendant que la morbi-mortalité de la procédure puisse être équivalente à celle de la chirurgie, l’angioplastie n’est pas recommandée en routine, et la chirurgie reste la technique de référence. Elle ne doit être pratiquée que chez des patients ayant une excellente indication pour la chirurgie, mais une contre-indication d’ordre technique [ 2]. Traitement des malformations vasculaires intracrâniennes Les options thérapeutiques dans le cas de cavernomes, malformations artério-veineuses et fistules artério-veineuses dépendent de la nature, du siège, et de la taille de ces malformations, et reposent sur des décisions individuelles en l’absence d’essai randomisé. |
En termes de service rendu à la population, les deux mesures prioritaires consistent à développer des unités neurovasculaires et, grâce à l’éducation du public et des soignants, faire entrer dans la pratique les mesures non spécifiques simples de prise en charge dans la phase aiguë d’un AVC. Si l’AVC est ischémique, les patients doivent ensuite recevoir un traitement par rtPA si les critères requis sont réunis. Dans le cas contraire, de l’aspirine (300 mg) doit être administrée dès que l’imagerie a écarté une hémorragie. Si l’AVC est hémorragique, un contrôle plus strict des chiffres tensionnels est recommandé en phase aiguë ainsi qu’une correction des troubles de coagulation si besoin. À distance, dans les accidents ischémiques, l’aspirine peut être prescrite à dose plus faible, ou mieux, le clopidogrel ou l’association aspirine-dipyridamole selon la tolérance, les pathologies associées et le coût, ou bien encore un antivitamine K en présence d’une cardiopathie à haut risque embolique. L’endartérectomie est nécessaire chez des patients sélectionnés sur la base de critères cliniques et d’imagerie. Dans tout type d’AVC, les facteurs de risque modifiables doivent être supprimés ou traités. |
Didier Leys a participé à des essais thérapeutiques industriels (> 5 ans) pour Sanofi Aventis/BMS : Active (End point Committee), CASTIA (Steering Committee), BOREALIS (investigateur) ; Boeringher-Ingelheim : PERFORM (co-investigateur), ECASS3 (investigateur) ; AstraZeneca : CHANT, SAINT (investigateur et coordinateur national) ; Servier : PERFORM (End point committee) ; Ebewe : CASTA (DSMB). Didier Leys a participé à des advisory boards ou a été orateur à des symposia (> 3 ans) pour Sanofi Aventis/BMS, Novonordisk, Boeringher-Ingelheim. Charlotte Cordonnier a participé à des essais thérapeutiques industriels (> 5 ans) pour Sanofi Aventis/BMS : BOREALIS (investigateur).
|
Footnotes |
1. Hankey GJ, Warlow CP. Treatment and secondary prevention of stroke: evidence, costs, and effects on individuals and populations. Lancet 1999; 354 : 1457–63. 2. Guidelines for management of ischaemic stroke and transient ischaemic attack. Cerebrovasc Dis 2008; 25 : 457–507. 3. Langhorne P, Dennis MS. Stroke units, an evidence based approach. London : BMJ Publishing Group, 1998. 4. Indredavik B, Bakke F, Slordahl SA, et al. Stroke unit treatment. 10-year follow-up. Stroke 1999; 30 : 1524–7. 5. Hacke W, Donnan G, Fieschi C, et al. Association of outcome with early stroke treatment: pooled analysis of ATLANTIS, ECASS, and NINDS rt-PA stroke trials. Lancet 2004; 363 : 768–74. 6. Hacke W, Kaste M, Bluhmki E, et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008; 359 : 1317–29. 7. Wahlgren N, Ahmed N, Davalos A, et al. Thrombolysis with alteplase for acute ischaemic stroke in the Safe Implementation of thrombolysis in stroke-monitoring study (SITS-MOST): an observational study. Lancet 2007; 369 : 275–82. 8. Wahlgren N, Ahmed N, Davalos A, et al. Thrombolysis with alteplase 3-4.5 h after acute ischaemic stroke (SITS-ISTR): an observational study. Lancet 2008; 372 : 1303–9. 9. CAST. Randomised placebo-controlled trial of early aspirin use in 20,000 patients with acute ischaemic stroke. CAST (Chinese acute stroke trial) Collaborative Group. Lancet 1997; 349 : 1641–9. 10. International-Stroke-Trial-Collaborative-Group. The International Stroke Trial (IST): a randomised trial if aspirin, subcutaneous heparin, both, or neither among 19435 patients with acute ischaemic stroke. Lancet 1997; 349 : 1569–81. 11. Bath PM, Iddenden R, Bath FJ. Low-molecular-weight heparins and heparinoids in acute ischemic stroke: a meta-analysis of randomized controlled trials. Stroke 2000; 31 : 1770–8. 12. Bath PM, Lindenstrom E, Boysen G, et al. Tinzaparin in acute ischaemic stroke (TAIST): a randomised aspirin-controlled trial. Lancet 2001; 358 : 702–10. 13. Berge E, Abdelnoor M, Nakstad PH, Sandset PM. Low molecular-weight heparin versus aspirin in patients with acute ischaemic stroke and atrial fibrillation: a double-blind randomised study. HAEST Study Group. Heparin in Acute Embolic Stroke Trial. Lancet 2000; 355 : 1205–10. 14. Vahedi K, Hofmeijer J, Jüttler E, et al. Early decompressive surgery in malignant infarction of the middle cerebral artery: a pooled analysis of three randomised controlled trials. Lancet Neurol 2007; 6 : 215–22. 15. Anderson CS, Huang Y, Wang JG, et al. Intensive blood pressure reduction in acute cerebral haemorrhage trial (INTERACT): a randomised pilot trial. Lancet Neurol 2008; 7 : 391–9. 16. Steiner T, Kaste M, Forsting M, et al. Recommendations for the management of intracranial haemorrhage. Part I: spontaneous intracerebral haemorrhage. The European stroke initiative writing committee and the writing committee for the EUSI executive committee. Cerebrovasc Dis 2006; 22 : 294–316. 17. Mendelow AD, Gregson BA, Fernandes HM, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International surgical trial in intracerebral haemorrhage (STICH): a randomised trial. Lancet 2005; 365 : 387–97. 18. Mayer SA, Brun NC, Begtrup K, et al. Recombinant activated factor VII for acute intracerebral hemorrhage. N Engl J Med 2005; 352 : 777–85. 19. Mayer SA, Brun NC, Begtrup K, et al. Efficacy and safety of recombinant activated factor VII for acute intracerebral hemorrhage. N Engl J Med 2008; 358 :2127–37. 20. PROGRESS collaborative group. Randomised trial of a perindopril-based blood-pressure-lowering regimen among 6,105 individuals with previous stroke or transient ischaemic attack. Lancet 2001; 358 : 1033–41. 21. Amarenco P, Bogousslavsky J, Callahan A, et al. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006; 355 : 549–59. 22. Algra A, van Gijn J. Cumulative meta-analysis of aspirin efficacy after cerebral ischaemia of arterial origin. J Neurol Neurosurg Psychiatry 1999; 66 : 255. 23. CAPRIE Steering Committee. A randomised, blinded trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996; 348 : 1329–39. 24. Algra A. Medium intensity oral anticoagulants versus aspirin after cerebral ischaemia of arterial origin (ESPRIT): a randomised controlled trial. Lancet Neurol 2007; 6 : 115–24. 25. Sacco RL, Diener HC, Yusuf S, et al. Aspirin and extended-release dipyridamole versus clopidogrel for recurrent stroke. N Engl J Med 2008; 359 : 1238–51. 26. Diener H, Bogousslavsky J, Brass L, et al. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo-controlled trial. Lancet 2004; 364 : 331–7. 27. EAFT (European Atrial Fibrillation Trial) Study Group. Secondary prevention in non-rheumatic atrial fibrillation after transient ischaemic attack or minor stroke. Lancet 1993; 342 : 1255–62. 28. The North American Symptomatic Carotid Endarterectomy Trial Collaborators. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis. North American symptomatic carotid endarterectomy trial collaborators. N Engl J Med 1991; 325 : 445–53. 29. The European Carotid Surgery Trialists Collaborative Group. Risk of stroke in the distribution of an asymptomatic carotid artery. Lancet 1995; 345 : 209–12. 30. Rothwell P, Eliasziw M, Gutnikov S, et al., for the Carotid Endarterectomy Trialists Collaboration. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet 2004; 363 : 915–24. 31. Mas JL, Chatellier G, Beyssen B, et al. Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis. N Engl J Med 2006; 355 : 1660–71. 32. Mas JL, Trinquart L, Leys D, et al. Endarterectomy versus angioplasty in patients with symptomatic severe carotid stenosis (EVA-3S) trial: results up to 4 years from a randomised, multicentre trial. Lancet Neurol 2008; 7 : 885–92. |