| |
| Med Sci (Paris). 2010 January; 26(1): 25–28. Published online 2010 January 15. doi: 10.1051/medsci/201026125.Nétrine et cellules souches, attirance ou répulsion ? Audrey Petit* University of Washington, Department of neurosurgery, 325, 9th avenue, Box 359655, Seattle, WA 98104, Etats-Unis MeSH keywords: Adulte, Animaux, Astrocytes, physiologie, Mouvement cellulaire, Cellules cultivées, transplantation , Techniques de coculture, Éphrine B3, Protéines Hedgehog, Humains, Protéines et peptides de signalisation intercellulaire |
On dénombrerait à l’échelle de la planète quelque 2,5 millions de personnes atteintes d’une lésion handicapante de la moelle épinière (ME) causée par un accident. Chaque année, on compte plus de 130 000 nouvelles victimes, principalement de jeunes adultes. Les handicaps fonctionnels varient selon le niveau de la blessure. Malgré des progrès importants dans la compréhension des mécanismes de ces lésions, celles-ci demeurent permanentes, offrant très peu d’espoir de réhabilitation [
1]. Un traumatisme de la ME produit un kyste, c’est-à-dire une zone nécrosée remplie de liquide, isolée du tissu sain par une cicatrice gliale, barrière physique et moléculaire formée par les astrocytes réactifs qui s’opposent à la régénération axonale et au remplacement des cellules neurales perdues [
2]. Les recherches actuelles visent à neutraliser les actions inhibitrices de la cicatrice gliale et à combler la zone cystique par la création d’un substrat permissif [
3]. |
Cellules souches neurales dans le système nerveux central et la moelle épinière La découverte de l’existence de cellules souches neurales (CSN) dans la ME des mammifères adultes, y compris l’espèce humaine, a suscité de nouvelles perspectives thérapeutiques [
4,
5]. Les CSN, douées d’autorenouvellement, peuvent, in vitro, donner naissance aux trois principaux types cellulaires composant le système nerveux central (SNC) : les neurones et les cellules gliales, astrocytes et oligodendrocytes (Figure 1A). Dans la ME, ces CSN sont localisées autour du canal épendymaire et elles se différencient exclusivement en cellules gliales. Les études effectuées chez l’animal démontrent que les CSN ont la faculté de se reproduire à l’épicentre d’une hémisection de la ME, mais ne se fixent pas dans cette zone inhospitalière et vont plutôt s’en éloigner [
6], obstacle de taille à l’usage de ces cellules en médecine régénérative.
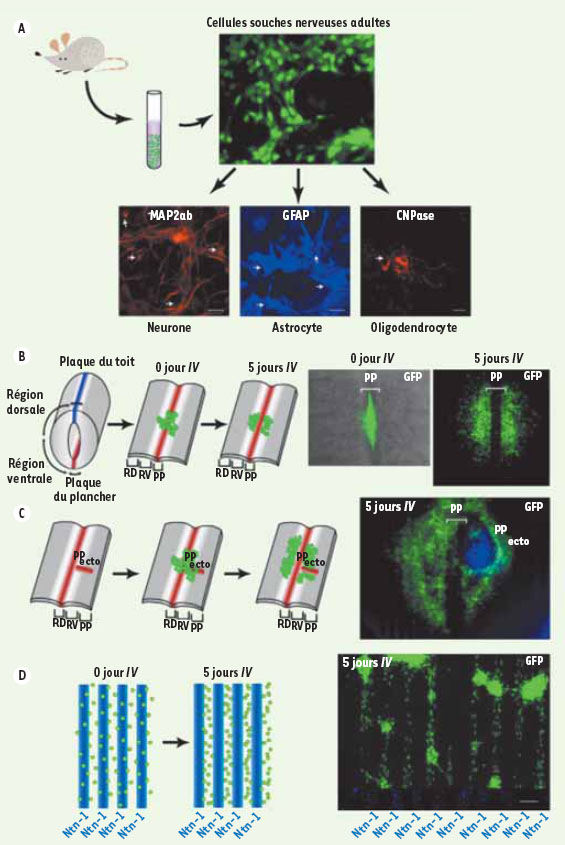
 | Figure 1.
Différenciation et migration des cellules souches neurales adultes. A. Les CSN sont isolées à partir de la moelle épinière de souris transgéniques adultes exprimant la protéine fluorescente verte (GFP). Les CSN prolifèrent en présence des facteurs de croissance EGF (epidermal growth factor) et FGF (fibroblast growth factor). Elles sont multipotentes et, cultivées dans les bonnes conditions, elles se différencient en neurones, astrocytes ou oligodendrocytes. B. Le tube neural d’embryons de souris de 12 jours a été coupé suivant la ligne médiane dorsale et ensuite sectionné pour obtenir des tranches organotypiques. Les CSN ont été positionnées au niveau de la plaque du plancher (PP) ; après 5 jours in vitro (IV), elles migrent de chaque côté de la PP. C. Lorsque des explants de la PP sont placés dans des positions ectopiques (ecto), les CSN établissent invariablement un nouveau chemin de migration. D. Les CSN cultivées sur un substrat de nétrine-1 (Ntn-1) disposé en rayures alternantes sont repoussées lorsqu’elles entrent en contact avec cette protéine. Échelle : 100 µm. |
Chez les rongeurs adultes, ces cellules ont une migration très limitée in vivo. Dans le système nerveux central, seules deux voies de migration ont été définies : les cellules progénitrices nées des CSN de la zone sous-ventriculaire migrent suivant le courant de migration rostrale, route unidirectionnelle menant aux bulbes olfactifs, et celles nées de la zone sous-granulaire migrent sur une courte distance dans la couche de cellules granulaires du gyrus dentelé [
7]. Les mécanismes et les signaux qui orientent la migration des CSN adultes sont peu connus. Toutefois, lors du développement du SN, la migration des neuroblastes est régulée par l’intégration spatiotemporelle de signaux moléculaires attractifs ou répulsifs, dont les protéines des familles nétrines, slit, éphrines et sémaphorines [
8,
9]. Or ces molécules continuent d’être exprimées chez l’adulte. |
Guidage et migration des cellules souches neurales de la moelle épinière Dans notre laboratoire, nous avons cherché à analyser la réponse des CSN de la ME adulte à ces signaux de guidage qui interviennent lors du développement neural [
10]. L’expression de plusieurs de ces molécules varie en réponse à une lésion, mais leurs fonctions et les conséquences de ces variations restent méconnues. La plaque du plancher (PP) du tube neural (TN) est une région clé de l’expression de ces signaux au cours du développement. Nous avons établi un modèle simple de coculture de tranches organotypiques du TN embryonnaire de la souris et de CSN adultes pour tester les réactions de celles-ci aux signaux endogènes (Figure 1B). Les CSN adultes étudiées ont été isolées à partir de la ME complète de souris transgéniques exprimant la protéine fluorescente verte (GFP). D’emblée, nous avons observé dans ce système que les CSN s’éloignaient de la PP, en suivant un chemin de migration invariable, latéral à la PP. Nous proposons deux explications à cette migration : soit les CSN sont soumises à une action répulsive de la PP, soit elles sont attirées par le neuroépithélium ventral. En plaçant les explants de la PP dans des positions ectopiques, nous avons démontré que l’hypothèse de la répulsion des CSN par la PP doit être retenue (Figure 1C). Les CSN répondent donc à un signal répulsif exprimé dans la PP. |
Identification de la nétrine à l’origine d’un signal répulsif Afin d’identifier les molécules en cause, nous avons perturbé l’expression de molécules de guidage dans la PP, dont la Nétrine-1 (Ntn-1), Slit2, l’éphrine-B3 et Sonic hedgehog, ou bien celle de leurs récepteurs, DCC (deleted in colorectal cancer), Néogénine, UNC5, Robo, EphB1 et EphB3, par les CSN. Les stratégies de perturbation utilisaient des anticorps, des ARN interférents et des tranches organotypiques de tissus transgéniques. Parmi ces signaux, seule la Ntn-1 s’est avérée capable de provoquer l’effet répulsif recherché (Figure 1D). Ntn-1 est reconnue pour son rôle majeur dans le guidage axonal au cours du développement neural. Plus récemment, de nouvelles fonctions lui ont été attribuées dans l’expression de diverses propriétés, adhérence, motilité, prolifération, différenciation, survie cellulaires et angiogenèse et, plus récemment, migration des CSN [
11]. Ntn-1 s’est révélée être l’élément clé de la migration des CSN puisque son inhibition, à elle seule, freine la formation du chemin de migration des cellules, latéral au PP. Serait-il possible que Ntn-1, dont l’expression augmente au site de la lésion lors d’une hémisection de la ME, participe à la migration des CSN hors du site de la lésion [
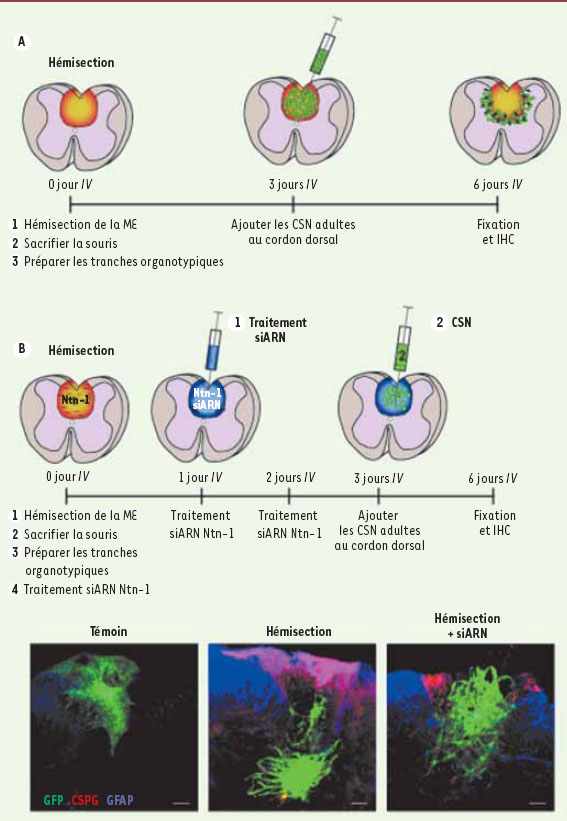
12] ? Notre modèle in vitro de tranches organotypiques préparées à partir de la ME lésée de souris adultes et mises en coculture avec des CSN de la ME reproduit le microenvironnement d’une lésion (Figure 2A). Les CSN ont reproduit le comportement observé in vivo, migrant hors de la région lésée. Si l’on diminue l’expression de Ntn-1 ou si l’on bloque la fonction de l’un de ses récepteurs, les CSN restent au niveau du site de la lésion démontrant une action directe de Ntn-1 (Figure 2B).
 | Figure 2.
Un modèle
in vitro
de lésion de la moelle épinière (ME). A. Après hémisection de la ME de souris adultes, la ME a été disséquée et sectionnée pour obtenir des tranches organotypiques en coupe transversale. Les CSN sont positionnées au niveau du cordon dorsal et migrent hors de la zone de lésion. B. Après hémisection, un traitement des tranches organotypiques avec des ARN interférents (si-ARN) contre Ntn-1 bloque la répulsion des CSN par la zone lésée, région délimitée par les astrocytes réactifs (glial fibrillary acidic protein) et l’expression de chondroïtine sulfate (chondroitin sulfate proteoglycan, CSPG). L’absence de répulsion dans la situation témoin est en accord avec notre démonstration d’une intervention de Ntn-1 dont l’expression augmente au site de la lésion après une hémisection. IHC : immunohistochimie. Échelle : 100 µm. |
Ces résultats établissent clairement le rôle de Ntn-1 en tant qu’agent répulsif des CSN. Nous proposons donc une approche novatrice pour remodeler le centre de la lésion chez les souris : bloquer l’expression de Ntn-1 afin de permettre aux CSN de demeurer au site de la lésion. Le centre de la lésion serait alors occupé par des CSN ayant la capacité de se différencier en cellules gliales créant un microenvironnement favorable à la survie neuronale et à la régénération axonale. Dans l’ensemble, nos travaux contribuent à mieux comprendre les mécanismes d’action des molécules de signalisation endogène qui affectent la mobilité des CSN adultes dans le SNC sain ou lésé. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Schwab JM, Brechtel K, Mueller CA, et al. Experimental strategies to promote spinal cord regeneration-an integrative perspective. Prog Neurobiol 2006; 78 : 91–116. 2. Silver J, Miller JH. Regeneration beyond the glial scar. Nat Rev Neurosci 2004; 5 : 146–56. 3. Eftekharpour E, Karimi-Abdolrezaee S, Fehlings MG. Current status of experimental cell replacement approaches to spinal cord injury. Neurosurg Focus 2008; 24 : E19. 4. Weiss S, Dunne C, Hewson J, et al. Multipotent CNS stem cells are present in the adult mammalian spinal cord and ventricular neuroaxis. J Neurosci 1996; 16 : 7599–609. 5. Dromard C, Guillon H, Rigau V, et al. Adult human spinal cord harbors neural precursor cells that generate neurons and glial cells in vitro. J Neurosci Res 2008; 86 : 1916–26. 6. Ke Y, Chi L, Xu R, et al. Early response of endogenous adult neural progenitor cells to acute spinal cord injury in mice. Stem Cells 2006; 24 : 1011–9. 7. Hagg T. Molecular regulation of adult CNS neurogenesis: an integrated view. Trends Neurosci 2005; 28 : 589–95. 8. Tessier-Lavigne M, Goodman CS. The molecular biology of axon guidance. Science 1996; 274 : 1123–33. 9. Chedotal A, Renaud J. Nucleus translocation in migrating neurons: key control by Sema6A and plexin A2. Med Sci (Paris) 2008; 24 : 797–8. 10. Petit A, Sellers DL, Liebl DJ, et al. Adult spinal cord progenitor cells are repelled by netrin-1 in the embryonic and injured adult spinal cord. Proc Natl Acad Sci USA 2007; 104 : 17837–42. 11. Mehlen P, Rama N. Netrin-1 and axonal guidance: signaling and asymmetrical translation. Med Sci
(Paris) 2007; 23 : 311–5. 12. Wehrle R, Camand E, Chedotal A, et al. Expression of netrin-1, slit-1 and slit-3 but not of slit-2 after cerebellar and spinal cord lesions. Eur J Neurosci 2005; 22 : 2134–44. |