| |
| Med Sci (Paris). 2010 February; 26(2): 128–130. Published online 2010 February 15. doi: 10.1051/medsci/2010262128.Les multiples fonctions des protéines lipolytiques à domaine patatine Thierry Heitz* Institut de biologie moléculaire des plantes (IBMP-CNRS), 12, rue du Général Zimmer, 67084 Strasbourg Cedex, France |
Les glycérolipides sont utilisés abondamment dans les édifices cellulaires. Ainsi, ils s’organisent en membranes lipidiques (phospho- ou galacto-lipides) délimitant les compartiments subcellulaires ou constituent des sites de stockage de réserves énergétiques (triglycérides). Ces lipides sont constamment remaniés par une cohorte d’enzymes hydrolytiques en réponse à des signaux environnementaux ou encore en fonction de l’état nutritionnel de l’organisme. Les progrès récents de la génomique ont conduit à l’identification de nombreuses protéines qui partagent un domaine appellé « patatine », décrit initialement dans la protéine de réserve principale du tubercule de pomme de terre, d’où son nom. Le fait remarquable est que ce domaine catalytique (Pfam 01734) a ensuite été détecté dans l’ensemble du monde vivant, incluant des bactéries, levures, nématodes, insectes, plantes et vertébrés. Plus particulièrement, différentes formes de ce domaine conservé d’environ 180 acides aminés confèrent des activités lipolytiques étonnament variables, puisque capables de libérer des acides gras à partir de phospholipides, lysophospholipides, triglycérides, galactolipides ou même d’esters de rétinol. D’autre part, la signature patatine est souvent associée à d’autres domaines fonctionnels, reflétant des sites et modes d’action multiples. Il apparaît maintenant que ces protéines, en ciblant divers lipides, exercent des fonctions distinctes dans des processus aussi variés que la virulence bactérienne, l’homéostasie lipidique, l’exécution de la mort cellulaire ou encore la croissance post-germinative. |
Les enzymes lipases à domaine patatine orchestrent la gestion des réserves lipidiques Cet article fait écho à une synthèse publiée dans ce même numéro de Médecine/Sciences (→) [
13] et qui traite des données récentes concernant les activités et fonctions physiologiques des protéines à domaine patatine chez les mammifères, appelées peu judicieusement PNPLA (patatin domain phospholipase), puisque toutes ne présentent pas une activité phospholipase. Le génome humain contient par exemple 9 gènes codant des protéines PNPLA, se répartissant en 3 sous-familles représentées par les lysophospholipases de type neuropathy target esterase (NTE), les phospholipases A2 calcium-indépendantes de type iPLA2β et γ, et les acylglycérol lipases/transacylases de type adipose triglyceride lipase (ATGL) et adiponutrine [
1]. Ces deux dernières protéines ont été particulièrement étudiées et sont maintenant reconnues comme des enzymes majeures dans la gestion anabolique et catabolique des réserves de triglycérides, notamment en réponse à l’insuline dans les adipocytes [
2]. Il est important de noter que des mutations ont été détectées dans ces 3 types de PNPLA et sont responsables de plusieurs pathologies humaines entraînant des défauts dans l’homéostasie lipidique, des troubles de l’ostéogenèse ou des dysfonctionnements neurologiques.
(→) voir l’article de S. Baulande et C. Langlois, page 177 de ce numéro
Peu après l’identification de la lipase ATGL [
3], des orthologues ont été isolés chez la drosophile, lipase Brummer ou bmm [
4], et chez la levure, Tgl3 et Tgl4 [
5], et leur inactivation génétique conduit à l’accumulation excessive de triglycérides, montrant que chez ces organismes également, des PNPLA sont directement impliquées dans la mobilisation de lipides de réserve. Chez les végétaux, la patatine a été découverte dans les tubercules de pomme de terre il y a plusieurs décennies [
6], et des formes moins abondantes l’ont été dans les parties aériennes de nombreuses espèces végétales, notamment en situation de stress. L’identification de SDP1 (sugar-dependent
1), une TAG lipase faiblement reliée à la patatine mais jouant un rôle majeur dans la mobilisation des réserves nécessaire à la croissance post-germinative chez la plante modèle Arabidopsis thaliana est relativement récente [
7]. Cette espèce, comme toutes les plantes dotées de graines oléagineuses, utilise la dégradation de triglycérides et la β-oxydation des acides gras libérés pour subvenir aux besoins énergétiques lors de la croissance préphotosynthétique de la plantule. Bien que diverses lipases végétales aient été isolées de corps lipidiques, seul un crible génétique recherchant des mutants incapables de dégrader leurs triglycérides après germination (et ne croissant qu’en présence de saccharose) a permis d’identifier le mutant sdp1 [7]. |
Les fonctions des protéines à domaine patatine dans les interactions pathogéniques L’implication récente de protéines à domaine patatine dans la gestion de l’homéostasie lipidique a été précédée de la publication de données décrivant l’intervention de protéines à domaine PNPLA dans certaines interactions pathogéniques, ces protéines provenant soit de l’agresseur, soit de l’organisme agressé. Ainsi, les effets cytotoxiques de la protéine exoU sécrétée par la bactérie Pseudomonas aeruginosa dans les cellules pulmonaires ou de la cornée sont médiés par l’activité lysophospholipase portée par un domaine patatine [
8]. L’opéron bdhA-patD est également nécessaire à la virulence de Legionella pneumophila [
9]. De façon plus générale, des explorations génomiques semblent indiquer une corrélation positive entre le nombre de gènes codant des protéines à domaine patatine dans les génomes bactériens et le degré de virulence de ces microbes [
10]. Dans un contexte physiopathologique, l’étude des plantes révèle une situation encore plus complexe. Notre équipe a montré que des isoformes de patatine issues de l’hôte apparaissent dans les feuilles de tabac ou d’Arabidopsis réagissant à des infections microbiennes par une forme de mort cellulaire programmée [
11]. Ces isoformes sont inactives sur les triglycérides, comme l’est la patatine de tubercule de pomme de terre, mais présentent des activités phospholipase A et surtout galactolipase. Ainsi, l’inactivation ou la surexpression du gène PLP2 chez Arabidopsis diminue ou aggrave respectivement les symptômes de mort cellulaire et a des effets différentiels sur la résistance antimicrobienne. L’interprétation des données suggère que PLP2 participe à l’arsenal défensif de la plante en alimentant la synthèse de certains signaux cellulaires dérivés d’acides gras et en catalysant le démantèlement de membranes lipidiques nécessaire à l’exécution rapide de la mort cellulaire [
12]. De même, AtPLA-I, ressemblant aux iPLA2 animales, est requise pour la résistance antifongique. On sait de plus que des bactéries phytopathogènes possèdent également une panoplie de gènes PNPLA dont l’implication dans la stratégie de colonisation des plantes par ces bactéries reste à déterminer. Alors qu’elle a été cantonnée pendant longtemps au simple rôle de protéine de réserve chez la pomme de terre (elle représente jusqu’à 40 % des protéines solubles du tubercule), la patatine, et surtout son domaine catalytique, constituent en fait un motif ancien utilisé dans tous les organismes. En ciblant des structures lipidiques distinctes, différentes PNPLA relayent un nombre croissant de fonctions biologiques importantes dans le développement et la pathologie.
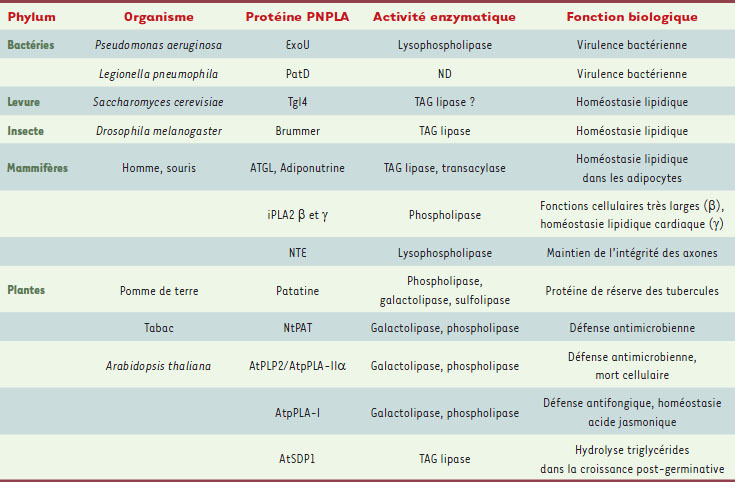
 | Tableau I.
Quelques exemples de la diversité et des fonctions des protéines à domaine patatine (PNPLA) dans le monde vivant. ATGL : adipose triglyceride lipase ; NTE : neuropathy target esterase ; TAG : triacyl-glycérol ; ND : non déterminé. |
|
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Kienesberger PC, Oberer M, Lass A, Zechner R. Mammalian patatin domain containing proteins: a family with diverse lipolytic activities involved in multiple biological functions. J Lipid Res 2009; 50 (suppl) : S63–8. 2. Kershaw EE, Hamm JK, Verhagen LA, et al. Adipose triglyceride lipase: function, regulation by insulin, and comparison with adiponutrin. Diabetes 2006; 55 : 148–57. 3. Zimmermann R, Strauss JG, Haemmerle G, et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science 2004; 306 : 1383–6. 4. Gronke S, Mildner A, Fellert S, et al. Brummer lipase is an evolutionary conserved fat storage regulator in Drosophila. Cell Metab 2005; 1 : 323–30. 5. Kurat CF, Natter K, Petschnigg J, et al. Obese yeast: triglyceride lipolysis is functionally conserved from mammals to yeast. J Biol Chem 2005; 281 : 491–500. 6. Racusen D, Foote M. A major soluble glycoprotein of potato tubers. J Food Biochem 1980; 4 : 43–52. 7. Eastmond PJ. Sugar-Dependent1 encodes a patatin domain triacylglycerol lipase that initiates storage oil breakdown in germinating Arabidopsis seeds. Plant Cell 2006; 18 : 665–75. 8. Pankhaniya RR, Tamura M, Allmond LR, et al.
Pseudomonas aeruginosa causes acute lung injury via the catalytic activity of the patatin-like phospholipase domain of ExoU. Crit Care Med 2004; 32 : 2293–9. 9. Aurass P, Pless B, Rydzewski K, et al. bdhA-patD operon as a virulence determinant, revealed by a novel large-scale approach for identification of Legionella pneumophila mutants defective for amoeba infection. Appl Environ Microbiol 2009; 75 : 4506–15. 10. Banerji S, Flieger A. Patatin-like proteins: a new family of lipolytic enzymes present in bacteria ? Microbiology 2004; 150 : 522–5. 11. La Camera S, Geoffroy P, Samaha H, et al. A pathogen-inducible patatin-like lipid acyl hydrolase facilitates fungal and bacterial host colonization in Arabidopsis. Plant J 2005; 44 : 810–25. 12. La Camera S, Balague C, Göbel C, et al. The Arabidopsis patatin-like protein 2 (PLP2) plays an essential role in cell death execution and differentially affects biosynthesis of oxylipins and resistance to pathogens. Mol Plant Microbe Interact 2009; 2 : 469–81. 13. Baulande S, Langlois C. Les protéines à domaine patatine : une nouvelle famille de régulateurs du métabolisme lipidique. Med Sci (Paris) 2010; 26 : 177–84. |