| |
| Med Sci (Paris). 2010 February; 26(2): 133–135. Published online 2010 February 15. doi: 10.1051/medsci/2010262133.Mutations de novo de SYNGAP1 associées à la déficience intellectuelle non syndromique Fadi F. Hamdan, Julie Gauthier, Guy A. Rouleau, and Jacques L. Michaud* Centre d’excellence en neuromique de l’Université de Montréal, Centre de recherche du Centre hospitalier universitaire Sainte-Justine, Centre de recherche, CHU Sainte-Justine, 3175, Côte Sainte-Catherine, Montréal (Québec), H3T 1C5 Canada MeSH keywords: Animaux, Enfant, Troubles de la cognition, génétique, Protéines d'activation de la GTPase, Humains, Déficience intellectuelle, Troubles de l'apprentissage, Troubles de la mémoire, Souris, Souris knockout |
La déficience intellectuelle (DI) constitue le handicap sévère le plus fréquent de l’enfance, et touche 1-2 % de la population. Elle survient avant l’âge de 18 ans et se traduit par un fonctionnement intellectuel significativement inférieur à la moyenne accompagné de difficultés importantes d’adaptation (communication, soins personnels, compétences domestiques, habiletés sociales, aptitudes scolaires et fonctionnelles, etc.) [
1]. La forme la plus répandue est la DI non syndromique (DINS), qui n’est associée à aucune autre anomalie. En l’absence de signes physiques qui orientent les chercheurs dans leurs explorations, l’identification des gènes autosomiques dominants associés à la DINS représente un défi particulier. Les familles dans lesquelles la DI est transmise sur le mode autosomique dominant sont rares en raison d’un taux de reproduction inférieur à celui de la population générale. Ces mutations autosomiques dominantes pourraient par contre survenir de novo (c’est-à-dire n’être pas héritées des parents). De fait, les remaniements chromosomiques de novo représentent la cause génétique de DI la plus fréquemment identifiée. Des mutations ponctuelles de novo pourraient elles aussi contribuer au développement de la DINS. La détection de ces mutations doit reposer sur leur recherche directe par séquençage. |
Processus cognitifs et plasticité synaptique : cibles de la déficience intellectuelle non syndromique Les processus cognitifs, comme la mémoire et les apprentissages, s’accompagnent d’un remodelage des synapses excitatrices qui se caractérise par des changements de leur force, de leur nombre et de leur forme. Le terme « plasticité synaptique » est utilisé pour désigner ces différents changements. Les synapses excitatrices prennent la forme d’épines faisant saillie sur les dendrites des neurones. Comme la DI affecte les processus cognitifs, il n’est pas surprenant que le nombre et/ou la forme des épines soient altérés dans plusieurs formes de DI [
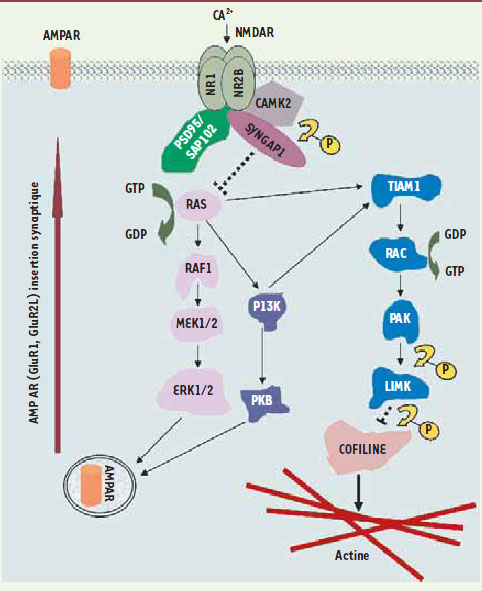
2]. En fait, il est raisonnable de postuler qu’un grand nombre de gènes atteints dans la DI agissent au sein de cascades qui convergent pour moduler la plasticité des synapses. Il est aussi possible que les gènes contrôlant la plasticité synaptique jouent un rôle plus important dans la DINS que dans la DI syndromique. En effet, cette dernière forme de DI peut être associée à des anomalies structurales du cerveau, qui n’ont pas de lien avec des perturbations de la plasticité synaptique. Les neurones présynaptiques associés aux épines dendritiques sécrètent le neurotransmetteur glutamate. La signalisation par le glutamate via le récepteur de type NMDA (NMDAR) est nécessaire à la plasticité des synapses excitatrices. Certaines formes de plasticité synaptique régulées par le NMDAR requièrent l’insertion du récepteur glutaminergique de type AMPA (AMPAR) dans la membrane post-synaptique. SYNGAP1, qui code pour une protéine activatrice de GTPase exclusivement exprimée dans le cerveau, agit en aval de NMDAR pour bloquer l’insertion de AMPAR dans la membrane post-synaptique en inhibant la voie RAS-ERK (Figure 1) [
3–
5]. Le rôle de SYNGAP pourrait être de restreindre dans le temps l’activation de RAS-ERK au cours de certaines phases de la plasticité synaptique. Les souris homozygotes pour un allèle nul de Syngap1 meurent à la naissance tandis que les souris hétérozygotes survivent mais ont des perturbations de la mémoire et des apprentissages [3,
6].
 | Figure 1.
Fonction de SYNGAP1 dans la synapse. SYNGAP1 agit en aval du récepteur glutaminergique de type NMDA pour restreindre l’activité de la voie RAS-ERK et l’insertion du récepteur glutaminergique de type AMPA dans la membrane au cours de certaines formes de plasticité synaptique. SYNGAP1 pourrait aussi influencer la morphologie des épines dendritiques en modulant la voie Rac et le remodelage du cytosquelette. TIAM1 : T-cell lymphoma invasion and metastasis ; LIMK : LIM domain kinase ; PAK : P21 activated kinase ; CAMK2 : calcium/calmoduline dependent protein kinase 2 ; SAP102 : synapse-associated protein. |
|
Haplo-insuffisance de SYNGAP1 à l’origine de déficience intellectuelle L’hypothèse de notre groupe est que des mutations ponctuelles de novo touchant des gènes essentiels pour la plasticité synaptique pourraient expliquer une fraction des cas de DINS. Pour l’explorer, nous avons entrepris de séquencer un grand nombre de gènes intervenant dans le processus de plasticité synaptique dans une cohorte d’enfants atteints de DINS. Nous avons donné la priorité à l’étude de SYNGAP1, en raison de son importance pour la plasticité synaptique et la cognition chez la souris. Le séquençage de la région codante de SYNGAP1 chez 94 patients sporadiques atteints d’une DINS inexpliquée a permis de détecter 3 mutations de novo différentes dans SYNGAP1 chez trois enfants [
7]. Deux sont des mutations faux-sens ; la troisième est constituée d’une délétion d’un nucléotide qui entraîne un changement du cadre de lecture et l’introduction d’un codon stop prématuré. Les 3 enfants sont des filles, âgées de 4 à 12 ans, présentant une DI de gravité moyenne. Deux d’entre elles sont aussi traitées pour une épilepsie généralisée qui est facile à maîtriser. Plusieurs observations suggèrent que ces mutations sont pathogéniques. D’abord, elles ont toutes comme conséquence d’amputer le domaine carboxy-terminal de SYNGAP1 qui est requis pour son interaction avec d’autres protéines du complexe du NMDAR. Ces interactions sont essentielles pour différents aspects de la plasticité synaptique qui sont associés à la mémoire et à l’apprentissage. Comme l’haplo-insuffisance de Syngap1 chez la souris affecte la plasticité synaptique et la mémoire spatiale, la perte d’un seul allèle de SYNGAP1 a le potentiel de perturber la cognition chez l’humain. Finalement, le séquençage de SYNGAP1 chez des individus autistes (n = 142), schizophrènes (n = 143) et sains (n = 190) n’a pas révélé de mutations de novo, ni de mutations potentiellement délétères [7]. Au total, ces observations suggèrent fortement que l’haploinsuffisance de SYNGAP1 est une des causes de DINS. |
Conclusion et perspectives La mise en évidence chez 3 % des patients testés de mutations dans SYNGAP1 est inattendue car la plupart des gènes associés à une DI ont une prévalence de moins de 1 %. Par exemple, le syndrome de l’X fragile, qui représente la cause monogénique de DI la plus fréquente, est détecté chez environ 2 % des individus masculins atteints de DI [
8,
9]. Il sera donc important de valider la prévalence des mutations de SYNGAP1 en séquençant le génome d’un grand nombre de patients porteurs des mêmes caractéristiques cliniques que celles des enfants étudiés dans notre étude.
SYNGAP1 représente un des premiers exemples de gènes autosomiques dominants associés à la DINS. Cette découverte aidera les cliniciens à établir un diagnostic étiologique de DI et facilitera le conseil génétique. De plus, la connaissance des gènes de DI impliqués dans les cascades synaptiques ouvre des perspectives futures de traitement pharmacologique de la DI, avec comme objectif de diminuer les anomalies associées comme l’épilepsie ou d’améliorer les performances cognitives. Finalement, notre étude valide l’approche de séquençage à haut débit pour l’exploration de maladies neurodéveloppementales. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Curry CJ, Stevenson RE, Aughton D, et al. Evaluation of mental retardation: recommendations of a Consensus Conference: American College of Medical Genetics. Am J Med Genet 1997; 72 : 468–77. 2. Purpura DP. Dendritic spine « dysgenesis » and mental retardation 1. Science 1974; 186 : 1126–8. 3. Komiyama NH, Watabe AM, Carlisle HJ, et al. SynGAP regulates ERK/MAPK signaling, synaptic plasticity, and learning in the complex with postsynaptic density 95 and NMDA receptor. J Neurosci 2002; 22 : 9721–32. 4. Rumbaugh G, Adams JP, Kim JH, Huganir RL. SynGAP regulates synaptic strength and mitogen-activated protein kinases in cultured neurons. Proc Natl Acad Sci USA 2006; 103 : 4344–51. 5. Carlisle HJ, Manzerra P, Marcora E, Kennedy MB. SynGAP regulates steady-state and activity-dependent phosphorylation of cofilin. J Neurosci 2008; 28 : 13673–83. 6. Guo X, Hamilton PJ, Reish NJ, et al. Reduced expression of the NMDA receptor-interacting protein SynGAP causes behavioral abnormalities that model symptoms of schizophrenia. Neuropsychopharmacology 2009; 34 : 1659–72. 7. Hamdan FF, Gauthier J, Spiegelman D, et al. Mutations in SYNGAP1 in autosomal nonsyndromic mental retardation. N Engl J Med 2009; 360 : 599–605. 8. Davidovic L, Tremblay S, Gravel M, et al. The fragile X syndrome: one protein missing and 1001 disoriented mRNAs. Med Sci (Paris) 2006; 22 : 41–6 9. Billuart P, Chelly J, Gilgenkrantz S. X-linked mental retardation. Med Sci (Paris) 2005; 21 : 947–53. |