| |
| Med Sci (Paris). 2010 February; 26(2): 145–146. Published online 2010 February 15. doi: 10.1051/medsci/2010262145.Le complexe ERMES Une connexion haut débit entre le réticulum endoplasmique et les mitochondries Benoît Kornmann* University of California at San Francisco, Genentech Hall N316 Box 2200, 600-16th Street, San Francisco CA 94158-2517, États-Unis MeSH keywords: Animaux, Activité bactéricide du sang, physiologie, Cellules endothéliales, effets des médicaments et des substances chimiques, Activation enzymatique, Histone, antagonistes et inhibiteurs , sang, toxicité, Humains, Souris, Modèles biologiques, Protéine C, Maturation post-traductionnelle des protéines |
La cellule MATRIX et ses esclaves les mitochondries On se souvient du film MATRIX [
1] où les machines réduisaient les humains en esclavage en faisant d’eux leur source majeure d’énergie. Elles les cultivaient dans des cocons remplis de matière nutritives et les plongeaient dans un monde virtuel - la matrice - en injectant des informations dans leur tronc cérébral grâce à une connexion branchée au niveau de leur nuque. En maîtrisant l’apport de nourriture matérielle et spirituelle, les machines s’assuraient un contrôle total sur les humains. Il est des cas où la science rejoint la fiction. À une tout autre échelle, l’histoire des cellules eucaryotes nous montre qu’à un moment de l’évolution, une cellule protoeucaryote (la cellule mère de toute la lignée) a réduit en esclavage des bactéries. Ces bactéries, ayant évolué en mitochondries, sont devenues la source principale d’énergie des cellules eucaryotes. Comme les machines de MATRIX, la cellule a besoin d’une emprise sur ses esclaves afin de contrôler leur activité et leur croissance et de les adapter à ses besoins propres. Pour parvenir à ce niveau de contrôle, l’évolution a dépouillé les mitochondries de nombreuses fonctions présentes dans la bactérie originelle et les a transférées à la cellule hôte. L’exemple le plus spectaculaire est la faculté de synthétiser des protéines. En effet, si les mitochondries ont conservé une molécule d’ADN, celle-ci ne représente plus qu’un vestige de génome, tout juste bon à coder une douzaine de protéines [
10,
11]. Et c’est la cellule hôte qui effectue et contrôle la synthèse de la majorité des protéines mitochondriales qui sont ensuite importées dans la mitochondrie [
2]. D’autres composants mitochondriaux sont également synthétisés hors de la mitochondrie. Ainsi, les lipides constituant la double membrane de la mitochondrie sont synthétisés dans le réticulum endoplasmique (RE). Ils sont ensuite transportés et insérés dans la membrane externe de la mitochondrie. Les lipides étant par nature insolubles dans le cytosol, ils transitent directement de la membrane du RE à la membrane de la mitochondrie, et ce d’une façon encore non élucidée. On soupçonnait cependant que ce transfert avait lieu au niveau de sites spécialisés où les membranes des deux organites sont en contact. Ces sites d’attachement sont visibles par microscopie et expliquent la cosédimentation du RE et des mitochondries lors d’expériences de fragmentation cellulaire [
3]. Ce processus, et en particulier le mécanisme responsable de l’attachement entre RE et mitochondries, échappait néanmoins à notre compréhension. |
Une histoire de « béquille moléculaire » Afin d’élucider ce mécanisme, nous avons développé une approche originale [
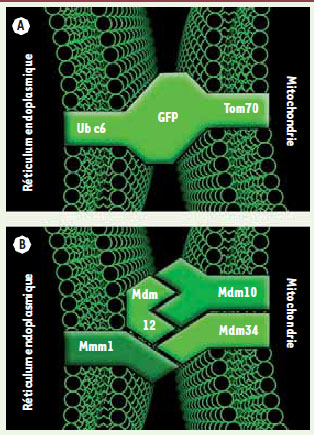
4]. Plutôt que de chercher à identifier des protéines naturelles intervenant au niveau des contacts entre le RE et les mitochondries, nous avons construit une protéine synthétique conçue pour créer de tels contacts artificiellement. Cette protéine possède une armature centrale flanquée d’un domaine d’insertion mitochondrial à son extrémité amino-terminale, et d’un domaine d’insertion dans le RE à l’extrémité carboxy-terminale (Figure 1A). En s’insérant dans les deux systèmes membranaires simultanément, elle renforce et élargit les domaines de contacts entre les deux organites [
5]. Mais comment cette protéine artificielle peut-elle nous renseigner sur l’identité des protéines naturelles impliquées dans ces contacts ? Tout simplement, en nous servant d’elle comme d’une « prothèse moléculaire », une stratégie que nous allons décrire par l’analogie suivante : imaginez que vous donniez des béquilles aux patients consultant habituellement un service d’urgences ; les divers blessés des membres inférieurs, bien contents de pouvoir les utiliser pour marcher, feront en sorte de les garder. À l’inverse, ceux qui souffrent d’autres blessures, n’en ayant pas l’usage, les abandonneront. Ainsi mettre à disposition des « jambes artificielles » permet de repérer au sein d’un groupe de blessés ceux qui souffrent de handicaps au niveau de leurs membres inférieurs naturels. De même devrions-nous pouvoir reconnaître les cellules ayant un défaut de connexion entre le RE et la mitochondrie en ce qu’elles ne pourront pas se passer de leur prothèse moléculaire. |
Un complexe protéique qui crée des connexions entre les organites Nous avons mis en pratique cette idée dans un crible génétique chez la levure de bière Saccharomyces cerevisiae, qui nous a permis de caractériser des cellules mutantes qui ne peuvent pousser que lorsqu’elles expriment notre prothèse artificielle. Les mutations identifiées impliquent toutes un seul complexe de protéines que nous avons nommé ERMES (ER-mitochondria encounter structures). Nous avons montré que des protéines insérées dans les membranes du RE et de la mitochondrie et s’assemblant au sein du complexe ERMES, maintiennent les deux organites accolés l’un à l’autre (Figure 1B). Et comme on pouvait s’y attendre, détruire ce complexe par mutation compromet l’import des lipides dans la mitochondrie.
 | Figure 1.
Stratégie d’identification et architecture du complex ERMES. A. Schéma de la protéine synthétique utilisée pour connecter artificiellement mitochondries et réticulum endoplasmique (RE). Un module central constitué d’une green fluorescent protein (GFP) est flanqué de la séquence transmembranaire mitochondriale amino-terminale de la protéine Tom70 et de la séquence carboxy-terminale d’ancrage dans le RE de la protéine Ubc6. B. Architecture du complexe ERMES. Mdm10 et Mdm34 sont deux protéines insérées dans la membrane externe de la mitochondrie. Mmm1 est une glycoprotéine insérée dans la membrane du RE. L’interaction de ces facteurs, aidée par la protéine soluble Mdm12, maintient les membranes de la mitochondrie et du RE apposées. |
Mais un éventail d’observations antérieures concernant les membres du complexe ERMES suggère que celui-ci exerce un rôle bien plus central dans la physiologie mitochondriale que celui de simple passeur de lipides. Le complexe ERMES se trouve par exemple associé spatialement aux génomes mitochondriaux en cours de réplication et les mutations d’ERMES engendrent un défaut de réplication et de transmission du génome mitochondrial [
6, 11] (→).
(→) voir l’article de E. Sarzi et A. Rötig, p. 171 de ce numéro
Autre exemple, un élément d’ERMES, Mdm10, se trouve être un composant régulateur d’un second complexe impliqué dans l’insertion de certaines protéines dans la membrane de la mitochondrie. Parmi les substrats de ce second complexe se trouve Tom40, le canal protéique à travers lequel transitent toutes les protéines destinées à l’import dans la mitochondrie [
7]. Enfin, la morphologie et la motilité des mitochondries des mutants d’ERMES sont profondément anormales, suggérant que le complexe régule également l’attachement de la mitochondrie au cytosquelette [
8]. |
Une cyber-connexion inter-organite Toutes ces observations montrent que le complexe ERMES se trouve au carrefour de nombreuses voies de régulation de la physiologie mitochondriale, telles que la maintenance du génome, de la membrane, des protéines, de l’activité, de la forme et de la transmission des mitochondries. Mais alors pour quelle raison le contrôle de fonctions aussi diverses se trouve-t-il intégré à l’interface entre la mitochondrie et le RE ? Peut-être parce que ces sites représentent des lieux de communication privilégiés entre la cellule et la mitochondrie [
9], une sorte de câblage connectant le maître et l’esclave qui permettrait au premier de garder le contrôle sur la taille, le nombre et l’activité du second. Retour à la fiction pour mieux illustrer la science… |
1. Wachowski A, Wachowski L. The Matrix. Los Angeles : Warner Brothers, 1999. 2. Dyall SD, Brown MT, Johnson PJ. Ancient invasions: from endosymbionts to organelles. Science 2004; 304 :253–7. 3. Vance JE. Newly made phosphatidylserine and phosphatidylethanolamine are preferentially translocated between rat liver mitochondria and endoplasmic reticulum. J Biol chem 1991; 266 : 89–97. 4. Kornmann B, Currie E, Collins SR, et al. An ER-mitochondria tethering complex revealed by a synthetic biology screen. Science 2009; 325 : 477–81. 5. Csordás G, Renken C, Várnai P, et al. Structural and functional features and significance of the physical linkage between ER and mitochondria. J Cell Biol 2006; 174 : 915–21. 6. Meeusen S, Nunnari J. Evidence for a two membrane-spanning autonomous mitochondrial DNA replisome. J Cell Biol 2003; 163 : 503–10. 7. Meisinger C, Pfannschmidt S, Rissler M, et al. The morphology proteins Mdm12/Mmm1 function in the major beta-barrel assembly pathway of mitochondria. EMBO J 2007; 26 : 2229–39. 8. Boldogh IR, Nowakowski DW, Yang H, et al. A protein complex containing Mdm10p, Mdm12p, and Mmm1p links mitochondrial membranes and DNA to the cytoskeleton-based segregation machinery. Mol Biol Cell 2003; 14 : 4618–27. 9. Wiedemann N, Meisinger C, Pfanner N. Connecting organelles. Science 2009; 325 : 403–4. 10. Rustin P, Jacobs H, Dietrich A, et al. Adresser du matériel allogène dans le compartiment mitochondrial. Med Sci (Paris) 2007; 23 : 519–25. 11. Sarzi E, Rötig A. Instabilité du génome mitochondrial et pathologies associées. Med Sci (Paris) 2010 : 26 : 171–6. |