| |
| Med Sci (Paris). 2010 March; 26(3): 227–228. Published online 2010 March 15. doi: 10.1051/medsci/2010263227.
Leishmania donovani induit un défaut d’acidification du phagosome Adrien F. Vinet and Albert Descoteaux* INRS-Institut Armand Frappier Centre for Host-Parasite Interactions, 531, boulevard des Prairies, Laval (Quebec) H7V 1B7, Canada MeSH keywords: Animaux, Humains, Leishmania donovani, Leishmaniose viscérale, immunologie, physiopathologie, Phagosomes, enzymologie, physiologie, Vacuolar Proton-Translocating ATPases, métabolisme, Polymorphisme génétique, États-Unis d'Amérique, Consentement d'un tiers, législation et jurisprudence |
La leishmaniose viscérale (Kala-azar) est causée par le protozoaire Leishmania donovani, un parasite qui infecte les macrophages du foie, de la rate et de la moelle osseuse. Cette infection est chronique et risque d’être mortelle si elle n’est pas traitée. Leishmania est transmis à l’humain par voie sanguine sous sa forme promastigote lors d’un repas sanguin de la mouche des sables du genre Lutzomyia ou Phlebotomus. Une fois chez l’hôte mammifère, le parasite est internalisé par des macrophages. Il altère alors le processus normal de phagocytose et mène sans opposition sa différenciation en amastigote. La forme amastigote, qui est résistante à l’arsenal microbicide du phagolysosome, peut alors se répliquer et infecter d’autres macrophages. Il n’existe pas de vaccin efficace pour prévenir la leishmaniose. De plus, la résistance du parasite aux agents pharmacologiques réduit grandement l’efficacité des médicaments conventionnels. Lors de la phagocytose, le phagosome nouvellement formé acquiert la capacité de tuer et de dégrader les micro-organismes en s’engageant dans un processus hautement régulé de maturation caractérisé par de nombreuses interactions avec le compartiment endosomal. Afin d’éviter la destruction, la forme promastigote de L. donovani inhibe la biogenèse du phagolysosome permettant ainsi au parasite d’établir l’infection dans une vacuole peu microbicide [
1–
3]. Cette inhibition est causée par le lipophosphoglycan (LPG), le principal glycolipide présent à la surface du promastigote. L’insertion du LPG dans les microdomaines lipidiques de la membrane phagosomale et la désorganisation qui s’ensuit semblent être à la base de l’inhibition de la maturation du phagosome [
4,
5]. |
L. donovani s’oppose à l’action de la Synaptotagmine V dans le phagosome Le processus phagocytaire fait intervenir un grand nombre d’événements de fusion membranaire lors de l’apport d’endomembranes issues de vésicules internes, et ce tout au long de la maturation du phagosome. Peu d’études se sont intéressées à l’identification des régulateurs de ces fusions membranaires lors de la phagocytose. Les Synaptotagmines (Syt) sont des senseurs calciques (détecteur-effecteur) de l’exocytose dont le rôle a été bien étudié dans les cellules neuronales et sécrétrices. Les membres de cette famille sont caractérisés par deux domaines C2 en tandem capables de lier le calcium, la phosphatidylsérine et les membres du complexe de fusion membranaire SNARE [SNAP (soluble NSF attachment protein) receptors] [
9]. Nous avons démontré précédemment que la Syt V régit l’apport d’endomembranes lors de la phagocytose, en particulier lorsque le macrophage se trouve en situation de forte demande membranaire [
6]. Nos récents travaux ont révélé le rôle clé que joue la Syt V durant la biogenèse du phagolysosome en régulant l’acquisition d’effecteurs essentiels au développement de propriétés microbicides, notamment la sous-unité c de la pompe à proton V-ATPase [
7]. En effet, l’acidification progressive du phagosome potentialise l’efficacité des agents microbicides tels que les enzymes lytiques, les peptides cationiques et les formes réactives de l’oxygène. Une fraction de la Syt V exprimée par le macrophage est associée aux microdomaines lipidiques membranaires. Lors d’une infection par des promastigotes de L. donovani, l’insertion du LPG dans les microdomaines lipidiques de la membrane du phagosome cause la dissociation de la Syt V de ces sites, ce qui entraîne une exclusion de la sous-unité c de la V-ATPase et, par conséquent, un défaut de l’acidification du phagosome [7]. Cette stratégie de survie intracellulaire consistant à éviter le contact avec le contenu lysosomal est utilisée par d’autres micro-organismes intracellulaires tels que Toxoplasma, Legionella et Mycobacterium. Le LPG n’est pas le seul facteur de virulence de Leishmania capable d’interagir avec les microdomaines lipidiques du macrophage. Ainsi, la protéase de surface GP63 est internalisée en grande partie via des microdomaines lipidiques, ce qui entraîne un clivage et une stimulation de l’activité phosphatase des protéines telles que SHP-1 (SH2 domain-containing protein phosphatase), PTP1B (protein tyrosine phosphatase) et TCPTP (T cell protein tyrosine phosphatase) [
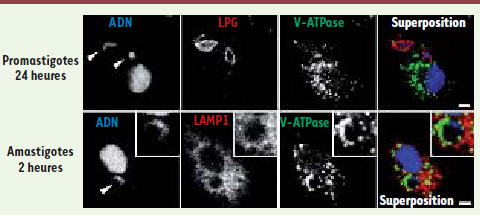
8]. Il en résulte une atténuation des fonctions microbicides du macrophage. La découverte que nous avons faite montrant que les phagosomes contenant les promastigotes de L. donovani n’acquièrent pas la V-ATPase (Figure 1) et ne s’acidifient pas [7] apporte un nouvel élément à notre compréhension de la biologie des Leishmania. En effet, en l’absence de données sur le pH des phagosomes abritant les promastigotes, il est présumé que la différenciation des promastigotes en amastigotes est déclenchée par une rapide exposition à un environnement acide et par le choc thermique que subit le parasite lors de son inoculation chez l’humain (passage de la température ambiante à 37ºC). Nos données suggèrent que ce modèle pourrait s’avérer incorrect et indiquent que des facteurs de l’hôte autres que l’acidification pourraient amorcer le processus de différenciation. Il sera donc important de poursuivre la caractérisation de la vacuole afin de mieux comprendre les mécanismes moléculaires grâce auxquels le parasite Leishmania réussit à s’adapter à l’humain et à déjouer son système immunitaire, lui permettant ainsi de proliférer en toute impunité.  | Figure 1.
L’exclusion de la V-ATPase des phagosomes est spécifique du stade promastigote de L. donovani. Des macrophages primaires issus de la moelle osseuse de souris ont été infectés par la forme promastigote (24 heures d’internalisation, panneaux du haut) ou la forme amastigote (2 heures d’internalisation, panneaux du bas) de L. donovani. Les cellules ont ensuite été fixées et préparées pour une visualisation par microscopie confocale du LPG (lipophosphoglycan) (rouge, panneaux du haut), du marqueur lysosomal LAMP-1 (lysosomal-associated membrane protein 1) (rouge, panneaux du bas), de la V-ATPase (vert) et de l’ADN du macrophage et des parasites (bleu). L’ADN des parasites est indiqué par une flèche. La V-ATPase n’est pas présente dans les phagosomes contenant la forme promastigote même après 24 heures d’infection, bien qu’elle ait été recrutée, tout comme LAMP-1, lors de périodes précoces pour les phagosomes contenant la forme amastigote. Barre 3µm. |
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Desjardins M, Descoteaux A. Inhibition of phagolysosomal biogenesis by the Leishmania lipophosphoglycan. J Exp Med 1997; 185 : 2061–8. 2. Scianimanico S, Desrosiers M, Dermine JF, et al. Impaired recruitment of the small GTPase rab7 correlates with the inhibition of phagosome maturation by Leishmania donovani promastigotes. Cell Microbiol 1999; 1 : 19–32. 3. Lodge R, Diallo TO, Descoteaux A. Leishmania donovani lipophosphoglycan blocks NADPH oxidase assembly at the phagosome membrane. Cell Microbiol 2006; 8 : 1922–31. 4. Dermine JF, Goyette G, Houde M, et al.
Leishmania donovani lipophosphoglycan disrupts phagosome microdomains in J774 macrophages. Cell Microbiol 2005; 7 : 1263–70. 5. Winberg ME, Holm A, Särndahl E, et al.
Leishmania donovani lipophosphoglycan inhibits phagosomal maturation via action on membrane rafts. Microbes Infect 2009; 11 : 215–22. 6. Vinet AF, Fukuda M, Descoteaux A. The exocytosis regulator synaptotagmin V controls phagocytosis in macrophages. J Immunol 2008; 181 : 5289–95. 7. Vinet AF, Fukuda M, Turco SJ, Descoteaux A. The Leishmania donovani lipophosphoglycan excludes the vesicular proton-ATPase from phagosomes by impairing the recruitment of Synaptotagmin V. PLoS Pathog 2009; 5 : e1000628. 8. Gomez MA, Contreras I, Halle M, et al.
Leishmania GP63 alters host signaling through cleavage-activated protein tyrosine phosphatases. Sci Signal 2009; 2 : ra58. 9. Seagar M, Quetglas S, Iborra C, Lévêque C. Le complexe SNARE au cœur de la fusion membranaire. Med Sci (Paris) 2001; 17 : 669–74. |