| |
| Med Sci (Paris). 2010 March; 26(3): 229–231. Published online 2010 March 15. doi: 10.1051/medsci/2010263229.Les macrophages interstitiels, gardiens de l’homéostasie immune pulmonaire Denis Bedoret, Fabrice Bureau,* and Christophe J. Desmet* Laboratoire de physiologie cellulaire et moléculaire, GIGA-Research, Université de Liège, avenue de l’hôpital, B-4000 Liège, Belgique MeSH keywords: Allergènes, effets indésirables, Asthme, épidémiologie, immunologie, Europe, Homéostasie, Humains, Hypersensibilité, Tolérance immunitaire, Poumon, Macrophages |
L’asthme allergique et les paradoxes apparents de la théorie du « danger » L’asthme est un syndrome regroupant différents types d’affections respiratoires qui, ensemble, affectent aujourd’hui 6 % de la population européenne. Sa caractéristique principale est une obstruction récurrente et réversible des voies respiratoires entraînant un sifflement caractéristique lors de la respiration. L’un des types les plus fréquents d’asthme est l’asthme atopique ou allergique. L’asthme allergique, comme son nom l’indique, est lié à des réactions allergiques des voies respiratoires à l’encontre d’allergènes environnementaux inhalés tels que les déjections d’acariens, les squames de chat, etc [
1]. Les allergènes sont des antigènes et devraient donc en théorie déclencher une réponse immunitaire contre le « non-soi » chez tous les individus exposés, ce qui n’est heureusement pas le cas. Pour expliquer l’absence de réponse aux allergènes chez les individus non atopiques, il est généralement fait référence à la théorie du danger. Selon cette théorie, le système immunitaire tolérerait la plupart des antigènes inhalés parce que ceux-ci ne présentent pas de signal de danger reconnaissable par le système immunitaire [
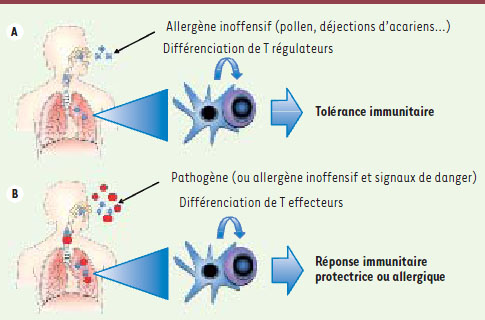
2]. Dans ces situations, les cellules dendritiques (CD), les sentinelles du système immunitaire, induiraient la différenciation de lymphocytes T régulateurs qui inhiberaient ainsi les réponses inflammatoires à l’encontre des antigènes inoffensifs [
3–
5] (Figure 1A). À l’inverse, les éléments dangereux comme les virus ou les bactéries présenteraient des signaux de danger instruisant directement ou indirectement les CD afin qu’elles déclenchent une réponse lymphocytaire protectrice (Figure 1B).
 | Figure 1.
La théorie du danger et la balance immunitaire du poumon. A. Un allergène inoffensif, lorsqu’il est présenté au système immunitaire par les cellules dendritiques (en bleu), induit la différenciation de lymphocytes T régulateurs (Treg, en mauve). Ces Treg assurent la tolérance du système immunitaire vis-à-vis de l’allergène. B. Un pathogène, par les signaux de danger qu’il présente (polygones rouges), induit les cellules dendritiques à promouvoir le développement de lymphocytes T effecteurs, lesquels participeront à une réponse immunitaire protectrice. De même, un allergène inoffensif, s’il est inhalé en même temps que des signaux de danger, peut induire le développement d’une réaction immunitaire allergique. |
La simplicité apparente de ce concept est cependant mise à mal. Il semble en effet peu probable que notre organisme soit amené à générer des lymphocytes T régulateurs spécifiques de chacun des millions d’antigènes inoffensifs différents rencontrés au cours de la vie. Par ailleurs, de nombreuses études environnementales et épidémiologiques ont démontré que des signaux de danger sont omniprésents dans l’air inhalé. Ils proviennent pour la plupart de déchets non viables des micro-organismes environnementaux [
6–
8]. Par exemple l’endotoxine (ou lipopolysaccharide, LPS), un composant de la paroi des bactéries Gram-, est présente en concentrations relativement élevées dans l’air ambiant [8–
12]. Ainsi, tous les antigènes que nous inhalons, même s’ils sont inoffensifs, sont accompagnés de signaux de danger d’origine bactérienne. Par conséquent, si la théorie du danger s’applique, le système immunitaire pulmonaire devrait systématiquement assimiler les allergènes inhalés à un danger et développer une réaction à leur encontre (Figure 1B). La population entière serait donc asthmatique ou développerait une réponse inflammatoire contre chaque antigène inhalé. Paradoxalement, si l’on étudie isolément le fonctionnement des CD, ceci semble être le cas. En effet, les CD promeuvent le développement d’une réponse lymphocytaire de type allergique à l’encontre de tout antigène inoffensif qui leur est présenté en même temps que du LPS à des concentrations similaires à celles que l’on détecte dans l’air ambiant [
13]. Si l’on considère uniquement le point de vue des CD, l’ensemble de la population devrait être asthmatique. Comme ce n’est pas le cas, il doit donc exister des mécanismes bloquant l’activité des CD en conditions normales. |
Les macrophages interstitiels pulmonaires, garde-fous anti-inflammatoires Les cellules immunes les plus représentées dans le poumon sont les macrophages. Cependant, leur rôle dans la régulation des réponses immunes adaptatives a été relativement peu étudié. Le poumon de la souris contient deux types de macrophages : les macrophages alvéolaires (MA) et les macrophages interstitiels (MI), distincts phénotypiquement et localisés dans l’interstitium pulmonaire. Les MI, par leur localisation, sont idéalement situés pour interagir avec les CD. Nous avons ainsi pu observer par immunohistochimie des images de contact ou de grande proximité entre ces deux types cellulaires (Figure 2). Nous avons donc entrepris d’étudier la fonction de ces macrophages interstitiels dans la régulation de l’homéostasie pulmonaire [
14].  | Figure 2.
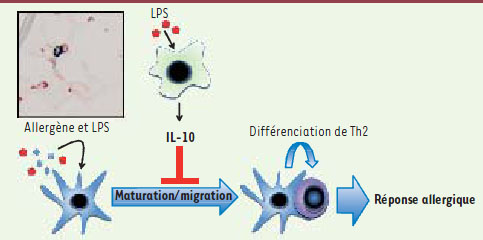
Les macrophages interstitiels induisent un état d’ignorance immunitaire en conditions physiologiques. Encart. Des cryo-coupes de poumons de souris ont été analysées par immunohistochimie afin d’identifier les macrophages interstitiels (MI, en rouge) et les cellules dendritiques (CD, en bleu). Sur cette photographie, le contact entre une CD et un MI peut être observé. Schéma. Modèle de la régulation de l’homéostasie immune pulmonaire par les MI en conditions physiologiques. Les CD (en bleu), lorsqu’elles sont exposées à un allergène accompagné d’endotoxine (LPS), comme cela se passe dans la majorité des situations physiologiques, devraient induire le développement de lymphocytes T auxiliaires de type 2 (Th2, en mauve) et subséquemment l’allergie pulmonaire. Dans notre modèle, la stimulation des MI par le LPS empêche ce processus. Les MI produisent alors la cytokine immunosuppressive IL-10, laquelle bloque la maturation et la migration des CD. Les réponses immunes adaptatives ne peuvent dès lors se développer et l’allergène est ignoré par le système immunitaire pulmonaire. |
Afin d’étudier l’interaction potentielle entre CD et macrophages, nous avons tout d’abord utilisé des modèles de coculture dans lesquels des CD et des macrophages, MI ou MA, étaient exposés à un antigène inoffensif et stimulés par du LPS (ajouté à une concentration similaire à celle de l’air ambiant). Les CD étaient ensuite injectées à des souris syngéniques receveuses, et la sensibilisation allergique des voies respiratoires des souris à l’encontre de l’antigène était étudiée. Nous avons observé que les CD cultivées seules ou en présence de MA induisaient une sensibilisation allergique des souris receveuses, mais pas les CD incubées en présence de MI. Ces dernières présentaient un phénotype plus immature et une activité migratoire diminuée par comparaison aux CD incubées seules ou en présence de MA. L’explication est la suivante : les MI, lorsqu’ils sont exposés au LPS, sécrètent de grandes quantités d’interleukine (IL)-10, une cytokine anti-inflammatoire qui bloque la maturation des CD et provoque leur paralysie. Ces résultats démontrent sans ambiguïté l’importance des MI dans l’homéostasie immune pulmonaire. Ce rôle est confirmé par les conséquences de la déplétion sélective des MI : celle-ci permet la sensibilisation des souris à un antigène inoffensif administré avec de faibles doses de LPS, un protocole qui n’induit pas de réponse chez les souris possédant leurs MI. Nous proposons donc un modèle dans lequel les MI, en conditions normales, sécrètent de l’IL-10 en réponse au LPS et, par ce biais, bloquent l’activité des CD, prévenant ainsi les réponses non désirables et potentiellement dangereuses à l’encontre d’antigènes inoffensifs (Figure 2). Dans ce modèle, la non-réponse aux antigènes inoffensifs est basée sur une ignorance, plutôt qu’une tolérance, de l’antigène par le système immunitaire. Le corollaire de cette hypothèse, que nous devons encore tester, est que la fonction des MI doit être modulée au cours des épisodes infectieux afin de permettre le développement de réponses protectrices. Par ailleurs, on peut également faire l’hypothèse qu’un déficit de la fonction des MI pourrait être à l’origine du développement d’un asthme atopique chez l’homme. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Bernstein DI. ABCs of asthma. Clin Cornerstone 2008; 8 : 9–25. 2. Willart MA, Lambrecht BN. The danger within: endogenous danger signals, atopy and asthma. Clin Exp Allergy 2009; 39 : 12–9. 3. Akbari O, DeKruyff RH, Umetsu DT. Pulmonary dendritic cells producing IL-10 mediate tolerance induced by respiratory exposure to antigen. Nat Immunol 2001; 2 : 725–31. 4. Akbari O, Freeman GJ, Meyer EH, et al. Antigen-specific regulatory T cells develop via the ICOS-ICOS-ligand pathway and inhibit allergen-induced airway hyperreactivity. Nat Med 2002; 8 : 1024–32. 5. de Heer HJ, Hammad H, Soullie T, et al. Essential role of lung plasmacytoid dendritic cells in preventing asthmatic reactions to harmless inhaled antigen. J Exp Med 2004; 200 : 89–98. 6. Thorn J, Rylander R. Airways inflammation and glucan in a rowhouse area. Am J Respir Crit Care Med 1998; 157 : 1798–803. 7. Douwes J, van der Sluis B, Doekes G, et al. Fungal extracellular polysaccharides in house dust as a marker for exposure to fungi: relations with culturable fungi, reported home dampness, and respiratory symptoms. J Allergy Clin Immunol 1999; 103 : 494–500. 8. Douwes J, Zuidhof A, Doekes G, et al. (1-3)-beta-D-glucan and endotoxin in house dust and peak flow variability in children. Am J Respir Crit Care Med 2000; 162 : 1348–54. 9. Michel O, Kips J, Duchateau J, et al. Severity of asthma is related to endotoxin in house dust. Am J Respir Crit Care Med 1996; 154 : 1641–6. 10. Rizzo M, Naspitz C, Fernández-Caldas E, et al. Endotoxin exposure and symptoms in asthmatic children. Pedriatr Allergy Immunol 1997; 8 : 121–6. 11. Milton D, Johnson D, Park J. Environmental endotoxin measurement: interference and sources of variation in the Limulus assay of house dust. Am Ind Hyg Assoc J 1997; 58 : 861–7. 12. Braun-Fahrlander C, Riedler J, Herz U, et al. Environmental exposure to endotoxin and its relation to asthma in school-age children. N Engl J Med 2002; 347 : 869–77. 13. Lambrecht BN, De Veerman M, Coyle AJ, et al. Myeloid dendritic cells induce Th2 responses to inhaled antigen, leading to eosinophilic airway inflammation. J Clin Invest 2000; 106 : 551–9. 14. Bedoret D, Wallemacq H, Marichal T, et al. Lung interstitial macrophages alter dendritic cell functions to prevent airway allergy in mice. J Clin Invest 2009; 119 : 3723–38. |