| |
| Med Sci (Paris). 2010 March; 26(3): 305–310. Published online 2010 March 15. doi: 10.1051/medsci/2010263305.Analyse de la spermatogenèse ex vivo Application à l’analyse de la toxicité testiculaire Marie-Hélène Perrard,1,2,3,4 Christophe Grenet,1,2,3,4 Nadia Prisant,5 Cendrine Geoffroy-Siraudin,6,7 Dominique Segretain,5 Marie-Roberte Guichaoua,6,7 Georges Pointis,5 and Philippe Durand1,2,3,4* 1Institut de génomique fonctionnelle de Lyon, Université Lyon I 2CNRS 3Inra 4École Normale Supérieure de Lyon, 46, allée d’Italie, 69364 Lyon Cedex 07, France 5Inserm U 895, Équipe 5 Physiopathology of germ cell control: genomic and non genomic mechanisms C3M, Université de Nice Sophia Antipolis, Université Paris Descartes, 45, rue des Saints-Pères, Paris, France 6Laboratoire de biologie de la reproduction, Hôpital de la conception, 147, boulevard Baille, Marseille 7Laboratoire de biogénotoxicologie et mutagenèse environnementale (EA1784), ECCOREV FR 3098 Aix-Marseille, Université/CNRS, France |
Les enjeux de la toxicologie testiculaire Plusieurs études suggèrent que l’exposition à des polluants présents dans l’environnement serait, en partie, responsable d’altérations de la fonction de reproduction masculine et de certaines pathologies testiculaires (diminution du nombre de spermatozoïdes, cancers, cryptorchidie, hypospadias) dont le nombre a augmenté au cours des cinq dernières décennies dans les pays industrialisés [1]. Des recherches ont été menées pour déterminer les effets délétères possibles d’une grande variété de produits chimiques sur la fertilité masculine. Ces études ont souligné la nécessité de clarifier les mécanismes d’action des différentes classes de ces produits au niveau des tissus impliqués. Toutefois, l’exploration de ces mécanismes in vivo peut être difficile dans un environnement où les hormones endogènes coexistent avec les composés chimiques et/ou pharmaceutiques étudiés. De plus en plus, les études de toxicologie font appel à la toxicogénomique, appliquée à des lignées de cellules en culture, pour identifier les gènes dont l’expression est modifiée par les toxiques. Cependant, cette approche n’est pas applicable à une étude toxicologique du fonctionnement testiculaire - toxicologie testiculaire - car il n’y a pas de lignée de cellules germinales « modèle » puisque la différenciation des cellules germinales est dépendante d’interactions avec les cellules somatiques du testicule. Les études in vitro réalisées jusqu’ici ont utilisé principalement des cultures primaires de cellules somatiques testiculaires (cellules de Leydig ou cellules de Sertoli) ou des lignées représentatives de ces cellules. Toutefois, de tels systèmes ne permettent pas d’étudier les effets de composés potentiellement toxiques sur la spermatogenèse. Peu d’études ont utilisé des incubations à court terme de cellules germinales, cultivées seules ou en présence de cellules de Sertoli, car la faible durée de vie de ces cultures réduit grandement leur utilité [2]. De surcroît, les molécules chimiques peuvent agir à différents moments de la vie d’un individu, et notamment durant la vie fœtale, qui est une des périodes critiques pour la fertilité masculine [3]. C’est, en effet, durant les premiers mois de la vie que les ébauches gonadiques se forment et que la différenciation testiculaire s’effectue, laquelle s’achèvera à la puberté avec le début de la spermatogenèse. C’est pourquoi, des systèmes de culture organotypique de fragments de testicules fœtaux humains ou de rongeurs ont été récemment développés [4]. Les tissus, ainsi cultivés, gardent pendant quelques jours leur organisation tridimensionnelle et leur fonction. Couplés à des études morphologiques, fonctionnelles et moléculaires, ces systèmes permettent d’analyser, sur une durée de 3 à 5 jours, les effets de substances sur le développement précoce du testicule et sur les gonocytes [5, 6], voire celui des rayons gamma sur ces cellules [7]. Outre que la disponibilité du tissu humain peut limiter une utilisation à grande échelle, ces systèmes, cependant, ne renseignent pas sur les effets éventuels des molécules auxquelles l’individu serait exposé plus tardivement [8], et qui pourraient altérer les différents types de cellules germinales qui se mettent en place au cours des phases de développement néonatal (spermatogonies), prépubertaire (spermatocytes), et pubertaire (spermatides et spermatozoïdes), ou les relations entre cellules testiculaires différenciées. |
Entrée en vigueur le 1er juin 2007, la réglementation européenne REACH1, (enregistrement, évaluation, autorisation et restrictions des substances chimiques) a pour objectif l’amélioration des connaissances des propriétés chimiques, toxiques et écotoxiques des substances utilisées dans la vie courante. Environ 30 000 substances chimiques, produites en quantité supérieure à une tonne par an, sont concernées par cette procédure qui sera gérée par l’Agence européenne des produits chimiques (ECHA). Les substances particulièrement préoccupantes, telles que les CMR (cancérigènes, mutagènes, reprotoxiques), PBT (persistantes, bioaccumulables et toxiques), vPvB (très persistantes et très bioaccumulables) ou les perturbateurs endocriniens, devront obtenir l’autorisation de la Commission européenne, qui s’appuiera sur les recommandations de l’ECHA. Leur utilisation pourra être soumise à restriction, voire être interdite. Selon la Commission européenne, REACH devrait coûter à l’industrie chimique et ses utilisateurs entre 2,8 et 5,2 milliards d’euros sur 11 ans. Les avantages anticipés pour l’environnement et la santé humaine seraient de l’ordre de 50 milliards d’euros sur une période de 30 ans. Pour les molécules concernées par REACH, il sera nécessaire d’effectuer une batterie de tests physicochimiques, d’écotoxicité et de toxicité. L’expérimentation animale nécessaire à ces tests pourrait entraîner l’utilisation de plusieurs millions d’animaux. Si REACH et la directive 86/609/CEE2 encouragent l’utilisation de méthodes alternatives comme les modèles cellulaires, la Commission européenne, pour autant, ne définit pas précisément quels tests alternatifs doivent être utilisés. L’évaluation repose donc sur des essais spécifiés par l’OCDE, où l’expérimentation animale est la règle puisque peu de méthodes alternatives ont été validées par cette organisation. |
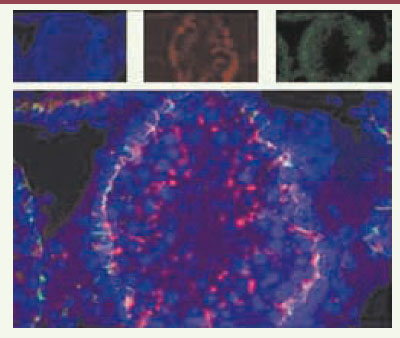
La spermatogenèse se déroule en trois phases : la prolifération des spermatogonies (cellules germinales souches diploïdes) ; la méiose, au cours de laquelle un spermatocyte donne quatre spermatides haploïdes, et la différenciation des spermatides en spermatozoïdes, ou spermiogenèse. Ces étapes se déroulent au sein de l’épithélium séminifère, où les cellules de Sertoli assurent un rôle de support architectural, de protection et de nutrition des cellules germinales, de régulation de la spermatogenèse, ainsi que la phagocytose des cellules germinales surnuméraires ou anormales et des corps résiduels des spermatides. La formation de jonctions serrées entre cellules de Sertoli permet la mise en place d’une barrière hématotesticulaire (Figure 1). Celle-ci s’établit au début de la puberté lors de l’entrée en méiose des premières cellules germinales et va jouer un rôle de protection contre une réaction auto-immune, et contre des polluants véhiculés par le sang ; elle régit également la composition du fluide testiculaire. Les cellules de Sertoli forment ainsi un microenvironnement indispensable au déroulement de la spermatogenèse. 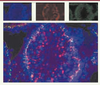 | Figure 1. Localisation des protéines jonctionnelles sur coupes histologiques de testicule d’un rat de 28 jours. L’étude en immunofluorescence d’une section transversale de testicule d’un rat de 28 jours révèle la présence d’occludine, protéine des jonctions serrées (fluorescence verte) et de connexine 43, protéine des jonctions communicantes (fluorescence rouge). Les noyaux des cellules sont colorés par du Hoescht 33342 (en bleu) (N. Prisant, P. Durand, D. Segretain, G. Pointis, communication personnelle). |
La spermatogenèse est régulée par des hormones hypothalamohypophysaires (la gonadotropin-releasing hormone Gn-RH, la luteinizing hormone LH et la follicle-stimulating hormone FSH), par des hormones, facteurs de croissance et cytokines synthétisés et sécrétés par les cellules somatiques testiculaires (cellules de Leydig, péritubulaires, de Sertoli) et les cellules germinales elles-mêmes, et adsorbés sur la matrice extracellulaire. Les jonctions intercellulaires adhérentes, communicantes (gap-junction) et serrées entre cellules de Sertoli et cellules germinales (Figure 1), jouent également un rôle important dans la spermatogenèse. Cette régulation intratesticulaire reste imparfaitement connue. Une des raisons est que certains effecteurs peuvent compenser, au moins en partie, l’absence d’autres régulateurs. De plus, la plupart des facteurs produits dans les testicules sont très exprimés ailleurs dans l’organisme où ils exercent des rôles différents. C’est pourquoi, les modèles animaux modifiés génétiquement, par invalidation ou surexpression de gènes candidats, n’ont pas toujours été à la hauteur des espérances. Même si certains de ces modèles ont permis de comprendre le rôle de plusieurs facteurs sur les premières étapes de la spermatogenèse, l’action de ces facteurs sur les étapes tardives de la spermatogenèse ne peut être étudiée puisque l’invalidation du gène qui les code entraîne un blocage précoce de celle-ci [9]. Pour pallier certaines de ces difficultés, nous développons, depuis 12 ans, des systèmes de culture permettant d’étudier ex vivo différentes étapes de la spermatogenèse. |
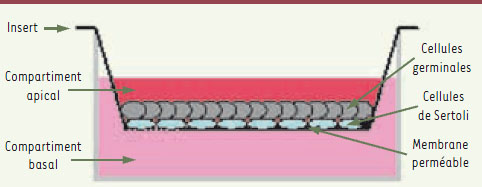
Études physiologiques de la spermatogenèse dans des modèles ex vivoDeux systèmes de coculture de cellules germinales et de cellules de Sertoli de rat ont été établis. Ces cultures, réalisées en chambres de culture bicamérales (à deux compartiments) (Figure 2), permettent la formation et/ou le maintien de la barrière hématotesticulaire (Figure 3). Dans le premier système, différents types de cellules germinales purifiées sont cultivés sur une couche de cellules de Sertoli [10], alors que dans le second système, des morceaux de tubes séminifères sont mis en culture [11, 12]. Ces systèmes permettent d’étudier plusieurs paramètres, au cours d’une période de plus de quatre semaines de culture : (1) la physiologie de la barrière hématotesticulaire ; (2) la survie et la mort des cellules somatiques et germinales ; (3) la prolifération des cellules de Sertoli et des spermatogonies ; (4) les divisions méiotiques (Figure 4) ; (5) les caractéristiques cytogénétiques des cellules germinales ; (6) les premiers stades de la spermiogenèse ; (7) le rôle de la matrice extracellulaire ; (8) l’expression de gènes spécifiques dans les cellules germinales ou somatiques (anlyse du transcriptome) ; (9) le profil d’expression et de sécrétion des protéines et peptides exprimés par les différentes cellules (analyse du protéome).  | Figure 2. Système de coculture des cellules germinales avec des cellules de Sertoli en chambre bicamérale. Ce système de coculture est modifiable à façon. Ainsi, il est possible d’ajouter une matrice extracellulaire (soit synthétisée naturellement soit artificielle de type matrigel) entre la membrane et les cellules et de cultiver d’autres cellules somatiques testiculaires (cellules de Leydig par exemple) au fond du puits de culture. |
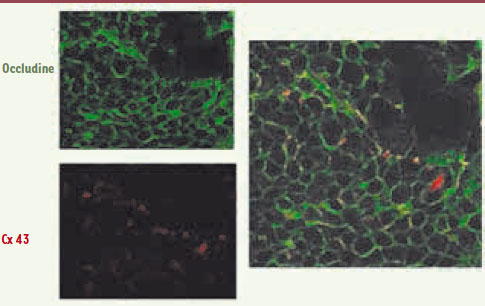
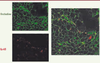 | Figure 3. Caractérisation de tubules séminifères de rats cultivés in vitro. L’étude en immunofluorescence d’une culture de 12 jours de tubes séminifères de rats âgés de 20 jours révèle la présence d’occludine (fluorescence verte) et de connexine 43 (fluorescence rouge) (N. Prisant, P. Durand, D. Segretain, G. Pointis, communication personnelle). |
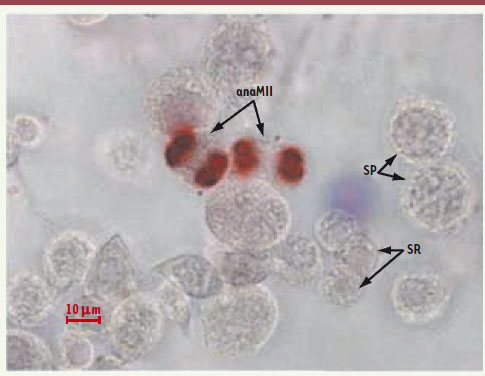
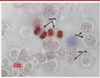 | Figure 4. Aspect d’une coculture de spermatocytes au stade pachytène élutriés avec des cellules de Sertoli. Les spermatocytes pachytènes sont cocultivés avec les cellules de Sertoli. La mise au point du microscope est effectuée sur les cellules germinales qui adhèrent au tapis sertolien. Les cellules en division sont marquées par un anticorps anti-phospho-histone H3, les noyaux cellulaires sont contre-colorés à l’hématoxyline. On visualise deux anaphases de deuxième division de méiose (anaMII), des spermatocytes pachytènes (SP), des spermatides rondes (SR). L’analyse est faite au jour 3 de la culture. La barre représente 10 µm. |
Un aspect important des résultats obtenus avec les modèles ex vivo est leur pertinence par rapport au processus physiologique (in vivo). Les systèmes développés au laboratoire ont été validés sur de nombreux points de la physiologie. Nous avons ainsi montré que l’ensemble du processus méiotique d’un mammifère peut se dérouler ex vivo [13] et que les caractéristiques de la méiose qui se déroule ex vivo sont très proches de ce qui se produit dans les testicules de rat à la puberté [14]. Par ailleurs, nous avons montré que les pourcentages de spermatocytes aux différents stades de la prophase I- leptotène, zygotène, pachytène et diplotène3 - sont les mêmes chez des rats de 42 jours et dans des tubes séminifères prélevés chez des rats âgés de 23 jours et maintenus en culture 16 jours, ce qui indique un développement similaire in vivo et ex vivo [Geoffroy-Siraudin C, Perrard MH, soumis pour publication]. Ces systèmes ont permis d’étudier certains mécanismes de régulation de la spermatogenèse. Après avoir observé que les deux divisions méiotiques sont bloquées par les inhibiteurs pharmacologiques du MPF (M-phase promoting factor) [15], il a été démontré que la progression méiotique des spermatocytes nécessite l’action des MAP kinases sertoliennes et des contacts étroits entre les cellules germinales et les cellules de Sertoli [16]. In vivo et ex vivo, la connexine 43 (Cx43), protéine transmembranaire constituant certaines jonctions de type gap, est détectée entre les cellules de Sertoli et entre les cellules de Sertoli et les cellules germinales (Figures 1 et 3). Or, une étude récente montre l’absence de cellules germinales en aval des spermatocytes primaires lorsque la Cx43 est remplacée par la Cx26 chez des souris transgéniques [17]. L’approche ex vivo a permis de montrer que la Cx43 localisée entre les cellules de Sertoli et les spermatogonies est impliquée dans la survie de ces cellules germinales et que la Cx43 des jonctions entre cellules de Sertoli participe au contrôle de la prolifération de ces dernières [18]. De même, les modèles de knock-out (KO) conditionnel pour le gène Cx43, montrent que la Cx43 est essentielle au contrôle de la prolifération et de la différenciation des cellules de Sertoli [19]. Dans ces cocultures, Vigier et al. ont montré que la FSH et la testostérone, à des concentrations physiologiques, ont des effets positifs et redondants sur les deux divisions de la méiose et sur l’expression de gènes exprimés par les cellules germinales haploïdes [20]. Ces résultats ont été depuis confirmés par d’autres équipes qui utilisent des modèles de souris KO [21, 22]. Dans les tubes séminifères, le NGF (nerve growth factor) et ses deux récepteurs sont exprimés de manière similaire in vivo et ex vivo et le NGF et le TGF-β1 (transforming growth factor) régulent négativement la deuxième division de méiose ex vivo [23, 24]. De plus, le NGF et le TGF-β1 ont un effet totalement redondant sur cette étape [25]. Cette redondance offre une explication aux résultats d’une étude, faite chez des souris SCID (severe combined immunodeficient), qui rapportait l’absence d’effet de l’invalidation du Tgf-β1 sur la méiose [26]. En effet, ce sont les spermatocytes pachytènes et les spermatides rondes précoces qui synthétisent le TGF-β1 en plus grande abondance [27], celles-là mêmes qui synthétisent le NGF [24]. Par conséquent, il est raisonnable de penser que l’absence d’effet observé, dans cette étude, est due à l’effet redondant du NGF sur cette étape. Concernant l’étape mitotique ex vivo, Fouchécourt et al. ont rapporté un effet inhibiteur du GDNF (Glial cell line-derived neurotrophic factor) sur l’entrée en phase S d’une grande population de spermatogonies différenciées de type A et un effet positif sur l’entrée en phase S d’une petite population de spermatogonies indifférenciées [28]. Ces études corroborent les résultats des études in vivo [29]. L’ensemble de ces données démontre que ces systèmes de coculture permettent d’étudier les mécanismes physiologiques impliqués dans la spermatogenèse. |
Évaluation du potentiel toxique des produits chimiques ex vivoCes systèmes de coculture sont aussi pertinents pour évaluer les effets toxiques de substances chimiques sur la spermatogenèse, tout en réduisant (de 10 à 20 fois) le nombre d’animaux utilisés. Soulignons que ces systèmes permettent d’étudier les effets d’une substance ajoutée dans le compartiment basal de la chambre bicamérale, et donc de mimer ce qui pourrait se produire dans le testicule. En effet, les jonctions cellulaires, entre les cellules de Sertoli et entre les cellules de Sertoli et les cellules germinales, sont maintenues ou reformées dans ces cultures. Par conséquent, avant d’atteindre les cellules germinales, les composés doivent traverser cette barrière. En revanche, dans une culture classique, un composé peut être toxique pour les cellules germinales différenciées, car il est directement en contact avec celles-ci, tandis qu’in vivo, il peut ne pas avoir accès au compartiment des tubes séminifères où résident ces cellules germinales. Dans ces modèles de culture dans des chambres à plusieurs compartiments, il est possible d’étudier un grand nombre de paramètres permettant de déterminer les mécanismes de la toxicité gonadique de faibles concentrations de composés organiques ou minéraux. Il est également possible de corréler les perturbations somatiques et germinales observées au cours de la culture aux modifications du transcriptome/protéome de ces cellules. Il convient de souligner que la connaissance du mode d’action de ces molécules aidera à vérifier si les observations faites chez les animaux sont transposables à l’homme, ce qui est un problème majeur dans ce type d’étude. L’analyse des altérations observées dans une même population cellulaire exposée ou non à la substance à analyser permet de s’affranchir d’une grande partie de la variabilité inter-animaux rencontrée in vivo et d’optimiser ainsi la puissance des tests statistiques4. Un intérêt supplémentaire de ces systèmes de culture est qu’ils permettent de tester l’effet de combinaisons de molécules à de faibles concentrations pendant une période de plusieurs semaines. Récemment, ces systèmes ont été utilisés pour étudier les effets de métaux lourds et des radiations ionisantes. Geoffroy-Siraudin et al. ont montré qu’une concentration de 1 µg/l de chrome altère gravement les complexes synaptonémaux des cellules méiotiques [soumis pour publication]. Perrin et al. ont comparé des cellules germinales exposées ou non à une irradiation par rayons gamma. Pour les spermatocytes non irradiés, le test des comètes (ou single cell gel electrophoresis), une technique de quantification et d’analyse des dommages de l’ADN au sein d’une cellule, a révélé la présence de cassures dans l’ADN, dont le nombre a diminué au cours de la coculture, témoignant de l’implication de mécanismes de réparation de l’ADN associés à la recombinaison méiotique. Dans les cellules irradiées, l’évolution des cassures d’ADN a été fortement modifiée [30]. |
Nous assistons depuis quelques années à un accroissement de la diversité des molécules présentes dans notre environnement, lesquelles peuvent entraîner des effets délétères sur l’organisme, même à des doses très faibles (micropolluants). Il devient indispensable de mieux connaître leur impact sur la santé humaine et sur l’environnement. Les systèmes de coculture développés au laboratoire, couplés à des méthodes analytiques performantes, sont un outil pertinent non seulement pour étudier la physiologie de la spermatogenèse mais aussi pour rechercher l’effet toxique sur la reproduction de substances polluantes et étudier les mécanismes moléculaires liés à leur toxicité. Enfin, ces systèmes répondent à la forte demande sociétale de réduire le nombre d’animaux utilisés pour les études biomédicales et toxicologiques. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Les auteurs remercient par ordre alphabétique : Anne Damestoy, Sophie Fouchécourt, Muriel Godet, Dominique Hue, Hervé Lejeune, Cécile Marret, Guillaume Montillet, Jean-Claude Nicolle, Ingrid Plotton, Christophe Staub, Michèle Vigier, Michèle Weiss pour leur participation aux études menées dans « l’équipe Durand ».
M.H. Perrard et C. Grenet ont contribué de manière équivalente à la rédaction de cet article. |
Footnotes |
1. Olesen IA, Sonne SB, Hoei-Hansen CE, et al. Environment, testicular dysgenesis and carcinoma in situ testis. Best Pract Res Clin Endocrinol Metab 2007; 21 : 462–78. 2. Pineau C, Dupaix A, Jégou B. The coculture of Sertoli cells and germ cells: applications in toxicology. Toxicol In Vitro 1999; 13 : 513–20. 3. Delbès G, Levacher C, Duquenne C, Habert R. Le testicule fœtal est-il en danger ? Med Sci (Paris) 2005; 21 : 1083–8. 4. Lambrot R, Livera G, Coffigny H, et al. A new method for toxicity assays on human and mouse fetal testis. Biochimie 2006; 88 : 1831–5. 5. Lambrot R, Muczynski V, Lécureuil C, et al. Phthalates impair germ cell development in the human fetal testis in vitro without change in testosterone production. Environ Health Perspect 2009; 117 : 32–7. 6. Chauvigné F, Menuet A, Lesné L, et al. Time- and dose-related effects of di-(2-ethylhexyl) phthalate and its main metabolites on the function of the rat fetal testis in vitro. Environ Health Perspect 2009; 117 : 515–21. 7. Lambrot R, Coffigny H, Pairault C, et al. High radiosensitivity of germ cells in human male fetus. J Clin Endocrinol Metab 2007; 92 : 2632–9. 8. Cravedi JP, Zalko D, Savouret JF, et al. Le concept de perturbation endocrinienne et la santé humaine. Med Sci (Paris) 2007; 23 : 198–204. 9. Escalier D. Knockout mice in the service of reproduction. Gynecol Obstet Fertil 2008; 36 : 1224–9. 10. Weiss M, Vigier M, Hue D, et al. Pre- and postmeiotic expression of male germ cell-specific genes throughout 2-week cocultures of rat germinal and Sertoli cells. Biol Reprod 1997; 57 : 68–76. 11. Hue D, Staub C, Perrard-Sapori MH, et al. Meiotic differentiation of germinal cells in three-week cultures of whole cell population from rat seminiferous tubules. Biol Reprod 1998; 59 : 379–87. 12. Marret C, Durand P. Culture of porcine spermatogonia: effects of purification of the germ cells, extracellular matrix and fetal calf serum on their survival and multiplication. Reprod Nutr Dev 2000; 40 : 305–19. 13. Staub C, Hue D, Nicolle JC, et al. The whole meiotic process can occur in vitro in untransformed rat spermatogenic cells. Exp Cell Res 2000; 260 : 85–95. 14. Perrard MH, Hue D, Staub C, et al. Development of the meiotic step in testes of pubertal rats: comparison between the in vivo situation and under in vitro conditions. Mol Reprod Dev 2003; 65 : 86–95. 15. Godet M, Damestoy A, Mouradian S, et al. Key role for cyclindependent kinases in the first and second meiotic divisions of rat spermatocytes. Biol Reprod 2004; 70 : 1147–52. 16. Godet M, Sabido O, Gilleron J, Durand P. Meiotic progression of rat spermatocytes requires mitogen-activated protein kinases of Sertoli cells and close contacts between the germ cells and the Sertoli cells. Dev Biol 2008; 315 : 173–88. 17. Winterhager E, Pielensticker N, Freyer J, et al. Replacement of connexin43 by connexin26 in transgenic mice leads to dysfunctional reproductive organs and slowed ventricular conduction in the heart. BMC Dev Biol 2007; 7 : 26. 18. Gilleron J, Carette D, Durand P, et al. Connexin 43 a potential regulator of cell proliferation and apoptosis within the seminiferous epithelium. Int J Biochem Cell Biol 2009; 41 : 1381–90. 19. Sridharan S, Simon L, Meling DD, et al. Proliferation of adult sertoli cells following conditional knockout of the Gap junctional protein GJA1 (connexin 43) in mice. Biol Reprod 2007; 76 : 804–12. 20. Vigier M, Weiss M, Perrard MH, et al. The effects of FSH and of testosterone on the completion of meiosis and the very early steps of spermiogenesis of the rat: an in vitro study. J Mol Endocrinol 2004; 33 : 729–42. 21. Abel MH, Baker PJ, Charlton HM, et al. Spermatogenesis and sertoli cell activity in mice lacking sertoli cell receptors for follicle-stimulating hormone and androgen. Endocrinology 2008; 149 : 3279–85. 22. De Gendt K, Swinnen JV, Saunders PT, et al. A Sertoli cell-selective knockout of the androgen receptor causes spermatogenic arrest in meiosis. Proc Natl Acad Sci USA 2004; 101 : 1327–32. 23. Damestoy A, Perrard MH, Vigier M, et al. Transforming growth factor beta-1 decreases the yield of the second meiotic division of rat pachytene spermatocytes in vitro. Reprod Biol Endocrinol 2005; 3 : 22. 24. Perrard MH, Vigier M, Damestoy A, et al. Beta-nervegrowth factor participates in an auto/paracrine pathway of regulation of the meiotic differentiation of rat spermatocytes. J Cell Physiol 2007; 210 : 51–62. 25. Perrard MH, Durand P. Redundancy of the effect of TGFbeta1 and beta-NGF on the second meiotic division of rat spermatocytes. Microsc Res Tech 2009; 72 : 596–602. 26. Ingman WV, Robertson SA. Transforming growth factor-beta1 null mutation causes infertility in male mice associated with testosterone deficiency and sexual dysfunction. Endocrinology 2007; 148 : 4032–43. 27. Teerds KJ, Dorrington JH. Localization of transforming growth factor beta 1 and beta 2 during testicular development in the rat. Biol Reprod 1993; 48 : 40–5. 28. Fouchécourt S, Godet M, Sabido O, Durand P. Glial cell-line-derived neurotropic factor and its receptors are expressed by germinal and somatic cells of the rat testis. J Endocrinol 2006; 190 : 59–71. 29. Meng X, Lindahl M, Hyvonen ME, et al. Regulation of cell fate decision of undifferentiated spermatogonia by GDNF. Science 2000; 287 : 1489–93. 30. Perrin J, Lussato D, De Meo M, et al. Evolution of DNA strand-breaks in cultured spermatocytes: the Comet Assay reveals differences in normal and gamma-irradiated germ cells. Toxicol In Vitro 2007; 21 : 81–9. |