| |
| Med Sci (Paris). 2010 May; 26(5): 457–458. Published online 2010 May 15. doi: 10.1051/medsci/2010265457.Interactions entre cellules épithéliales normales et transformées Conflits de voisinage Sophie Dupré-Crochet,1,2* Catherine Hogan,3 and Yasuyuki Fujita3* 1Université Paris-Sud, UMR 757, Orsay F-91405, France 2Inserm U757,Orsay F-91405, France 3MRC Laboratory for Molecular Cell Biology and Cell Biology Unit, University College of London, London, WC1E 6BT, Royaume-Uni MeSH keywords: Animaux, Communication cellulaire, Transformation cellulaire néoplasique, Protéines de Drosophila, génétique, physiologie, Drosophila melanogaster, cytologie, Cellules épithéliales, Femelle, Gènes ras, Gènes src |
Des expériences sur la drosophile… De nombreuses études, effectuées sur l’organisme modèle Drosophila melanogaster, ont montré l’importance des interactions locales entre cellules normales et cellules transformées. Les premières expériences ont été effectuées en 1975 avec des souches mutantes appelées Minute. Les mutations Minute affectent des gènes codant des protéines ribosomales ou d’autres protéines impliquées dans la traduction. Les études ont montré que si, dans des chimères, des cellules hétérozygotes pour un gène Minute sont entourées par des cellules de génotype sauvage, elles sont éliminées par apoptose [
1,
2]. L’apoptose n’a pas été observée dans des drosophiles dont toutes les cellules sont hétérozygotes pour ce gène Minute. Ces résultats indiquent que la présence des cellules sauvages induit l’apoptose des cellules hétérozygotes pour ce gène Minute [2]. Des relations similaires ont été observées entre des cellules de drosophiles possédant différents niveaux d’expression du gène Myc (dMyc). Ce gène code un facteur de transcription qui stimule l’expression de gènes impliqués dans la croissance et la prolifération cellulaire. Ainsi, des cellules exprimant fortement le gène dMyc induisent l’apoptose de cellules voisines qui expriment dMyc à un niveau plus faible [
3,
4]. D’autres résultats récents montrent que, dans des disques imaginaux des ailes, les cellules surexprimant la kinase Src et entourées par des cellules sauvages sont exclues de façon basale de l’épithélium des disques imaginaux et entrent en apoptose [
5]. Un phénomène similaire d’exclusion a été observé pour des cellules exprimant l’oncogène RasV12 [
6]. Ces résultats montrent donc, chez la drosophile, l’existence d’interactions entre des cellules normales et transformées. De telles interactions existent-elles chez les mammifères ? |
…aux études chez les mammifères La majorité des cancers chez l’homme se produisent au niveau des épithéliums. Au tout début de la carcinogenèse, une seule cellule est transformée en raison de mutations dans des gènes suppresseurs de tumeurs ou dans des proto-oncogènes. C-Src, un proto-oncogène, est une tyrosine kinase qui phosphoryle de nombreuses protéines sur des résidus tyrosines. Src appartient à une famille de protéines kinases ayant de multiples rôles dans la cellule, incluant la régulation de la croissance, de l’adhésion et de la migration cellulaires [
7]. La forme virale de c-Src, la protéine du virus du sarcome de Rous (v-Src), a été le premier oncogène identifié [
8]. Afin d’étudier les interactions entre des cellules normales et des cellules exprimant la kinase Src constitutivement active, nous utilisons comme modèle cellulaire des cellules épithéliales transformées avec une forme thermosensible de la protéine v-Src (cellules v-Src). Nous co-cultivons ces cellules avec des cellules épithéliales non transformées et, lorsque la monocouche épithéliale est formée, un changement de température permet d’activer la kinase Src dans les cellules transformées. Le devenir des cellules dans cette monocouche épithéliale est alors analysé par vidéomicroscopie. Les cellules exprimant v-Src sont fréquemment exclues. Une extrusion de ces cellules est observée à la surface apicale de la monocouche. Celle-ci s’effectue de façon indépendante de l’apoptose et n’a pas lieu lorsque les cellules entourant les cellules v-Src sont également des cellules v-Src. La présence de cellules normales autour des cellules v-Src est donc nécessaire à l’extrusion apicale. Les quelques cellules v-Src qui n’ont pas été exclues de la monocouche présentent des changements morphologiques : une forme ronde et une hauteur plus importante le long de l’axe apico-basal [
9]. L’extrusion apicale des cellules exprimant Src constitutivement active a été également observée in vivo en induisant l’expression de v-Src dans certaines cellules de la monocouche épithéliale externe de l’embryon du poisson zèbre [9]. Le modèle cellulaire décrit précédemment permet de rechercher les acteurs moléculaires de l’extrusion. L’activité de la myosine II et de la protéine FAK (focal adhesion kinase) est accrue dans les cellules v-Src lorsque celles-ci sont entourées par des cellules normales. L’augmentation de l’activité de la myosine-II, des protéines FAK (focal adhesion kinase) et MAPK (mitogen activated protein kinase) est impliquée dans l’extrusion apicale des cellules v-Src, la myosine-II et FAK fonctionnant en amont de MAPK [9]. |
L’extrusion apicale des cellules transformées… Pourquoi ? Comment ? Les cellules transformées par les oncogènes v-Src ou RasV12 modulent leur forme et leur cytosquelette de manière similaire lorsqu’elles sont entourées par des cellules non transformées (Figure 1) [6, 9]. Des mécanismes communs sont donc impliqués dans l’extrusion apicale de ces cellules transformées. En outre, la présence des modifications décrites ci-dessus dans les cellules transformées suggère que celles-ci détectent la présence des cellules normales qui les entourent. Comment les cellules transformées et les cellules normales peuvent-elles reconnaître leurs différences ? Des études suggèrent que les cellules peuvent détecter la plus ou moins grande rigidité de leur environnement et répondre à celle-ci [
10]. Des études de microscopie à force atomique indiquent que les cellules v-Src et RasV12 ont une plus grande élasticité que les cellules normales [6, 9]. Il est donc possible que les cellules normales et transformées détectent cette différence de propriété physique entre elles. Des études ultérieures seront nécessaires pour élucider le mécanisme de reconnaissance mis en jeu et les voies de signalisation déclenchées.
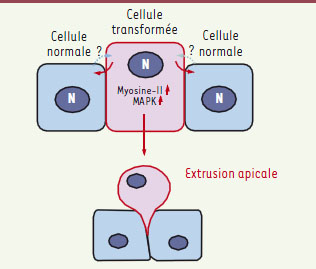
 | Figure 1.
Modèle d’extrusion apicale des cellules épithéliales transformées par les oncogènes c-Src ou RasV12. Ces cellules, entourées par des cellules épithéliales normales, modulent leur cytosquelette (activation de la myosine-II) et leur forme. L’activité accrue de la myosine-II et de MAPK dans ces cellules transformées est impliquée dans leur extrusion apicale. La nature des interactions entre cellules normales et transformées provoquant cette extrusion reste à découvrir. N : noyau. |
L’extrusion apicale des cellules transformées a été observée dans un système cellulaire modèle. Il reste à montrer que cette extrusion apicale a vraiment lieu chez l’homme au tout début de la carcinogenèse. Pour former des métastases, les cellules transformées doivent migrer de façon basale hors du feuillet épithélial et pénétrer dans la matrice. Par conséquent, une extrusion apicale des cellules transformées pourrait être un mécanisme de protection contre la progression de la carcinogenèse. Si nous parvenions à mieux comprendre les interactions entre cellules normales et transformées, il serait alors possible de développer une nouvelle thérapie contre les cancers : l’élimination des cellules cancéreuses avec l’aide des cellules normales qui les entourent. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient M.C. Faure, J.P. Mauger et O. Nüsse pour leur relecture du manuscrit et M. Kajita pour son aide dans l’élaboration de celui-ci.
|
1. Morata G, Ripoll P. Minutes: Mutants of Drosophila autonomously affecting cell division rate. Dev Biol 1975; 42 : 211–21. 2. Diaz B, Moreno E. The competitive nature of cells. Exp Cell Res 2005; 306 : 317–22. 3. Moreno E, Basier K. dMyc transforms cells into super-competitors. Cell 2004; 117 : 117–29. 4. De la Cova C, Abril M, Bellosta P, et al. Drosophila Myc regulates organ size by inducing cell competition. Cell 2004; 117 : 107–16. 5. Vidal M, Larson DE, Cagan RL. Csk-deficient boundary cells are eliminated from normal Drosophila epithelia by exclusion, migration and apoptosis. Dev Cell 2006; 10 : 33–44. 6. Hogan C, Dupre-Crochet S, Norman M, et al. Characterization of the interface between normal and transformed epithelial cells. Nat Cell Biol 2009; 11 : 460–7. 7. Parsons SJ, Parsons JT. Src family kinases, key regulators of signal transduction. Oncogene 2004; 23 : 7906–9. 8. Hunter T, Sefton BM. Transforming gene product of Rous sarcoma virus phosphorylates tyrosine. Proc Natl Acad Sci USA 1980; 77 : 1311–5. 9. Kajita M, Hogan C, Harris A.R, et al. Interaction with surrounding normal epithelial cells influences signalling pathways and behaviour of Src-transformed cells. J Cell Sci 2009; 123 : 171–80. 10. Vogel V, Sheetz M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol 2006; 7 : 265–75. |