| |
| Med Sci (Paris). 2010 June; 26(6-7): 566–568. Published online 2010 June 15. doi: 10.1051/medsci/2010266-7566.Parvalbumine et régulation du transport ionique dans le tube contourné distal du rein Hendrica Belge and Olivier Devuyst* Service de néphrologie, Faculté de médecine, Université catholique de Louvain, Cliniques universitaires Saint-Luc, 10, avenue Hippocrate, B-1200 Bruxelles, Belgique MeSH keywords: Transport biologique, Syndrome de Gitelman, physiopathologie, Homéostasie, Humains, Ions, métabolisme, Tubules contournés distaux, physiologie, Parvalbumines |
Chaque jour, nos reins filtrent environ 180 litres de plasma et réabsorbent plus de 99 % du sodium filtré, ce qui correspond à plus d’un kilogramme de sel (NaCl). Cette réabsorption massive de NaCl dépend de mécanismes opérant dans les cellules épithéliales bordant divers segments tubulaires spécialisés au niveau du néphron [
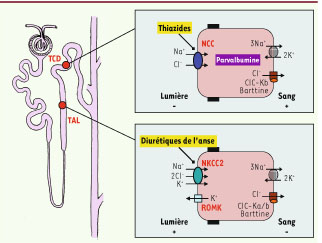
1]. Ainsi, les cellules du tube proximal du rein réabsorbent les deux tiers environ de la charge filtrée, alors que les segments plus distaux du néphron portion épaisse ascendante de l’anse de Henle (TAL, thick ascending limb) et tube contourné distal (TCD) sont responsables de la réabsorption de 25 % et de 5 à 10 % du NaCl filtré, respectivement. La réabsorption de NaCl dans ces deux segments peut être inhibée par des agents diurétiques. Les diurétiques agissant au niveau de l’anse (furosémide, bumétanide), qui bloquent le cotransporteur Na+−K+−2Cl− (NKCC) au niveau du TAL, sont de puissants agents utilisés pour traiter la rétention hydrosaline, alors que les dérivés thiazidiques (hydrochlorothiazide, bendrofluméthiazide, indapamide…), qui bloquent le cotransporteur Na+−Cl- (NCC) au niveau du TCD, sont largement utilisés dans le traitement de l’hypertension artérielle (Figure 1).  | Figure 1
Réabsorption du NaCl dans la portion épaisse ascendante (TAL) de l’anse de Henle et dans le tube contourné distal (TCD) du rein. Environ 25 % du NaCl filtré est réabsorbé dans le TAL via le cotransporteur apical Na+−K+−2Cl− (NKCC2, inhibé par les diurétiques de l’anse), organisé en parallèle avec le canal K+ apical ROMK (renal outer medullary K) afin d’assurer le recyclage de K+. La Na+−K+-ATPase et les canaux Cl−, ClC−Ka et ClC−Kb, associés à la sous-unité béta régulatrice barttine assurent la sortie des ions Na+ et Cl−. Le cotransporteur Na+−Cl− NCC, sensible aux diurétiques thiazidiques, assure 5 % à 10 % de la réabsorption de NaCl dans le TCD. Ce processus est influencé par l’expression spécifique de la parvalbumine qui régule la signalisation calcique intracellulaire dans ce segment. |
|
Cotransporteur NCC et syndrome de Gitelman Outre le cotransporteur NCC sensible aux thiazides, les cellules de la portion initiale du TCD possèdent un canal chlorure ClC-Kb associé à une sous-unité (barttine) au pôle basolatéral. Elles sont également impliquées dans la réabsorption active du Ca2+ et du Mg2+
via les canaux apicaux TRPV5 (Transient receptor potential cation channel subfamily V member 5) et TRPM6, respectivement. La diffusion cytosolique des cations divalents se fait par liaison aux tampons calbindines (CB-D28k et CB-D9k) et l’expulsion basolatérale via une Ca2+−ATPase et un échangeur Na+-Ca2+ (NCX1). Les mécanismes de transport opérant dans le TCD sont perturbés dans le syndrome de Gitelman, une maladie autosomique récessive (prévalence 1/50 000) qui associe déplétion sodée, hypokaliémie, alcalose métabolique, hypomagnésémie et hypocalciurie. Le syndrome de Gitelman est causé par des mutations invalidantes du gène SLC12A3 codant pour le cotransporteur apical NCC [
2]. L’inactivation de NCC induit une perte de sel et une contraction volémique, stimulant l’axe rénine-angiotensine-aldostérone et entraînant une réabsorption électrogénique de Na+ dans le canal collecteur via le canal épithélial sodique ENaC. Ce dernier processus stimule la sécrétion distale des cations K+ et H+, induisant une hypokaliémie et une alcalose métabolique [
3]. Par ailleurs, la contraction volémique stimule la réabsorption de Na+ dans le tube proximal, ainsi qu’une réabsorption paracellulaire de Ca2+ pouvant rendre compte de l’hypocalciurie typiquement associée au syndrome de Gitelman ou à la prise de diurétiques thiazidiques [
4]. Des travaux récents ont permis de mieux comprendre les mécanismes de transport opérant au niveau du TCD, y compris le rôle inattendu de la parvalbumine un tampon calcique spécifiquement exprimé dans ce segment du néphron. |
La parvalbumine, protéine à expression tissulaire restreinte La parvalbumine appartient à la classe des protéines de type calmoduline (ou EF-hand) qui, en liant le Ca2+ cytosolique, régulent une série de processus cellulaires essentiels incluant l’exocytose, la contraction musculaire, la transcription, la prolifération et l’homéostasie calcique [
5]. La parvalbumine est codée par le gène PVALB localisé au niveau du chromosome 22 (22q12-q13.1) chez l’homme. Cette protéine cytosolique de 12 kDa possède deux motifs conservés hélice-boucle-hélice capables de lier des ions Ca2+ et Mg2+. À l’état basal, la parvalbumine est liée au Mg2+. Une augmentation du Ca2+ intracellulaire induit une dissociation lente de Mg2+ suivie d’une liaison au Ca2+ [
6]. La distribution tissulaire de la parvalbumine chez les vertébrés est restreinte à quelques cellules métaboliquement actives comme les fibres musculaires striées squelettiques à contraction/relaxation rapide ainsi que les cellules nerveuses contenant le neurotransmetteur GABA. L’étude des souris invalidées Pvalb
-/- a démontré que la parvalbumine facilite la relaxation musculaire en jouant un rôle de tampon calcique [
7]. Dans le système nerveux central, la parvalbumine peut moduler l’amplitude et le décours de courants calciques intracellulaires dans les terminaisons nerveuses lors d’un potentiel d’action et intervient également dans la régulation des effets inhibiteurs du GABA [6]. |
Parvalbumine et régulation de NCC Dans le rein, la parvalbumine est exclusivement exprimée dans la partie proximale du TCD, étroitement colocalisée avec NCC [
8,
9]. L’analyse phénotypique des souris Pvalb
-/- a permis de mieux comprendre le rôle de la parvalbumine dans les mécanismes de transport opérant dans le TCD [9]. En effet, les souris Pvalb
-/- présentent un phénotype associant perte sodique modérée, hyperaldostéronisme secondaire et kaliurie augmentée, diminution de la clairance du lithium endogène suggérant une réabsorption compensatrice de sodium au niveau du tube proximal, et une hypocalciurie associée à une densité osseuse majorée. Ce phénotype ressemble beaucoup au syndrome de Gitelman. En outre, les souris Pvalb
-/- présentent une diminution très significative de l’expression de NCC au niveau du TCD, reflétée par l’absence de réponse aux thiazides. L’hypothèse du lien entre la parvalbumine, la régulation de NCC, la réabsorption de NaCl et la réponse aux diurétiques thiazidiques a été soutenue par des expériences effectuées sur des cultures cellulaires. Ces travaux, menés sur une lignée dérivée du TCD de souris (mTCD) ont démontré que l’induction d’une diminution (knock-down) de l’expression de la parvalbumine par divers siARN se traduit par une diminution spécifique de l’expression endogène de NCC. Par ailleurs, à l’instar de son rôle de tampon calcique dans les cellules musculaires et neuronales, la parvalbumine est capable de moduler l’amplitude des courants calciques induits par les agonistes purinergiques (ATP et UTP) ainsi que le niveau d’expression de NCC dans les cellules mTCD [9]. Ces résultats sont conformes à des travaux antérieurs suggérant que le néphron distal répond à l’ATP via des récepteurs purinergiques qui inhibent le transport de sodium [
10]. D’autres travaux seront nécessaires pour élucider le(s) lien(s) entre les modifications de l’amplitude et/ou de la durée des modifications calciques transitoires et l’activité de divers facteurs (kinases, facteurs de transcription) dans le TCD. Le fait que la parvalbumine soit exactement localisée dans le TCD au niveau du rein humain, et que le phénotype de la souris Pvalb
-/- soit similaire au syndrome de Gitelman, évoque une implication potentielle de cette protéine dans les atteintes du TCD chez l’homme. Bien que le syndrome de Gitelman soit transmis de façon récessive et que la majorité des patients soient des hétérozygotes composés, on ne détecte qu’un seul allèle muté chez presque 40 % des patients. Par ailleurs, l’hétérogénéité de la maladie peut suggérer l’existence d’éventuels gènes modificateurs [
11]. Bien que l’implication de mutations ou de variants du gène PVALB dans le syndrome de Gitelman n’ait pu être démontrée à ce jour [
12], il n’est pas exclu que ce gène puisse être impliqué dans d’autres tubulopathies impliquant le TCD. Par ailleurs, des variations congénitales ou acquises de la parvalbumine pourraient jouer un rôle dans la réabsorption du NaCl dans le néphron distal ainsi que dans la réponse individuelle aux diurétiques thiazidiques. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient Ph. Gailly, B. Schwaller, J. Loffing, E. Riveira-Munoz, R. Beauwens, J.P. Devogelaer, J.G. Hoenderop, R. Bindels, M. Konrad, X. Jeunemaitre, N.V. Knoers, H. Debaix, K. Dahan, R. Vargas-Poussou, A. Blanchard pour leur collaboration concernant ces travaux, ainsi que les FNRS et FRSM, la Fondation Alphonse et Jean Forton, l’IUAP P6/05, le projet DIANE (Communauté française de Belgique) et le programme EUNEFRON (FP7, GA#201590) de la Communauté européenne pour leur soutien.
|
1. Devuyst O. Salt wasting and blood pressure. Nat Genet 2008; 40 : 495-6. 2. Simon DB, Nelson-Williams C, Bia MJ, et al. Gitelman’s variant of Bartter’s syndrome, inherited hypokalaemic alkalosis, is caused by mutations in the thiazidesensitive Na-Cl cotransporter. Nat Genet 1996; 12 : 24-30. 3. Devuyst O, Konrad M, Jeunemaitre X. Tubular disorders of electrolyte regulation. In : Avner ED, Harmon WE, Niaudet P, Yoshikawa N, eds. Pediatric nephrology, 6th ed. New York : Springer, 2009 : 929-78. 4. Nijenhuis T, Vallon V, van der Kemp AW, et al. Enhanced passive Ca2+ reabsorption and reduced Mg2+ channel abundance explains thiazide-induced hypocalciuria and hypomagnesemia. J Clin Invest 2005; 115 : 1651-8. 5. Ikura M. Calcium binding and conformational response in EF-hand proteins. Trends Biochem Sci 2006; 21 : 14-7. 6. Schwaller B. The continuing disappearance of pure Ca2+ buffers. Cell Mol Life Sci 2009; 66 : 275-300. 7. Schwaller B, Dick J, Dhoot G, et al. Prolonged contraction-relaxation cycle of fast-twitch muscles in parvalbumin knockout mice. Am J Physiol 1999; 276 : C395-403. 8. Loffing J, Loffing-Cueni D, Valderrabano V, et al. Distribution of transcellular calcium and sodium transport pathways along mouse distal nephron. Am J Physiol Renal Physiol 2001; 281 : F1021-7. 9. Belge H, Gailly Ph, Schwaller B, et al. Renal expression of parvalbumin is critical for NaCl handling and response to diuretics. Proc Natl Acad Sci USA 2007; 104 : 14849-54. 10. Leipziger J. Control of epithelial transport via luminal P2 receptors. Am J Physiol Renal Physiol 2003; 284 : F419-32. 11. Riveira-Munoz E, Chang Q, Godefroid N, et al. Transcriptional and functional analyses of SLC12A3 mutations: new clues for the pathogenesis of Gitelman’s syndrome. J Am Soc Nephrol 2007; 18 : 1271-83. 12. Riveira-Munoz E, Devuyst O, Belge H, et al. Evaluating PVALB as a candidate gene for SLC12A3 negative cases of Gitelman’s syndrome. Nephrol Dial Transplant 2008; 23 : 3120-5. |