| |
| Med Sci (Paris). 2010 June; 26(6-7): 621–626. Published online 2010 June 15. doi: 10.1051/medsci/2010266-7621.L’éosinophile : nouvel acteur de la réponse immunitaire innée ? Virginie Driss,1,2 Fanny Legrand,1,3,4 Sylvie Loiseau,1,4 and Monique Capron1,4* 1Inserm U547, Université Lille 2, Institut fédératif de recherche 142, Institut Pasteur de Lille, France 2Inserm U837, Institut de recherche sur le cancer de Lille, Université Lille 2, Institut fédératif de recherche 114, Lille, France
3Laboratoire d’immunologie du CHRU de Lille, Université Lille 2, Centre de biologie pathologie, Lille 4Inserm U995, Faculté de médecine, Université Lille 2, Institut fédératif de recherche 114, fédératif de recherche 114, 1, place de Verdun, 59045 Lille Cedex, France |
L’éosinophile est considéré aujourd’hui comme un acteur cellulaire multifonctionnel mais capable aussi de participer aux processus précoces intervenant dans l’immunité innée, cette dernière représentant la première barrière de l’organisme vis-à-vis de nombreux pathogènes (bactéries, virus, champignons, parasites). D’un point de vue phylogénique, des cellules possédant des granules éosinophiliques (eosinophil granule cells) ont été trouvées chez des organismes évoluant depuis plus de 500 millions d’années, suggérant que ces cellules pouvaient participer à des processus primitifs de défense innée bien avant l’apparition des processus de réarrangement des gènes nécessaires à la réponse immune adaptative [
1]. De même, les gènes codant pour des protéines contenues dans les granules éosinophiliques telles que l’ECP (protéine cationique de l’éosinophile) et l’EDN (neurotoxine dérivée de l’éosinophile) sont apparus suite à une duplication il y a environ 50 millions d’années et ont conservé, malgré de nombreuses mutations, leur activité ribonucléasique. |
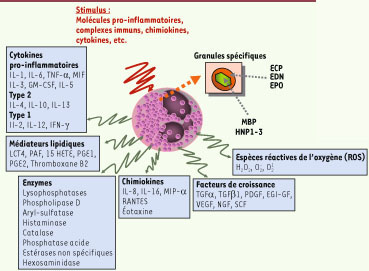
Arsenal cytotoxique des éosinophiles Les éosinophiles sont capables de libérer un très grand nombre de médiateurs cytotoxi ques différents en fonction de la nature du stimulus [
2] (Figure 1). Possédant un équipement enzymatique varié, ils peuvent générer rapidement des espèces réactives de l’oxygène et des médiateurs lipidiques capables d’altérer les agents pathogènes mais aussi les cellules tissulaires et d’amplifier la réponse inflammatoire. Les éosinophiles contiennent dans leurs granules des quantités importantes de médiateurs préformés très divers qu’ils peuvent libérer sous l’influence de certains stimulus rapidement et sélectivement : il s’agit de chimiokines, de facteurs de croissance, de nombreuses cytokines, ainsi que des protéines cationiques. Si le potentiel cytotoxique de ces dernières a été principalement démontré in vitro vis-à-vis de différents pathogènes (Tableau I), la démonstration de leur rôle in vivo repose essentiellement sur la détection des molécules cytotoxiques, soit à proximité des pathogènes (par exemple autour des œufs de parasites présents dans les tissus) ou de tissus lésés (au cours de processus inflammatoires cutanés ou pulmonaires).  | Figure 1
Médiateurs libérés par les polynucléaires éosinophiles. TGF : transforming growth factor ; PDGF : platelet-derived growth factor ; EGI-GF : epithelial growth inhibitor ; VEGF : vascular endothelial growth factor ; NGF : nerve growth factor ; SCF : stem cell growth factor ; RANTES : regulated upon activation, normal T cell expressed and secreted ; GM-CSF : granulocyte-macrophage colony-stimulating factor ; MIF : macrophage migration inhibitory factor ; LCT4 : leucotriène C4 ; PAF : platelet activating factor ;15 HETE : 15-Hydroxyeicosatetraenoic acid ; PGE : prostaglandine ; IFN : interféron ; TNF : tumor necrosis factor ; HNP1-3 : human neutrophil peptides 1-3 ; IL : interleukine. |
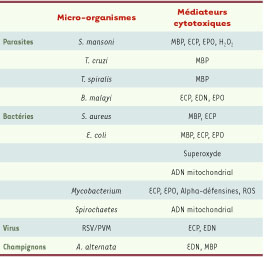
 | Tableau IPathogènes sensibles aux médiateurs cytotoxiques libérés par les éosinophiles [
7,
8,
27,
31]. MBP : major basic protein ; ECP : eosinophil cationic protein ; EPO : eosinophil peroxydase ; EDN : eosinophil derived neurotoxin ; ROS : reactive oxygen species. |
L’éosinophile est capable de produire différents médiateurs néoformés comme les espèces réactives de l’oxygène (ROS), libérées précocement après activation, et en quantités beaucoup plus importantes que dans le cas des polynucléaires neutrophiles. L’ensemble de ces espèces activées de l’oxygène confère a l’éosinophile un rôle pro-inflammatoire et cytotoxique. Dans ses granules secondaires, l’éosinophile stocke quatre protéines très basiques de bas poids moléculaire : la MBP (protéine basique majeure), l’ECP, l’EDN et l’EPO (peroxydase de l’éosinophile). Ces protéines jouent un rôle à la fois dans la défense de l’hôte et dans la pathogenèse des maladies associées à une hyperéosinophilie. La MBP possède une activité cytotoxique contre les helminthes mais aussi contre les bactéries. Cette activité cytotoxique s’exerce par la capacité de la MBP à perturber l’intégrité cellulaire en modifiant l’équilibre électrostatique de la bicouche de phospholipides de la membrane cellulaire, ce qui augmente ainsi sa perméabilité. L’EPO catalyse la formation de radicaux libres extrêmement instables et oxydants, ce qui explique l’activité bactéricide et cytotoxique attribuée à cette peroxydase. L’ECP, qui a une activité ARNase, possède comme la MBP une toxicité envers les helminthes, les bactéries et certains types cellulaires due à son effet déstabilisant sur les lipides membranaires [
3]. Tout comme l’ECP, l’EDN exerce une forte activité ribonucléase et joue un rôle neurotoxique délétère pour l’hôte, mais elle possède aussi des propriétés antivirales bénéfiques pour l’hôte. L’EDN est également considérée comme une « alarmine » au même titre que les défensines qui sont des signaux de danger chargés d’alerter le système immunitaire en cas de dommages cellulaires et d’infections [
4]. Les peptides antimicrobiens sont parmi les élémentsclés de la défense immunitaire innée. De nombreux peptides ayant une activité antimicrobienne, dont les défensines, ont été identifiés chez l’homme [
5]. Cette famille de peptides cationiques antimicrobiens comprend entre autres les α-défensines. Les défensines sont apparues très tôt au cours de l’évolution et sont très conservées même entre des espèces très éloignées. Les défensines possèdent des résidus cystéines (motif consensus) qui permettent la formation de trois ponts disulfure intramoléculaires. Concernant leur mécanisme d’action, l’hypothèse actuellement admise est que les défensines se fixeraient sur la membrane des microorganismes cibles sous forme de pores multimériques[
6]. Nous avons montré pour la première fois l’expression constitutive, la colocalisation avec la MBP et la libération d’α-défensines par les éosinophiles humains qui participent directement à la mort mycobactérienne[7], ajoutant ainsi de nouvelles potentialités à l’arsenal cytotoxique des éosinophiles. De plus, une synergie est observée entre l’activité antibactérienne de l’ECP et des α-défensines, suggérant une complémentarité de leurs propriétés. Les défensines potentialiseraient ainsi l’activité cytotoxique des protéines granulaires des éosinophiles, leur conférant une activité anti-infectieuse accrue et donc un rôle protecteur. Outre ces différents procédés de dégranulation, un nouveau mécanisme de libération de médiateurs vient d’être décrit qui renforce le rôle des éosinophiles dans l’immunité innée : la libération « explosive » de filaments d’ADN. Telle une catapulte, l’ADN mitochondrial est projeté dans le milieu environnant en moins d’une seconde [8]. Il est, dans son principe, similaire aux pièges extracellulaires découverts sur les neutrophiles en 2004 et dont Médecine/Sciences s’est fait l’écho [
32], mais de structure différente [
9]. Ainsi, les filaments-pièges des éosinophiles sont constitués d’ADN mitochondrial et de protéines granulaires (ECP, MBP) et forment, une fois libérés dans le milieu extracellulaire, des réseaux entrelacés capables de piéger et de tuer des bactéries. Les mécanismes moléculaires de libération d’ADN semblent différents de ceux qui sont impliqués dans la libération des protéines de granules [
10]. La structure des « pièges éosinophiles » confère probablement à ces polynucléaires une spécificité fonctionnelle supplémentaire. |
Reconnaissance directe des pathogènes par les éosinophiles La découverte, ces dix dernières années, de l’expression par l’éosinophile de nouveaux récepteurs de membrane a permis de reconsidérer l’étendue des propriétés fonctionnelles de ce polynucléaire [
11]. Les éosinophiles seraient ainsi particulièrement réceptifs aux signaux de l’environnement tissulaire. Le concept de « signaux de danger » est une notion originale selon laquelle le contexte dans lequel une molécule est reconnue par le système immunitaire influence la nature de la réponse induite [
12]. La perception et la transmission de ces signaux de danger mettent en jeu des motifs moléculaires, d’origine exogène ou endogène, capables d’activer des récepteurs spécifiques. Plusieurs récepteurs permettent aux éosinophiles d’être stimulés directement par des motifs moléculaires communs à plusieurs pathogènes. Certaines protéases d’acariens ou de champignons sont capables d’activer directement les éosinophiles par clivage de la partie amino-terminale des récepteurs PAR (protease activated receptors) couplés à des protéines G. En effet, les éosinophiles expriment PAR-1 à leur surface et PAR-2 dans le cytoplasme [
13]. Sous l’action des protéases, l’éosinophile libère des radicaux libres et des leucotriènes pro-inflammatoires. PAR-2 est notamment impliqué dans l’activation de l’éosinophile par un champignon de l’air ambiant du genre Alternaria [
14]. De nombreux récepteurs pour les chimiokines et les médiateurs lipidiques ainsi que des récepteurs pour le complément (CR1 et CR3) dont l’activation provoque la dégranulation sont également exprimés sur les éosinophiles [
15]. Les éosinophiles expriment le formyl peptide receptor (FPR) qui lie un signal de danger représenté par le fMLF libéré (N-formyl - Met-Leu-Phe) par les bactéries [
16]. Si les récepteurs Toll-like (TLR) 1, 2, 4, 5, 6, 7 et 9 ont été détectés sous forme protéique dans les éosinophiles humains [
17], leurs fonctions restent encore imprécises. Parmi les différents ligands des TLR, seul un ligand du TLR 7-8 (R-848) est capable d’activer les éosinophiles humains et de déclencher la production d’ions superoxydes [
18]. Cependant, une autre étude suggère que les ligands des TLR 2, 5 et 7 pourraient activer de manière différentielle les éosinophiles, aboutissant à l’augmentation de l’expression de certaines molécules d’adhérence comme I CAM -1 (intercellular adhesion molecule) et CD18 (chaîne P2 des intégrines) et/ou à la libération de cytokines/chimiokines, superoxydes, protéines granulaires, spécifiques du ligand utilisé [17]. Les ligands de TLR 3, 4, 8 et 9 semblent moins actifs voire inactifs, alors qu’une activation potentielle via TLR4, en réponse à une voie dépendante du CD14, a été proposée [
19,
20]. Chez la souris, il n’existe qu’une seule étude publiée sur l’expression des TLR sur les éosinophiles murins ; elle a mis en évidence la présence des TLR 3, 4, 5 et 7 [
21]. L’expression par les éosinophiles de ces différents récepteurs de l’immunité innée, et la reconnaissance de l’appartenance deces cellules a un lignage très ancien retrouvé chez des vertébrés inférieurs comme les poissons sans mâchoire, suggèrent un rôle potentiel des éosinophiles dans l’immunité innée. Dans ce contexte, notre équipe a récemment démontré l’interaction directe de TLR2 exprimé par les éosinophiles humains avec des mycobactéries. En effet, Mycobacterium bovis-BCG, utilisé comme modèle d’étude, est capable d’attirer et d’activer les éosinophiles qui dégranulent et libèrent de l’ECP ainsi qu’une α-défensine, les deux agissant en synergie dans la cytotoxicité vis-à-vis des mycobactéries [7]. De plus, d’autres ligands mycobactériens comme les phosphoantigènes se lient à un récepteur de membrane que nous avons également récemment identifié sur les éosinophiles humains, le TCRγδ (T cell receptor γδ) [
33] ; il en résulte l’induction de la synthèse d’espèces réactives de l’oxygène et la dégranulation [
22]. L’existence de ces deux types de récepteurs à l’interface entre immunité innée (TLR) et adaptative (TCRγδ) et capables d’interagir avec des pathogen associated molecular pattern (PAMP) confère à l’éosinophile une fonction nouvelle dans ses i nteractions avec les pathogènes. |
Éosinophiles et infections Une éosinophilie sanguine et/ou tissulaire est caractéristique de certaines infections causées par des helminthes. Les éosinophiles sont capables, in vitro, de tuer des parasites helminthes, surtout s’ils sont au stade larvaire. La forte toxicité des protéines granulaires des éosinophiles ne s’exerce pas uniquement contre les parasites helminthes mais cause aussi des dommages tissulaires chez l’hôte. Dans des souris dépourvues de Myd88 une molécule adaptatrice intervenant dans les voies de signalisation en aval de certains TLR infectées par S. mansoni
1
, même si aucune différence n’a été observée en ce qui concerne la mortalité, le taux d’immunoglobulines IgE ou la charge parasitaire, la taille du granulome hépatique était néanmoins réduite ainsi que la taille de l’infiltrat à éosinophiles [
23]. Une possible interprétation de ces données serait que l’absence de signalisation TLR dans ces éosinophiles Myd88−/compromette leur recrutement via certains antigènes parasitaires qui sont des ligands naturels de ces récepteurs. Les éosinophiles semblent aussi être impliqués dans les infections virales sans toutefois que les mécanismes soient bien identifiés [
24]. Une éosinophilie pulmonaire est observée, in vivo, après infection par le PVM (pneumonia virus mice). En réponse à l’infection, les éosinophiles s’activent et il y a une dégranulation qui libère l’ECP et l’EDN. In vitro, le même phénomène est observé après infection par le RSV (respiratory syncytial virus). Phipps et ses collaborateurs ont montré de manière indirecte que les éosinophiles améliorent l’élimination du virus via un processus dépendant de TLR7 et MyD88 [21]. Lors d’une infection par le virus de l’immunodéficience humaine (VIH), l’éosinophile peut constituer à la fois un réservoir de virus, puisque cette cellule est infectable via l’antigène CD4 qu’elle exprime, mais elle peut aussi participer à l’activité antivirale via la libération d’EPO et d’H2O2, ce qui illustre parfaitement le concept de dualité fonctionnelle de l’éosinophile [
25]. Des études récentes se sont intéressées au rôle des éosinophiles dans les infections fongiques. En effet, les éosinophiles tuent les champignons en entourant l’organisme de leurs protéines granulaires cytotoxiques [
26]. Le récepteur CD11b est impliqué dans ces interactions éosinophiles-champignons. De plus, l’interaction de l’aspartateprotéase fongique avec PAR-2 exprimé à la surface des éosinophiles joue un rôle-clé dans la réponse contre Alternaria [27]. Au contraire, les infections bactériennes ne sont pas associées classiquement à une éosinophilie périphérique. Néanmoins, plusieurs études ont montré que les éosinophiles phagocytent diverses espèces bactériennes comme S. aureus [
28], Escherichia coli, et Mycobacterium [
29]. Les éosinophiles ont des propriétés bactéricides puisqu’ils participent à la défense de l’hôte contre E. coli, bactérie Gram-, par un mécanisme dépendant de l’oxygène et faisant probablement intervenir l’EPO [
30]. De plus, la majorité des bactéries Graminduisent la libération d’ECP alors que celle d’EPO et de MBP est induite à la fois par les bactéries Gram+ et Gram‒ [31]. De ce fait, les éosinophiles pourraient représenter des effecteurs cellulaires importants et méconnus de l’immunité antibactérienne. L’expression par une sous-population d’éosinophiles humains du complexe CD3/TCRγδ ouvre de nombreuses perspectives quant au rôle potentiel de cette nouvelle sous-population d’effecteurs de l’immunité innée. À l’instar des lymphocytes T Vγ9Vδ22, les éosinophiles TCRγδ+ pourraient interagir avec d’autres pathogènes tels Listeria, Yersinia, Plasmodium, une fonction qui n’a pas été envisagée jusqu’à présent. |
Cette revue dévoile l’évolution des concepts concernant le polynucléaire éosinophile, autrefois considéré uniquement comme une cellule effectrice participant à la réponse de l’immunité adaptative au cours des parasitoses et des allergies ; elle émerge maintenant comme un partenaire au même titre que les différentes cellules participant à l’immunité innée. Beaucoup d’arguments plaident en faveur du rôle primordial que peuvent avoir les éosinophiles au cours des réactions de l’immunité innée vis-à-vis de pathogènes : la capacité de stockage importante des éosinophiles (liée à une activité transcriptionnelle de base très faible comparée à d’autres cellules du système immunitaire comme les lymphocytes), leur localisation préférentielle dans les tissus situés à l’interface avec le milieu extérieur, leur reconnaissance et leur intégration de différents signaux de danger émanant de l’environnement, leur potentiel cytotoxique remarquable mobilisable rapidement et sélectivement grâce à des mécanismes de dégranulation finement régulés. La question du rôle des éosinophiles en tant que nouvel acteur de la réponse immunitaire innée anti-infectieuse reste donc ouverte et mérite de plus amples investigations. Les éosinophiles sont aussi à la frontière des processus immunitaires inné et acquis : ce sont des cellules cytotoxiques qui participent à l’immunité cellulaire mais qui sécrètent aussi de nombreuses cytokines effectrices et régulatrices. Par la libération de divers médiateurs, les éosinophiles pourraient alors contribuer à initier ou entretenir une réponse inflammatoire. Les éosinophiles sont également au cœur d’un équilibre entre la tolérance microbienne et l’exacerbation inflammatoire visant à éliminer l’agent microbien et menant à la destruction tissulaire. Une réponse anti-infectieuse dérégulée des éosinophiles, notamment par leur localisation préférentielle dans le tube digestif, pourrait ainsi intervenir dans des maladies inflammatoires de l’intestin telles que la rectocolite hémorragique ou la maladie de Crohn qui mettent en jeu des interactions entre le système immunitaire, une sensibilité génétique et l’environnement par l’intermédiaire de la flore bactérienne. Enfin, se pose la question de l’existence de sous-populations d’éosinophiles qui, à l’instar des lymphocytes T avec lesquels elles partagent certains récepteurs et médiateurs, exerceraient de manière différentielle des fonctions effectrices ou régulatrices. La mise en place de modèles expérimentaux relevants, animaux ou cellulaires, devrait permettre de répondre à la plupart de ces questions. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Lee JJ, Lee NA. Eosinophil degranulation : an evolutionary vestige or a universally destructive effector function ? Clin Exp Allergy 2005 ; 35 : 986-94. 2. Decot V, Capron M. Eosinophils: structure and functions. Presse Med 2006 ; 35 : 113-24. 3. Carreras E, Boix E, Rosenberg HF, et al. Both aromatic and cationic residues contribute to the membrane-lytic and bactericidal activity of eosinophil cationic protein. Biochemistry 2003 ; 42 : 6636-44. 4. Yang D, Chan Q, Su SB, et al. Eosinophil-derived neurotoxin acts as an alarmin to activate the TLR2-MyD88 signal pathway in dendritic cells and enhances Th2 immune responses. J Exp Med 2008 ; 205 : 79-90. 5. Holzl MA, Hofer J, Steinberger P, et al. Host antimicrobial proteins as endogenous immunomodulators. Immunol Lett 2008 ; 119 : 4-11. 6. Selsted ME, Ouellette AJ. Mammalian defensins in the antimicrobial immune response. Nat Immunol 2005 ; 6 : 551-7. 7. Driss V, Legrand F, Hermann E, et al. TLR2-dependent eosinophil interactions with mycobacteria: role of alpha-defensins. Blood 2009 ; 113 : 3235-44. 8. Yousefi S, Gold JA, Andina N, et al. Catapult-like release of mitochondrial DNA by eosinophils contributes to antibacterial defense. Nat Med 2008 ; 14 : 949-53. 9. Brinkmann V, Reichard U, Goosmann C, et al. Neutrophil extracellular traps kill bacteria. Science 2004 ; 303 : 1532-5. 10. Melo RC, Spencer LA, Dvorak AM, Weller PF. Mechanisms of eosinophil secretion: large vesiculotubular carriers mediate transport and release of granule-derived cytokines and other proteins. J Leukoc Biol 2008 ; 83 : 229-36. 11. Hogan SP, Rosenberg HF, Moqbel R, et al. Eosinophils: biological properties and role in health and disease. Clin Exp Allergy 2008 ; 38 : 709-50. 12. Bianchi ME. DAMPs, PAMPs and alarmins: all we need to know about danger. J Leukoc Biol 2007 ; 81 : 1-5. 13. Bolton SJ, McNulty CA, Thomas RJ, et al. Expression of and functional responses to protease-activated receptors on human eosinophils. J Leukoc Biol 2003 ; 74 : 60-8. 14. Inoue Y, Matsuwaki Y, Shin SH, et al. Nonpathogenic, environmental fungi induce activation and degranulation of human eosinophils. J Immunol 2005 ; 175 : 5439-47. 15. Kato M, Abraham RT, Okada S, Kita H. Ligation of the beta2 integrin triggers activation and degranulation of human eosinophils. Am J Respir Cell Mol Biol 1998 ; 18 : 675-86. 16. Svensson L, Redvall E, Bjorn C, et al. House dust mite allergen activates human eosinophils via formyl peptide receptor and formyl peptide receptor - like 1. Eur J Immunol 2007 ; 37 : 1966-77. 17. Wong CK, Cheung PF, Ip WK, Lam CW. Intracellular signaling mechanisms regulating toll-like receptor-mediated activation of eosinophils. Am J Respir Cell Mol Biol 2007 ; 37 : 85-96. 18. Nagase H, Okugawa S, Ota Y, et al. Expression and function of Toll-like receptors in eosinophils: activation by Toll-like receptor 7 ligand. J Immunol 2003 ; 171 : 3977-82. 19. Plotz SG, Lentschat A, Behrendt H, et al. The interaction of human peripheral blood eosinophils with bacterial lipopolysaccharide is CD14 dependent. Blood 2001 ; 97 : 235-41. 20. Meerschaert J, Busse WW, Bertics PJ, Mosher DF. CD14+ cells are necessary for increased survival of eosinophils in response to lipopolysaccharide. Am J Respir Cell Mol Biol 2000 ; 23 : 780-7. 21. Phipps S, Lam CE, Mahalingam S, et al. Eosinophils contribute to innate antiviral immunity and promote clearance of respiratory syncytial virus. Blood 2007 ; 110 : 1578-86. 22. Legrand F, Driss V, Woerly G, et al. A functional gammadeltaTCR/CD3 complex distinct from gammadeltaT cells is expressed by human eosinophils. PLoS One 2009 ; 4 : e5926. 23. Layland LE, Wagner H, da Costa CU. Lack of antigen-specific Th1 response alters granuloma formation and composition in Schistosoma mansoni - infected MyD88−/− mice. Eur J Immunol 2005 ; 35 : 3248-57. 24. Rosenberg HF, Dyer KD, Domachowske JB. Respiratory viruses and eosinophils: exploring the connections. Antiviral Res 2009 ; 83 : 1-9. 25. Klebanoff SJ, Coombs RW. Virucidal effect of stimulated eosinophils on human immunodeficiency virus type 1. AIDS Res Hum Retrovir 1996 ; 12 : 25-9. 26. Yoon J, Ponikau JU, Lawrence CB, Kita H. Innate antifungal immunity of human eosinophils mediated by a beta 2 integrin, CD11b. J Immunol 2008 ; 181 : 2907-15. 27. Matsuwaki Y, Wada K, White TA, et al. Recognition of fungal protease activities induces cellular activation and eosinophil-derived neurotoxin release in human eosinophils. J Immunol 2009 ; 183 : 6708-16. 28. Hatano Y, Taniuchi S, Masuda M, et al. Phagocytosis of heat-killed Staphylococcus aureus by eosinophils: comparison with neutrophils. Apmis 2009 ; 117 : 115-23. 29. Castro AG, Esaguy N, Macedo PM, et al. Live but not heat-killed mycobacteria cause rapid chemotaxis of large numbers of eosinophils in vivo and are ingested by the attracted granulocytes. Infect Immun 1991 ; 59 : 3009-14. 30. Persson T, Andersson P, Bodelsson M, et al. Bactericidal activity of human eosinophilic granulocytes against Escherichia coli.
Infect Immun 2001 ; 69 : 3591-6. 31. Svensson L, Wenneras C. Human eosinophils selectively recognize and become activated by bacteria belonging to different taxonomic groups. Microbes Infect 2005 ; 7 : 720-8. 32. Gougerot-Pocidalo MA, El Benna J, My-Chan Dang P, Elbim C. Quand les polynucléaires neutrophiles attrapent les agents pathogènes dans leurs filets. Med Sci (Paris) 2007 ; 23 : 464-5. 33. Catros V, Toutirais O, Bouet F, et al. Lymphocytes Tyδ en cancérologie : des lymphocytes tueurs non conventionnels. Med Sci (Paris) 2010 ; 26 : 185-91. |