| |
| Med Sci (Paris). 2010 August; 26(8-9): 681–685. Published online 2010 August 15. doi: 10.1051/medsci/2010268-9681.L’élastase 2, une nouvelle protéase épidermique impliquée dans l’établissement de la barrière cutanée Chrystelle Bonnart,1 Céline Deraison,1 Matthieu Lacroix,1 and Alain Hovnanian2* 1Inserm U563, Toulouse, France, Université Toulouse III Paul-Sabatier, Toulouse, France 2Inserm U781, Paris, France, Université René Descartes, Paris V, France, CHU Necker-Enfants malades, Services de dermatologie et de génétique, 149, rue de Sèvres, 75743 Paris Cedex 15, France MeSH keywords: Épiderme, anatomopathologie, Humains, Nourrisson, Protéines de filaments intermédiaires, génétique, Syndrome de Netherton, enzymologie, Serine endopeptidases, Maladies génétiques de la peau |
Équilibre prolifération - desquamation à la surface cutanée L’épiderme est un épithélium pluristratifié qui se met en place au cours de la vie embryonnaire et qui s’autorenouvelle tout au long de la vie. Ce renouvellement continu, génétiquement programmé, est assuré par les cellules souches présentes dans la couche basale de l’épiderme [
1]. La prolifération de ces cellules génère de nouvelles cellules qui s’engagent dans un processus de différenciation et migrent dans les couches épineuse puis granuleuse de l’épiderme. Les kératinocytes de la couche granuleuse possèdent des grains de kératohyaline dans leur cytoplasme, qui contiennent des agrégats de protéines insolubles (Figure 1). La zone de transition entre la couche granuleuse et la couche cornée est une région d’intenses activités enzymatiques et de restructuration (perte du noyau et d’organites cellulaires) menant à la formation des cornéocytes. Ces cellules sont entourées de lamelles lipidiques hydrophobes organisées en multicouches, l’ensemble formant une structure insoluble essentielle à l’imperméabilité de l’épiderme. L’agrégation des filaments intermédiaires de kératines est à l’origine de l’effondrement des kératinocytes sur eux-mêmes et de la forme très aplatie des cornéocytes [
2]. La couche cornée, en contact avec l’environnement, représente ainsi l’étape ultime de la différenciation kératinocytaire (Figure 1).  | Figure 1
Schéma des deux dernières couches de l’épiderme. La dernière couche vivante de l’épiderme, la couche granuleuse, est composée de kératinocytes aplatis qui renferment des grains de kératohyaline ainsi que des corps lamellaires. Ces derniers se déversent dans l’espace extracellulaire, à l’interface couche granuleuse-couche cornée, libérant des enzymes indispensables d’une part à la formation des lamelles lipides assurant l’imperméabilité de la peau, et d’autre part à la desquamation des cornéocytes de la couche cornée. Cette couche de l’épiderme en contact direct avec l’environnement assure une fonction de barrière protectrice essentielle de l’organisme. |
L’exfoliation des cornéocytes à la surface de l’épiderme, appelée desquamation, implique la dégradation progressive de la desmogléine-1, la desmocolline-1 et la cornéodesmosine, protéines constitutives des jonctions intercellulaires des cornéocytes, les cornéodesmosomes. Ce processus est rendu possible par l’action de protéases spécifiques comme des protéases à sérine (les kallikréines (KLK) 5, 7, 8 et 14), des protéases à cystéine (SCTP) et à aspartate (cathepsine D) qui sont présentes dans la couche cornée [
3–
8]. La régulation de la desquamation est orchestrée par des variations localisées de l’acidité du milieu extracellulaire au sein de la couche cornée, permettant une activation sélective des différentes classes de protéases [
9]. D’autres facteurs interviennent également dans le contrôle de l’activité protéasique, tels que l’hydratation de la couche cornée, les lipides intercornéocytaires (sulfate de cholestérol) et la présence d’inhibiteurs de protéases : SLPI (secretory leukocyte protease inhibitor) [
10], SKALP (skin-derived anti-leukoproteinase) [
11], Cystatine M/E [
12], LEKTI (lympho-epithelial Kazal type related inhibitor) [
13]. L’ensemble de ces facteurs contribue à finement réguler le processus de desquamation afin que seuls les cornéocytes les plus superficiels se désolidarisent de la couche cornée. Chaque cornéocyte progressivement éliminé est alors remplacé par une nouvelle cellule. De cette façon, un équilibre s’établit entre la prolifération de la couche basale et la desquamation à la surface cutanée, permettant de maintenir un nombre constant de couches cellulaires dans l’épiderme. À la surface du corps et en contact direct avec l’environnement, l’épiderme assure ainsi une fonction de barrière protectrice essentielle pour l’organisme. Il empêche la perte des fluides corporels et s’oppose aux agressions physiques et chimiques ainsi qu’à la pénétration des agents pathogènes et des allergènes. Notre équipe s’intéresse particulièrement à la mise en place et à la régulation de cette fonction barrière de l’épiderme en étudiant la physiopathologie d’une maladie génétique cutanée sévère de l’enfant, le syndrome de Netherton (SN). |
Le syndrome de Netherton (SN, OMIM 256500) est une maladie génétique cutanée sévère transmise selon le mode autosomique récessif [
24]. On estime l’incidence de cette maladie rare à un cas sur 100 000 naissances. La triade clinique classique du SN comprend : (1) une érythrodermie desquamative congénitale, qui associe une rougeur intense et une exfoliation marquée de la couche superficielle de l’épiderme, (2) une dysplasie pilaire spécifique appelée Trichorrhexis invaginata ou cheveu bambou et (3) des manifestations atopiques constantes et sévères comprenant des lésions cutanées à type de dermatite atopique, rhinite allergique (rhume des foins), asthme allergique, urticaire et allergies alimentaires (Figure 2) [
14–
16]. Une ichtyose linéaire circonflexe se développe chez un patient sur deux, caractérisée par des plaques migratrices, érythémateuses et squameuses à double collerette périphérique. À ce tableau clinique s’ajoutent des complications fréquentes en période néonatale telle qu’une déshydratation hypernatrémique, des infections bactériennes récurrentes et des septicémies, une hypothermie et une perte de poids rapide, dont la cause majeure est la perte de fonction barrière de l’épiderme.  | Figure 2
Manifestations cliniques du syndrome de Netherton. A. Érythrodermie ichtyosiforme congénitale. B. Trichorrexis invaginata, cheveux rares et cassants. C. Lésions cutanées eczématiformes à type de dermatite atopique. |
L’identification du gène du SN a constitué une étape primordiale pour comprendre la physiopathologie de cette maladie [
17]. Le gène SPINK5 (serine protease inhibitor Kazal type 5) code un inhibiteur de protéase de type Kazal, LEKTI (lympho-epithelial Kazal type inhibitor). La plupart des mutations décrites à ce jour entraînent la formation de codons stop prématurés, conduisant à la perte d’expression de LEKTI [
18]. Dans l’épiderme, LEKTI est spécifiquement exprimé dans la couche granuleuse où se déroulent des étapes cruciales pour l’élaboration de la barrière cutanée [
19]. Afin de mieux comprendre le rôle physiologique de LEKTI dans l’homéostasie de l’épiderme, nous avons développé des souris invalidées pour le gène Spink5 [
20]. Les souris Spink5
−/− meurent de déshydratation quelques heures après la naissance en raison d’un défaut sévère de la barrière cutanée. Ces souris présentent des érosions cutanées superficielles résultant d’une perte d’adhérence de la couche cornée à l’épithélium sous-jacent. L’absence de LEKTI chez ces souris conduit à l’augmentation de l’activité des protéases épidermiques KLK5, KLK7 ainsi que d’une troisième protéase épidermique d’un poids moléculaire apparent de 28 kDa. Ces protéases hyperactives dégradent de façon prématurée la desmogléine 1, fragilisant les desmosomes et entraînant un défaut de l’adhérence de la couche cornée à l’épithélium sous-jacent. |
ELA2 : une nouvelle protéase de l’épiderme À partir d’extraits épidermiques des souris Spink5−/−, nous avons purifié et identifié de façon univoque la protéase de 28 kDa comme étant l’élastase 2 (ELA2) [
21]. Jusqu’à ce jour, l’expression de l’ELA2 n’avait jamais été rapportée dans l’épiderme mais uniquement documentée dans le pancréas. ELA2 est constitutivement exprimée et active dans la couche granuleuse de l’épiderme chez l’homme et la souris. En l’absence de LEKTI, on observe une augmentation de l’activité élastolytique dans cette couche cellulaire. Cependant, ELA2 n’est pas directement inhibée par LEKTI. Nous avons mis en évidence un mécanisme de contrôle indirect de l’activité de l’ELA2 par LEKTI. En effet, LEKTI inhibe directement la KLK5 [9], cette dernière étant capable d’activer la forme pro-ELA2 inactive en forme ELA2 active. Ainsi le mode d’inhibition de l’ELA2 par LEKTI est indirect et basé sur la régulation de l’activation de la pro-ELA2 via la KLK5. De plus, la KLK5 et l’ELA2 sont colocalisées dans le cytoplasme des kératinocytes différenciés, ce qui est compatible avec une interaction directe entre ces 2 protéases. |
Des souris transgéniques pour comprendre le rôle de l’ELA2 Afin d’étudier la contribution de l‘ELA2 dans le phénotype SN, nous avons généré un modèle de souris transgénique pour la forme murine de l’ELA2 (Tg-Ela2), dans lequel l’expression du transgène est sous le contrôle du promoteur de l’involucrine (promoteur spécifique de la couche granuleuse de l’épiderme). L’étude de ces souris nous a permis de découvrir le rôle-clé de l’hyperactivité de l’Ela2 dans de nombreux aspects du phénotype SN et en particulier dans la perte de fonction barrière de la peau. Quelques jours après la naissance, les souris Tg-Ela2 présentent une desquamation excessive caractérisée par la présence de fines squames blanches (Figure 3A). 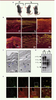 | Figure 3
Anomalies de la barrière cutanée des souris Tg-Ela2. A. Les souris Tg-Ela2 présentent une desquamation intense quelques jours après leur naissance. B. Dans l’épiderme de souris sauvage (WT) ou de témoin humain (sain), la coloration au rouge de Nile permet de mettre en évidence les lamelles lipidiques sous forme de fines lignes jaunes parallèles. Dans les épidermes dépourvus de LEKTI (knock-out [KO] ou SN) et ceux de souris Tg-Ela2 (Tg), des vésicules intra - et intercellulaires sont observées. C. En microscopie électronique, l’épiderme Tg-Ela2 révèle une absence des grains de kératohyaline. D. L’immunodétection des différentes formes de la filaggrine montre que la quantité de pro-filaggrine ainsi que celle des intermédiaires de maturation de la filaggrine est diminuée. E. Colocalisation de l’ELA2 avec la filaggrine et la KLK5 dans le cytoplasme de kératinocytes humains différenciés. Les photos de la colonne de droite (ELA/Flg et ELA/KLK5) sont un agrandissement de la zone délimitée par le carré en pointillés blancs. |
|
Des gouttelettes lipidiques dans la couche cornée La fonction de barrière cutanée repose notamment sur une organisation spécifique des lipides intercornéocytaires en lamelles. Les lipides majoritaires de la couche cornée sont les céramides, les acides gras et le cholestérol, en proportion équimolaire [
22]. Cette composition, qui diffère profondément de celle des membranes biologiques par l’absence de phospholipides, est la clé de l’organisation des lipides intercornéocytaires en lamelles lipidiques. La nature hydrophobe des lipides lamellaires permet de limiter le déplacement des solutions aqueuses à travers la couche cornée. Cette propriété est cruciale pour lutter contre la déshydratation de l’organisme et permet aussi de stopper la pénétration de molécules exogènes hydrophiles. L’observation des lipides épidermiques sur coupe de peau colorée au rouge de Nile révèle une absence de lamelles lipidiques et la présence de vacuoles lipidiques dans les épidermes de souris Tg-Ela2 ainsi que chez les patients SN (Figure 3B). L’analyse lipidique de l’épiderme des souris transgéniques montre une composition en céramides et en acides gras libres anormale, incompatible avec la formation de bicouches lipidiques. Ainsi, l’ELA2 serait impliquée dans différentes voies du métabolisme lipidique assurant la formation de lamelles intercornéocytaires indispensables à l’établissement d’une barrière cutanée efficace. |
La filaggrine, une cible privilégiée de l’ELA2 La filaggrine (Flg) est un acteur majeur de la différenciation terminale des kératinocytes et de la formation de la barrière cutanée. La pro-Flg est une phosphoprotéine extrêmement insoluble, qui constitue les grains de kératohyaline de la couche granuleuse. Durant la différenciation terminale, à l’interface entre couche granuleuse et couche cornée, la pro-Flg (~ 400 kDa) est clivée en plusieurs monomères de filaggrine d’environ 30 kDa chacun. La Flg participe à l’agrégation des filaments de kératine du cytosquelette permettant ainsi la différenciation des cellules granuleuses en cornéocytes. Les monomères de Flg sont ensuite entièrement dégradés dans les couches les plus superficielles de la couche cornée pour produire un mélange d’acides aminés hygroscopiques importants pour maintenir l’hydratation épidermique. La Flg est donc une protéine essentielle à la formation de la barrière cutanée [
23]. Les patients SN présentent des anomalies majeures de la différenciation terminale de l’épiderme, des malformations pilaires et une dérégulation du processus de la mise en place de la barrière cutanée. La maturation de la Flg est également anormale chez les patients SN, les grains de kératohyaline sont absents. Ce défaut est aussi observé dans l’épiderme des souris Spink5
−/− et celui des souris Tg-Ela2 (Figure 3C). L’analyse en Western blot de l’épiderme Tg-Ela2 révèle des anomalies de la maturation de la pro-Flg en Flg qui sont corrélées avec la sévérité de la perte de barrière cutanée (Figure 3D). Nous avons montré par microscopie confocale que l’Ela2 colocalise parfaitement avec la Flg dans les grains de kératohyaline (Figure 3E). Enfin, nous avons démontré que l’ELA2 est capable de dégrader toutes les formes de la Flg in vitro, du précurseur au monomère. Les élastases sont caractérisées par leur capacité à dégrader des protéines très insolubles comme les fibres d’élastine. Cette caractéristique conforte l’interaction entre l’ELA2 et la Flg et identifie cette protéase comme un nouvel acteur de la maturation complexe de la Flg. L’hyperactivité de l’ELA2 contribue ainsi, via la dégradation de la Flg et la désorganisation des lipides intercornéocytaires, au défaut de barrière cutanée intrinsèque (en dehors des zones de décollement) des patients SN. La caractérisation de l’ELA2 a ainsi permis de révéler le rôle majeur de cette nouvelle protéase épidermique dans le maintien de l’homéostasie épidermique via son rôle dans l’établissement de la barrière cutanée. La sévérité clinique du syndrome de Netherton et de ses complications souligne l’importance du contrôle de l’activité protéasique pour le maintien d’une barrière cutanée efficace. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Ces travaux ont été soutenus par l’Agence nationale pour la recherche (ANR), l’Association française contre les myopathies (AFM) et la Fondation pour la recherche médicale (FRM).
|
1. Fuchs E. Scratching the surface of skin development. Nature 2007 ; 445 : 834-42. 2. Candi E, Schmidt R, Melino G. The cornified envelope: a model of cell death in the skin. Nat Rev Mol Cell Biol 2005 ; 6 : 328-40. 3. Caubet C, Jonca N, Brattsand M, et al. Degradation of corneodesmosome proteins by two serine proteases of the kallikrein family, SCTE/KLK5/hK5 and SCCE/KLK7/ hK7. J Invest Dermatol 2004 ; 122 : 1235-44. 4. Kishibe M, Bando Y, Terayama R, et al. Kallikrein 8 is involved in skin desquamation in cooperation with other kallikreins. J Biol Chem 2007 ; 282 : 5834-41. 5. Stefansson K, Brattsand M, Ny A, et al. Kallikrein-related peptidase 14 may be a major contributor to trypsin-like proteolytic activity in human stratum corneum. Biol Chem 2006 ; 387 : 761-8. 6. Borgono CA, Michael IP, Komatsu N, et al. A potential role for multiple tissue kallikrein serine proteases in epidermal desquamation. J Biol Chem 2007 ; 282 : 3640-52. 7. Bernard D, Mehul B, Thomas-Collignon A, et al. Analysis of proteins with caseinolytic activity in a human stratum corneum extract revealed a yet unidentified cysteine protease and identified the so-called stratum corneum thiol protease as cathepsin l2. J Invest Dermatol 2003 ; 120 : 592-600. 8. Igarashi S, Takizawa T, Yasuda Y, et al. Cathepsin D, but not cathepsin E, degrades desmosomes during epidermal desquamation. Br J Dermatol 2004 ; 151 : 355-61. 9. Deraison C, Bonnart C, Lopez F, et al. LEKTI Fragments specifically inhibit KLK5, KLK7, and KLK14 and control desquamation through a pH-dependent interaction. Mol Biol Cell 2007 ; 18 : 3607-19. 10. Sallenave JM. The role of secretory leukocyte proteinase inhibitor and elafin (elastase-specific inhibitor/skin-derived antileukoprotease) as alarm antiproteinases in inflammatory lung disease. Respir Res 2000 ; 1 : 87-92. 11. Schalkwijk J, de Roo C, de Jongh GJ. Skin-derived antileukoproteinase (SKALP), an elastase inhibitor from human keratinocytes. Purification and biochemical properties. Biochim Biophys Acta 1991 ; 1096 : 148-54. 12. Zeeuwen PL, van Vlijmen-Willems IM, Olthuis D, et al. Evidence that unrestricted legumain activity is involved in disturbed epidermal cornification in cystatin M/E deficient mice. Hum Mol Genet 2004 ; 13 : 1069-79. 13. Komatsu N, Takata M, Otsuki N, et al. Elevated stratum corneum hydrolytic activity in Netherton syndrome suggests an inhibitory regulation of desquamation by SPINK5-derived peptides. J Invest Dermatol 2002 ; 118 : 436-43. 14. Comel M. Ichtyosis linearis circumflexa. Dermatologica 1949 ; 98 : 133-6. 15. Netherton EW. A unique case of Trichorrexis Invaginata. Arch Dermatol 1958 ; 78 : 483-7. 16. Judge MR, Morgan G, Harper JL. A clinical and immunological study of Netherton’s syndrome. Br J Dermatol 1994 ; 131 : 615-21. 17. Chavanas S, C Bodemer, A Rochat, et al., Mutations in SPINK5, encoding a serine protease inhibitor, cause Netherton syndrome. Nat Genet 2000 ; 25 : 141-2. 18. Bitoun E, Chavanas S, Irvine AD, et al. Netherton syndrome: disease expression and spectrum of SPINK5 mutations in 21 families. J Invest Dermatol 2002 ; 118 : 352-61. 19. Bitoun E, Micheloni A, Lamant L, et al., LEKTI proteolytic processing in human primary keratinocytes, tissue distribution and defective expression in Netherton syndrome. Hum Mol Genet 2003 ; 12 : 2417-30. 20. Descargues P, Deraison C, Bonnart C, et al. Spink5-deficient mice mimic Netherton syndrome through degradation of desmoglein 1 by epidermal protease hyperactivity. Nat Genet 2005 ; 37 : 56-65. 21. Bonnart C, Deraison C, Lacroix M, et al. Elastase 2 is expressed in human and mouse epidermis and impairs skin barrier function in Netherton syndrome through filaggrin and lipid misprocessing. J Clin Invest 2010 ; 120 : 871-82. 22. Swartzendruber DC, Wertz PW, Kitko DJ, et al. Molecular models of the intercellular lipid lamellae in mammalian stratum corneum. J Invest Dermatol 1989 ; 92 : 251-7. 23. Sandilands A, Sutherland C, Irvine AD, et al. Filaggrin in the frontline: role in skin barrier function and disease. J Cell Sci 2009 ; 122 : 1285-94. 24. Descargues P, Deraison C, Bonnart C, Hovnanian A. Syndrome de Netherton : un modèle d’étude de la régulation de la desquamation. Med Sci (Paris) 2005 ; 21 : 457-8. |




