| |
| Med Sci (Paris). 2010 August; 26(8-9): 719–723. Published online 2010 August 15. doi: 10.1051/medsci/2010268-9719.Facteurs de risque d’anaphylaxie alimentaire sévère Rôle confirmé de certaines classes de médicaments Denise Anne Moneret-Vautrin1* 1Service de médecine interne, immunologie clinique et allergologie, Hôpital central, 29, avenue du Maréchal de Lattre de Tassigny, 54035 Nancy, France |
L’anaphylaxie est la forme la plus grave des réactions allergiques immédiates liées à l’interaction d’allergènes et d’anticorps allergiques, les immunoglobulines E (IgE) spécifiques (voir Glossaire) [
1]. Les allergènes sont des aliments, ou les venins d’hyménoptères, ou des médicaments. Révélée par un choc anaphylactique dominé par le collapsus cardiovasculaire et ses conséquences mortelles, l’anaphylaxie peut aussi se manifester par des symptômes touchant la peau, le système respiratoire et le système digestif, par un œdème laryngé suffocant ou par un asthme aigu grave. Sa prévalence connaît depuis 15 ans une inquiétante progression : la fréquence de l’anaphylaxie, multipliée par 5 en France entre 1980 et 1995, a augmenté de façon spectaculaire entre 1995 et 2005 dans les pays occidentaux, en Australie et aux États-Unis [
2–
4]. L’allergie alimentaire constitue une part importante de l’anaphylaxie sévère. Elle concerne tous les âges et touche 3,24 % de la population française [
5]. Certes il existe des allergènes à haut risque (arachide et fruits à coque), mais ni la nature de l’allergène, ni l’intensité de la sensibilisation ne suffisent à expliquer la sévérité de certaines formes cliniques. C’est pourquoi l’on recherche des facteurs de risque qui, s’ils sont connus, permettent éventuellement une prévention primaire pouvant diminuer l’incidence de nouveaux cas, comme une prévention secondaire diminuant celle des récidives. Des facteurs de risque endogènes ont été identifiés. L’âge avancé est un important facteur puisque le risque relatif (RR) d’anaphylaxie grave, exprimé par l’odds ratio (OR), est multiplié par 14 chez le sujet âgé par rapport à la population pédiatrique [
6]. De même les comorbidités que sont les cardiopathies, l’asthme évolutif et plus rarement une affection particulière, la mastocytose1, aggravent la sévérité des pathologies [
7–
11]. Il a été montré que le risque d’anaphylaxie, qui s’accroît avec l’âge, peut être également dépendant d’une consommation médicamenteuse accrue. D’où l’hypothèse que des médicaments pourraient être des facteurs exogènes de risque de potentialisation. Avant d’exposer les connaissances actuelles sur le rôle potentialisateur de certaines classes pharmacologiques, nous rappelerons les mécanismes de l’anaphylaxie, en mettant en exergue les cibles de l’agression par les mécanismes allergiques. |
Physiopathologie de l’anaphylaxie sévère Des IgE spécifiques sont synthétisées chez le sujet sensibilisé à l’al lergène. Bien que ces IgE soient couramment mises en évidence dans le sérum, elles sont habituellement fixées sur la membrane des cellules effectrices que sont les mastocytes tissulaires et les basophiles sanguins. Un nouveau contact avec l’allergène entraîne la liaison par l’allergène de deux molécules connexes d’IgE spécifiques (pontage). Au-delà d’un certain nombre de ces pontages la cellule est activée et libère de très nombreux médiateurs chimiques (histamine, PAF-acéther2, leucotriènes, protéases, cytokines, etc. [
12]). Les actions principales de ces médiateurs dans l’anaphylaxie sont triples. Une hyperperméabilité endothéliale paroxystique et immédiate entraîne au niveau de la microcirculation capillaire une extravasation plasmatique dans les tissus interstitiels et donc une hypovolémie, source de chute tensionnelle. Par ailleurs, les effets des médiateurs sur les fibres musculaires lisses des parois vasculaires entraînent une vasodilatation, contribuant à la chute tensionnelle et provoquent une bronchoconstriction qui explique la composante asthmatique. Des désordres plus complexes caractérisent la circulation hépatosplanchnique et la circulation pulmonaire, du type vasoconstriction, à la source d’un défaut de remplissage du cœur droit puis du cœur gauche. Au fur et à mesure que l’hypovolémie s’aggrave, une chute du débit cardiaque s’installe, ce qui induit une diminution du débit cérébral et systémique. Des effets cardiaques directs s’ajoutent, du type tachycardie, mais ils correspondent parfois à des troubles du rythme plus graves. Enfin le processus allergique peut activer le métabolisme de la bradykinine, un médiateur généré dans le plasma, qui induit des effets vasodilatateur et hyperperméant supplémentaires. La conception classique de la physiopathologie de l’anaphylaxie privilégie donc l’intervention d’IgE spécifiques et l’activation des cellules cibles (mastocytes et basophiles). Mais, actuellement, ce sont des évènements de physiologie ainsi que les dysfonctionnements de l’endothélium qui suscitent l’intérêt. L’endothélium est une cible majeure de l’agression par les médiateurs et exprime aussi à sa surface des facteurs protecteurs comme l’enzyme de conversion de l’angiotensine I (ECA). Un autre site est très important, surtout en cas d’anaphylaxie alimentaire : la muqueuse intestinale, site d’absorption des allergènes alimentaires. Son agression par différents facteurs altère la perméabilité aux allergènes. Par ailleurs, il apparaît que des polymorphismes génétiques modulent diverses activités enzymatiques permettant la synthèse, mais aussi la dégradation, des médiateurs chimiques de l’anaphylaxie. Une synthèse accrue de leucotriènes, par surexpression de LTC4 (leucotriène C4) synthase, ou bien une altération de la dégradation de médiateurs vasoactifs comme la bradykinine et le PAF-acéther, liée à un déficit en aminopeptidase P ou/et en enzyme de conversion de l’angiotensine, ou en PAF- acéther hydrolase, pourrait accentuer la gravité d’une réaction allergique [
13–
15]. De surcroît, une dysfonction de l’enzyme de conversion peut rendre compte d’un taux bas d’angiotensine. Or ce peptide est un acteur essentiel de la régulation de la pression artérielle, et, à ce titre, protège de la survenue du collapsus [
16]. |
Agents pharmacologiques potentialisateurs de l’anaphylaxie Des publications de cas isolés ou de courtes séries avaient indiqué la possibilité que deux classes pharmacologiques soient des potentialisateurs de l’anaphylaxie : l’aspirine et les bêta-bloqueurs. Ces derniers avaient été dénoncés dans le cadre des chocs anaphylactiques survenant au cours d’anesthésies, sans exclure la possibilité qu’ils soient aussi impliqués dans l’aggravation d’anaphylaxies alimentaires [
17–
19]. Le rôle de l’aspirine en prises orales dans l’anaphylaxie alimentaire avait été établi par l’étude des effets de l’allergène isolé ou associé à la prise d’aspirine [
20,
21]. Une étude cas-contrôle menée sur 76 cas de chocs anaphylactiques comparés à 235 cas d’allergies alimentaires d’intensité modérée à moyenne a pu non seulement confirmer ces connaissances mais, en outre, incriminer formellement les inhibiteurs de l’ECA (IEC) et les anti-inflammatoires non stéroïdiens (AINS) en chiffrant le risque relatif d’anaphylaxie induit par ces classes pharmacologiques [
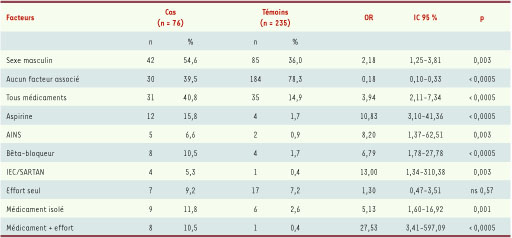
22] (Tableau I).
 | Tableau I
Facteurs de risque d’anaphylaxie sévère (médicaments, exercice, alcool). Étude cas-contrôle de 76 cas de chocs anaphylactiques et de 235 cas d’allergie alimentaire modérée à moyenne [ 22]. OR : odds ratio ; AINS : anti-inflammatoires non stéroïdiens ; IEC : inhibiteurs de l’enzyme de conversion ; SARTAN : antagonistes des récepteurs de l’angiotensine II. |
Il est donc particulièrement utile d’approfondir l’étude des mécanismes de ces effets potentialisateurs du processus allergique. Ils peuvent intervenir au niveau des cellules effectrices, de l’endothélium, des fibres musculaires lisses des vaisseaux et de la muqueuse digestive. Certaines classes pharmacologiques sont prescrites quotidiennement : bêta-bloqueurs, IEC, aspirine à dose anti-agrégante en cardiologie, AINS dans les indications rhumatologiques, statines, inhibiteurs de pompe à protons, etc. L’aspirine et les AINS sont des médicaments couramment pris isolément. Dans un groupe de 76 patients ayant souffert d’anaphylaxie alimentaire, un sujet sur dix prenait des bêta-bloqueurs alors que dans les allergies d’intensité modérée, seuls 4 sujets sur 235 prenaient ce médicament. L’OR est de 6,8 (Tableau I) [22]. En revanche, les antihypertenseurs alpha-bloquants ne sont pas décrits comme facteurs de risque d’anaphylaxie. Les mécanismes classiquement invoqués dans cette potentialisation sont doubles. D’une part le blocage des récepteurs bêta sur les cellules effectrices facilite la libération d’histamine. D’autre part, le traitement par bêta-bloqueur entraîne une réduction du nombre de récepteurs bêta puis secondairement alpha rendant les fibres musculaires lisses moins sensibles aux effets vasoconstricteurs de l’adrénaline. Cela prive l’organisme d’une réponse physiologique protectrice liée à la production par la médullo-surrénale de catécholamines dès qu’il y a libération d’histamine. Le collapsus installé est également réfractaire a l’administration d’adrénaline [17–19]. L’action principale pourrait se situer au niveau de l’endothélium, porteur de récepteurs bêta : en effet, la bêta-stimulation au niveau de l’endothélium prévient l’hyperperméabilité associée à l’anaphylaxie expérimentale [
23]. On peut donc concevoir que les bêta-bloqueurs s’opposent à cet effet bénéfique. |
Inhibiteurs de l’enzyme de conversion de l’angiotensine Les IEC bloquent l’activité de l’enzyme de conversion de l’angiotensine (ECA). Notons que l’ECA est largement représentée sur tous les endothéliums, et sur l’épithélium de l’intestin grêle, les deux sites privilégiés de l’agression par les allergènes alimentaires. Le taux circulant de l’ECA est bas voire nul sous traitement par les IEC [
24]. Cette enzyme est impliquée dans le catabolisme de la bradykinine, dans lequel intervient aussi l’aminopeptidase P. Son blocage pharmacologique par les IEC entraîne des angiœdèmes, parfois létaux chez des sujets qui présentent de façon latente une déficience en aminopeptidase P [
25]. Une étude cas-contrôle a montré que la prise d’IEC est un facteur de risque d’angiœdème (OR de 5,1) [
26]. En ce qui concerne les allergies alimentaires, il a été montré que lorsque les allergies sévères aux fruits à coque s’expriment par un angiœdème pharyngo-laryngé, elles sont liées à un taux bas de l’ECA, sans modification du taux d’aminopeptidase P [
27]. Un cas avéré d’anaphylaxie alimentaire dû à un IEC a été rapporté [
28]. L’étude cas-contrôle confirme l’implication des IEC dans le collapsus anaphylactique, l’OR étant de 13, donc particulièrement élevé. Un collapsus serait facilité par un double mécanisme : d’une part, l’action très vasodilatatrice de la bradykinine insuffisamment dégradée pourrait s’ajouter aux effets de l’histamine et des leucotriènes ; d’autre part, le blocage de l’ECA diminue le taux d’angiotensine 2, ce qui altère la réponse homéostasique. En effet, l’angiotensine 2 est un puissant vasoconstricteur, directement et par son effet stimulant la décharge noradrénergique des terminaisons sympathiques [
14]. Un taux bas a été corrélé avec la sévérité de l’anaphylaxie aux hyménoptères [
29,
30]. |
Aspirine ou anti-inflammatoires non stéroïdiens Le fait que l’aspirine soit un facteur de risque d’anaphylaxie sévère a été documenté par la comparaison de tests de provocation à l’aliment, négatifs sans aspirine et positifs lorsqu’il y a coadministration. L’aspirine, prise de manière isolée, est bien tolérée par les patients, ce qui exclut son rôle direct [20, 21]. Même les faibles doses utilisées en prévention d’accidents cardiovasculaires semblent présenter un risque [
31]. Les mécanismes d’action sont doubles. Au niveau de la muqueuse intestinale, l’aspirine provoque une augmentation de la perméabilité [
32]. Celle-ci favorise un passage accru de l’allergène dans le sang [
33]. Au niveau de plusieurs types cellulaires, mais en particulier des mastocytes activés par les IgE spécifiques qui sont liées par les allergènes, l’aspirine interfère avec le métabolisme de l’acide arachidonique en bloquant la voie des cyclooxygénases, et en favorisant l’activité de la voie de la lipoxygénase. Ceci conduit à une synthèse accrue de leucotriènes chez certains sujets [13]. La prise d’AINS est une cause connue d’angiœdèmes, le risque relatif ayant été évalué à un OR de 4,13 [26]. Elle potentialise la sévérité de la réaction allergique (RR 8,2). Les mécanismes d’action (inhibition de la cyclo-oxygénase et hyperperméabilité intestinale) sont similaires à ceux de l’aspirine [
34]. Il est intéressant de noter que l’exercice physique, associé à la prise de médicament, potentialise de façon drastique le risque propre du médicament : l’OR pour le médicament seul est de 5,1 alors que l’association du médicament et de l’exercice conduit à obtenir un OR de 27,5 (Tableau I). On sait que l’exercice, associé à l’ingestion d’un allergène alimentaire, peut déclencher une anaphylaxie [20, 21,
35]. Parmi les causes, probablement multiples, l’induction d’une hyperperméabilité intestinale pour l’allergène a été démontrée chez l’animal comme chez l’homme [33,
36]. On peut postuler que cette hyperperméabilité augmente aussi le passage rapide du médicament dans la circulation, ce qui accentue ses effets pharmacologiques et donc potentialise l’anaphylaxie. La brusque stimulation du système nerveux parasympathique déclenchée par l’effort pourrait aussi favoriser la libération d’histamine car les mastocytes humains ont des récepteurs cholinergiques [
37]. |
Autres agents pharmacologiques D’autres classes pharmacologiques sont-elles susceptibles de potentialiser la sévérité de la réaction allergique ? Aucune publication ne documente un effet indésirable des prises d’alpha-bloqueurs et des inhibiteurs calciques. Les inhibiteurs de pompe à protons, très largement prescrits, ont été incriminés comme favorisant des sensibilisations alimentaires, mais pas des allergies alimentaires sévères [
38]. Il conviendrait d’exercer une surveillance des patients traités par cette classe médicamenteuse ainsi que par des médicaments qui inhibent la diamineoxydase, enzyme majeur de la dégradation de l’histamine : antibiotiques (acide clavulanique, céfuroxime et céfotiam, imipénem, isoniazide, métronidazole, pentamidine), mucolytiques (ambroxol, acétylcystéine) ; et d’autres médicaments tels que dihydralazine, propafénone, vérapamil, dobutamine, aminophylline et salazosulfapyridine [
39]. Enfin, l’effet des médicaments ayant un impact sur le fonctionnement endothélial, comme les statines, serait également à surveiller. |
Les mécanismes de l’anaphylaxie alimentaire s’exercent principalement sur trois cibles cellulaires : cellules effectrices, endothélium, muqueuse intestinale. Les études actuelles montrent le rôle majeur d’un dysfonctionnement endothélial et laissent entrevoir l’importance des polymorphismes enzymatiques impliqués dans la synthèse et la dégradation des médiateurs de l’anaphylaxie [13, 14,
40]. L’action potentialisatrice des bêta-bloqueurs, des IEC, de l’aspirine et des AINS, établie dans l’allergie alimentaire, devrait aussi se rencontrer dans l’allergie aux hyménoptères, dans laquelle le rôle des IEC est désormais affirmé [
41]. Elle pourrait aussi probablement être impliquée dans la sévérité d’accidents d’hypersensibilité non immunologique ou de mécanismes mal connus comme les accidents aux produits iodés de contraste [
42]. L’association de deux ou plus de ces classes pharmacologiques est courante en cardiologie, et ces médicaments sont souvent prescrits à des patients ayant un âge élevé, associé à un vieillissement endothélial. Ces faits ont deux conséquences : d’une part, poser un diagnostic actuel d’anaphylaxie chez un sujet sous traitement conduit couramment à suspecter une anaphylaxie ou une intolérance aux médicaments. Il est probable qu’un certain nombre de ces cas soit attribuable à une allergie alimentaire méconnue. D’autre part, ces constatations légitiment une prévention secondaire destinée aux patients présentant des sensibilisations alimentaires encore sans expression clinique. Des conseils simples seraient de recommander de ne pas prendre d’aspirine ou d’AINS au début des repas, tout en reconnaissant que des traitements de plusieurs jours sont aussi incriminables, lorsque la prise médicamenteuse est faite à distance de l’ingestion de l’allergène. Une contre-indication au traitement par bêta-bloqueurs ou par IEC doit être nuancée. Elle ne peut être systématique : dans les cardiopathies, le bénéfice thérapeutique paraît supérieur au risque d’aggravation d’une anaphylaxie, ellemême aggravée par une cardiopathie [
43]. En revanche, pour le traitement de l’hypertension artérielle, on dispose généralement d’autres classes thérapeutiques. De façon générale, une vigilance accrue vis-à-vis des prescriptions médicamenteuses doit être recommandée : aucune nouvelle interférence ne devrait être éliminée a priori. C’est dire que la déclaration d’effets indésirables sévères devrait être faite à la pharmacovigilance, certes, mais également au réseau allergovigilance [
44]. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.

|
Footnotes |
1. Johansson S, Bieber T, Dahl R, et al. Revised nomenclature for allergy for global use: report of the romenclature review committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol 2004; 113 : 832-6. 2. Moneret-Vautrin DA, Morisset M, Flabbee J, et al. Epidemiology of life-threatening and lethal anaphylaxis: a review. Allergy 2005; 60 : 443-51. 3. Gupta R, Sheikh A, Strachan D, Anderson HR. Time trends in allergic disorders in the UK. Thorax 2006; 62 : 91-6. 4. Poulos LM, Waters AM, Corell P, et al. Trends in hospitalizations for anaphylaxis, angioedema, and urticaria in Australia, 1993-1994 to 2004-2005. J Allergy Clin Immunol 2007; 120 : 878-84. 5. Kanny G, Moneret-Vautrin DA, Flabbee J, et al. Population study of food allergy in France. J Allergy Clin Immunol 2001; 108 : 133-40. 6. Simon MR, Mulla ZD. A population-based epidemiologic analysis of deaths from anaphylaxis in Florida. Allergy 2008; 63 : 1077-83. 7. Pumphrey R. Lessons for management of anaphylaxis from a study of fatal reactions. Clin Exp Allergy 2000; 30 : 1144-50. 8. Greenberger PA, Rotskoff BD, Lifschultz B. Fatal anaphylaxis: postmortem findings and associated comorbid diseases. Ann Allergy Asthma Immunol 2007; 98 : 252-7. 9. Brokow K, Jofer C, Behrendt H, Ring J. Anaphylaxis in patients with mastocytosis: a study on history, clinical features and risk factors in 120 patients. Allergy 2008; 63 : 226-32. 10. Mueller UR. Cardiovascular disease and anaphylaxis. Curr Opin Allergy Clin Immunol 2007; 7 : 337-41. 11. Liew WK, Williamson E, Tang ML. Anaphylaxis fatalities and admissions in Australia. J Allergy Clin Immunol 2009; 123 : 434-42. 12. Burks AW. Factoring PAF in anaphylaxis. N Engl J Med 2008; 358 : 79-81. 13. Cowburn AS, Sladek K, Soja J, et al. Overexpression of leukotriene c4 synthase in bronchial biopsies from patients with aspirin-intolerant asthma. J Clin Invest 1998; 10 : 834-46. 14. Drouet C, Desormeaux A, Robillard J, et al. Metallopeptidase activities in hereditary angioedema: effect of androgen prophylaxis on plasma aminopeptidase P. J Allergy Clin Immunol 2007; 121 : 429-3. 15. Vadas P, Gold M, Perelman B, et al. Platelet-activating factor, PAF acetylhydrolase, and severe anaphylaxis. N Engl J Med 2008; 3 : 28-35. 16. Dzau VJ. Vascular renin-angiotensin system and vascular protection. J Cardiovasc Pharmacol 1993; 22 : S1-9. 17. Toogood JH. Risk of anaphylaxis in patients receiving beta-blocker drugs. J Allergy Clin Immunol 1988; 81 : 1-5. 18. Laxenaire MC, Torrens J, Moneret-Vautrin DA. Fatal anaphylactic shock in a patient treated with beta-blockers. Ann Fr Anesth Reanim 1984; 3 : 453-5. 19. Moneret-Vautrin DA, Kanny G, Faller J, et al. Severe anaphylactic shock with heart arrest caused by coffee and gum arabic, potentiated by beta-blocking eyedrops. Rev Med Interne 1993; 14 : 107-11. 20. Dohi M, Suko M, Sjiyama H, et al. Three cases of food-dependent exercise-induced anaphylaxis in which aspirin intake exacerbated anaphylactic symptoms. Aerugi 1990; 39 : 1598-604. 21. Harada S, Horikawa T, Ashida M, et al. Aspirin enhances the induction of type i allergic symptoms when combined with food and exercise in patients with food-dependent exercise-induced anaphylaxis. Br J Dermatol 2001; 145 : 336-9. 22. Moneret-Vautrin DA, Latarche C. Médicaments facteurs de risque de sévérité de l’anaphylaxie alimentaire de l’adulte. Étude cas-contrôle. Bull Acad Natl Med 2009; 193 : 51-63. 23. Inagaki N, Miura T, Nagai H, Koda A. Antiallergic mechanisms of beta-adrenergic stimulants in rats. Life Sci 1992; 51 : 201-5. 24. Baudin B. L’enzyme de conversion de l’angiotensine 1 (ECA) dans le diagnostic de la sarcoïdose. Pathol Biol 2005; 53 : 183-8. 25. Adam A, Desormeaux A, Moreau ME. Physiopathology of the acute adverse effects of angiotensin- converting-enzyme inhibitors. Bull Acad Natl Med 2007; 191 : 1433-44. 26. Gabb GM, Ryan P, Wing LM, Hutchinson KA. Epidemiological study of angioedema and ACE inhibitors. Aust NZ J Med 1996; 26 : 777-82. 27. Summers CW, Pumphrey RS, Woods CN, et al. Factors predicting anaphylaxis to peanuts and tree nuts in patients referred to a specialist center. J Allergy Clin Immunol 2008; 121 : 632-8. 28. Moneret-Vautrin DA, Bilain H, Kanny G, Bloch Y. Anaphylaxis to walnuts and pine nuts induced by ACE. Allergy 1998; 53 : 1233-4. 29. Hermann K, Von Tschirschnitz M, Ebner von Eschenbach C, Ring J. Histamine, tryptase, norepinephrine, angiotensinogen, angiotensin-converting enzyme, angiotensin i and ii in plasma of patients with hymenoptera venom anaphylaxis. Int Arch Allergy Immunol 1994; 104 : 379-84. 30. Hermann K, Ring J. The renin-angiotensin system in patients with repeated anaphylactic reactions during hymenoptera venom hyposensitization and sting challenge. Int Arch Allergy Immunol 1997; 112 : 251-6. 31. Fujii H, Kambe N, Fujisawa A, et al. Food-dependent exercise-induced anaphylaxis induced by low dose aspirin therapy. Allergol Int 2008; 57 : 97-8. 32. Rabassa AA, Goodgame R, Sutton FM, et al. Effects of aspirin and helicobacter pylori on the gastroduodenal mucosal permeability to sucrose. Gut 1996; 39 : 159-63. 33. Matsuo H, Morimoto K, Akaki T, et al. Exercise and aspirin increase levels of circulating gliadin peptides in patients with wheat-dependent exercise-induced anaphylaxis. Clin Exp Allergy 2005; 35 : 461-6. 34. Smecuol E, Bai JC, Sugai E, et al. Acute gastrointestinal permeability responses to different non-steroidal anti-inflammatory drugs. Gut 2001; 4 : 650-5. 35. Aihara M, Miyazawa M, Osuna H, et al. Food-dependent exercise-induced anaphylaxis: influence of concurrent aspirin administration on skin testing and provocation. Br J Dermatol 2002; 146 : 466-72. 36. Yano H, Kato Y, Matsuo T. Acute exercise induces gastrointestinal leakage of allergen in lysozyme-sensitized mice. Eur J Appl Physiol 2002; 87 : 358-64. 37. Sudheer PS, Hall JE, Donev R, et al. Nicotinic acetylcholine receptors on basophils and mast cells. Anaesthesia 2006; 61 : 1170-4. 38. Scholl I, Untersmayr E, Bakos N, et al. Antiulcer drugs promote oral sensitization and hypersensitivity to hazelnut allergens in balb/c mice and humans. Am J Clin Nutr 2005; 81 : 154-60. 39. Sattler J, Hesterberg R, Lorentz W, et al. Inhibition of human and canine diamine oxidase by drugs used in an intensive care unit: relevance for clinical side effects? Agents Actions 1985; 16 : 91-4. 40. Korhonen H, Fisslthaler B, Moers A, et al. Anaphylactic shock depends on endothelial gq/g11. J Exp Med 2009; 206 : 411-20. 41. Rueff F, Przybilla B, Bilo MB, et al. Predictors of severe systemic anaphylactic reactions in patients with Hymenoptera venom allergy: importance of baseline serum tryptase-a study of the European Academy of Allergology and Clinical Immunology interest group on insect venom hypersensitivity. J Allergy Clin Immunol 2009; 124 : 1047-54. 42. Javeed N, Javeed H, Javeed S, et al. Refractory anaphylactoid shock potentiated by beta-blockers. Cathet Cardiovasc Diagn 1996; 3 : 383-4. 43. Tenbrook JA, Wolf MP, Hoffman SN, et al. Should beta-blockers be given to patients with heart disease and peanut-induced anaphylaxis? A decision analysis. J Allergy Clin Immunol 2004; 113 : 977-82. 44. Moneret-Vautrin DA. Le risque allergique et le rôle du Réseau d’allergovigilance Bull Acad Natl Med 2007; 191 : 807-14. |