| |
| Med Sci (Paris). 2010 August; 26(8-9): 734–739. Published online 2010 August 15. doi: 10.1051/medsci/2010268-9734.Sélectivité fonctionnelle des ligands des récepteurs opiacés Nicolas Audet, Élodie Archer-Lahlou, Mélissa Richard-Lalonde, and Graciela Pineyro-Filpo* Départements de pharmacologie et de psychiatrie, Université de Montréal, 2332, boulevard Édouard-Montpetit, Montréal (Québec) H3C 3T5, Canada Centre de recherche du CHU Sainte-Justine, 3175, chemin de la
Côte-Sainte-Catherine, Montréal (Québec), H3T 1C5 Canada |
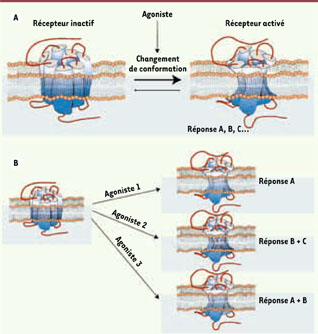
La sélectivité fonctionnelle : un nouveau concept pharmacologique Dans le but de prédire si un médicament aura la capacité de se lier à un récepteur (affinité) et de l’activer (efficacité), la pharmacologie classique se fonde sur des principes de type quantitatif. Ces principes reposent sur l’hypothèse selon laquelle un récepteur oscille entre une conformation active et une conformation inactive, l’état actif étant à la source de toutes les réponses pharmacologiques associées au récepteur (Figure 1A). Dans ce modèle, l’efficacité d’un ligand est définie par sa capacité à stabiliser diverses quantités d’une seule conformation active du récepteur : l’agoniste complet stabilise une grande quantité de la forme active, l’agoniste partiel une quantité moindre, l’agoniste inverse stabilise principalement la conformation inactive, quant à l’antagoniste, il occupe le récepteur sans modifier la distribution entre les deux états de celui-ci [
1].  | Figure 1
Évolution du concept d’efficacité en pharmacologie. A. Modèle à deux états : une conformation active unique est à la source de toutes les réponses associées à un récepteur donné. B. États actifs multiples : différentes conformations actives présentent des profils de signalisation distincts. |
Ce modèle pharmacologique classique a cependant été remis en question au cours de ces dernières années. Les progrès technologiques ont en effet permis de démontrer que l’ordre d’efficacité et/ou de puissance de différents ligands peut s’inverser lorsque ces propriétés sont évaluées sur plusieurs voies de signalisation [
2]. Ces observations ne peuvent pas s’expliquer par l’existence d’un état actif unique. Elles impliqueraient plutôt qu’un même récepteur puisse être stabilisé sous différentes conformations actives dont chacune possède des propriétés de signalisation spécifiques [1,
3]. Avec ce nouveau concept est née l’idée que la mise au point de ligands sélectifs qui stabiliseraient spécifiquement certaines conformations de récepteurs pourrait permettre de cibler des voies de signalisation et donc d’obtenir les réponses pharmacologiques qui y sont associées (Figure 1B) [3]. La capacité d’un ligand à stabiliser un récepteur dans une conformation reliée à des propriétés de signalisation et/ou de régulation spécifiques [2] est appelée sélectivité fonctionnelle [1] ou biased agonism [3]. Ce nouveau paradigme est actuellement l’objet d’une attention considérable puisqu’il constitue théoriquement un moyen de dissocier les effets désirables d’un médicament de ses effets indésirables, à condition, bien sûr, de connaître les signaux correspondant à chaque type de réponse. |
Les récepteurs opiacés, dont les trois sous-types connus sont le μ (MOR), le δ (DOR) et le κ (KOR), appartiennent à la famille des récepteurs couplés aux protéines G (RCPG). Leur activation est associée à l’inhibition de l’adénylate cyclase (AC) par les sous-unités Gαi/o et à la modulation d’effecteurs par les sous-unités Gβγ des protéines G hétérotrimériques (Gαβγ). Cette modulation inclut l’activation des kinases régulées par un signal extracellulaire (ERK) [
4], l’activation des phospholipases C (PLC) [
5] ainsi que la modulation des canaux calciques N/P [
6] et des canaux potassiques à rectification entrante1 (GIRK) [
7]. Les récepteurs opiacés peuvent également activer une voie de signalisation indépendante de celles des protéines G. L’activation de la cascade ERK par la β-arrestine en est un exemple typique [
8]. Les agonistes des récepteurs opiacés sont les analgésiques les plus efficaces actuellement disponibles. L’activation des trois sous-types conduit à des effets antinociceptifs, mais les opiacés généralement utilisés dans le traitement de la douleur (par exemple la morphine, l’hydromorphone, le fentanyl et l’oxycodone) agissent de façon prédominante sur le MOR, dont l’activation est indissociable d’effets indésirables tels que la constipation, la dépression respiratoire, la tolérance, la dépendance physique ainsi que les risques d’abus [
9-
11]. L’analgésie induite par les agonistes du KOR est associée à un potentiel d’abus inférieur à celui produit par les ligands du MOR [
10], mais les propriétés psychomimétiques de ces agonistes [
12], le développement de tolérance [
13] ainsi que leurs effets dysphoriques et anxiogènes [
14] limitent leur utilisation clinique. Enfin, les agonistes du DOR produisent certes moins de dépression respiratoire [
15], de constipation [
16] et de dépendance physique [
17] que les agonistes du MOR, mais il a été démontré dans des modèles animaux de douleur chronique et aiguë qu’ils entraînent une tolérance à l’analgésie [11,
18,
19]. Ces observations suggèrent que l’obtention de ligands sélectifs de l’un des soustypes de récepteurs n’apportera qu’une réponse partielle aux problèmes causés par des analgésiques opiacés. Par conséquent, de nouvelles modalités de recherche doivent être conçues afin de développer des agonistes opiacés dotés d’un meilleur profil thérapeutique. Une manière d’aborder le problème consisterait à exploiter le concept de sélectivité fonctionnelle pour un sous-type de récepteur, notamment pour élaborer des opiacés dont le potentiel de tolérance serait réduit. Dans les sections suivantes, nous évaluerons les données qui soutiennent l’idée que les récepteurs opiacés constituent des cibles valables pour la mise au point de ligands fonctionnellement sélectifs. Nous proposerons une hypothèse centrée sur le type de sélectivité fonctionnelle qui permettrait de réduire la tolérance analgésique. L’accent sera mis sur les ligands du MOR et du DOR, compte tenu des perspectives prometteuses qu’ils offrent en vue du traitement pharmacologique des douleurs sévères. |
Sélectivité fonctionnelle et signalisation des récepteurs opiacés La capacité des ligands opiacés à stabiliser différentes conformations actives a été démontrée sur des récepteurs purifiés en utilisant la résonance plasmonique de surface [
20]. Il a été observé que l’affinité des DOR pour différentes sous-unités Gα varie en fonction de l’agoniste utilisé, démontrant ainsi que le ligand peut déterminer le partenaire de signalisation du récepteur auquel il est lié. Ces résultats sont en accord avec les observations obtenues dans des cellules vivantes qui montrent que le DOR occupé par différents ligands interagit de façon distincte avec les différentes sous-unités du complexe Gαβγ [
21]. La stabilisation de conformations spécifiques par divers ligands, qui entraîne l’activation préférentielle de différentes cascades de signalisation, se manifeste par une inversion de l’ordre d’efficacité et/ou de puissance de ces ligands. Cette inversion est primordiale pour démontrer la sélectivité fonctionnelle des ligands [1, 3]. Par exemple, dans des cellules exprimant de façon endogène le DOR, l’activation de la sous-unité Gαi2 est plus importante que l’activation de la sous-unité Gαo2 lorsque le DOR est occupé par l’agoniste DPDPE ([D-Pen2,5]-Enkephalin), tandis que le DOR stabilisé par l’agoniste deltorphine I active préférentiellement Gαo2 [
22]. La sélectivité fonctionnelle des ligands du MOR n’a, quant à elle, pas encore été clairement établie bien qu’une inversion de l’ordre d’efficacité des agonistes pour les protéines de fusion MOR-Gαo1 et MOR-Gαi2 ait été observée [
23]. Il est important de ne pas confondre la sélectivité fonctionnelle des ligands avec la sélectivité de signalisation qui dépend du type cellulaire. Dans ce dernier cas, la spécificité de la réponse pharmacologique est déterminée par les protéines de signalisation qui sont exprimées dans la cellule étudiée [3]. Les propriétés pharmacologiques et signalétiques des récepteurs opiacés peuvent en effet varier en fonction du profil d’expression protéique qui est spécifique à chaque type cellulaire. Différents partenaires de dimérisation peuvent ainsi modifier les propriétés pharmacologiques des récepteurs [
24,
25]. Pourtant, si aucune inversion de l’ordre d’efficacité et/ou de puissance des ligands n’est observée, ces modifications ne constituent pas une preuve irréfutable de la présence de conformations actives spécifiques aux ligands. L’hétérodimérisation DOR/MOR, par exemple, produit un changement de couplage du DOR de Gαi3 vers Gαz, mais le DPDPE reste plus efficace que la deltorphine II pour activer les différentes sous-unités Gα [25]. Par ailleurs, la sélectivité fonctionnelle ne se limite pas à produire l’activation de différentes sous-unités Gα. Elle peut également permettre l’activation de voies de signalisation par des mécanismes différents. La morphine et l’étorphine, par exemple, deux agonistes du MOR, provoquent l’activation des kinases ERK. Cependant, cette activation passe par l’intermédiaire de la protéine kinase C (PKC) dans le cas de la morphine tandis que celle déclenchée par l’étorphine implique l’intervention de la β-arrestine [8]. Ces deux mécanismes conduisent d’ailleurs à des distributions subcellulaires différentes des ERK, l’étorphine et de la morphine entraînant respectivement une accumulation de la kinase dans le noyau et le cytoplasme [8]. Les ligands du DOR produisent également différentes conformations actives du récepteur, possédant une sélectivité fonctionnelle en ce qui concerne les voies ERK et AC. Le TICP (Tyr-TicΨ [CH2-NH]Cha-Phe-OH) et le DPDPE amorcent tous deux l’activation de la cascade ERK, mais le DPDPE se comporte comme un agoniste dans la voie cyclase tandis que le TICP est agoniste inverse sur cette voie [2]. Ces observations indiquent que même si le DOR occupé par l’un ou l’autre des ligands est capable d’activer la voie de signalisation des ERK, les conformations sont nécessairement distinctes puisqu’elles produisent des effets opposés sur la voie de l’AMPc. |
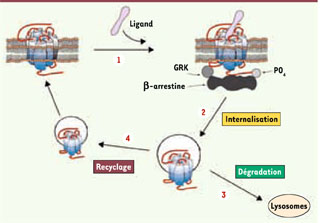
Sélectivité fonctionnelle et tolérance analgésique La tolérance à l’analgésie est un phénomène complexe : elle implique des changements à différents niveaux d’organisation du système nerveux central. Ces changements débutent par des adaptations cellulaires et moléculaires qui se développent de façon progressive jusqu’à interférer avec la fonction normale des circuits de perception de la douleur. En particulier, la tolérance aux opiacés s’installe par suite d’un traitement prolongé et serait associée à la désensibilisation du récepteur et/ou à des changements adaptatifs au niveau cellulaire qui s’opposent aux effets induits par l’activation soutenue de ce dernier. Désensibilisation des récepteurs opiacés La désensibilisation des récepteurs se manifeste par une réduction de leur capacité de signalisation. Elle débute par l’activation des kinases dépendantes du second messager et/ou de type GRK (kinases des RCPG) qui entraînent la phosphorylation du récepteur et son découplage des protéines G. La phosphorylation par les GRK induit le recrutement de la β-arrestine vers le récepteur et permet ensuite la formation d’un complexe avec les protéines d’endocytose. Après leur i nternalisation, les récepteurs sont soit dégradés par les lysosomes, soit recyclés vers la membrane pour un nouveau cycle de signalisation (Figure 2). 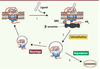 | Figure 2
Désensibilisation homologue et trafic intracellulaire des récepteurs opiacés. 1. Par suite de l’activation prolongée du récepteur par un agoniste, des kinases de type GRK produisent la phosphorylation du récepteur. 2. Le recrutement de la β-arrestine permet le découplage des protéines G et l’interaction du récepteur avec les protéines d’endocy-tose. Le récepteur internalisé est alors soit (3) dégradé soit (4) recyclé pour un nouveau cycle de signalisation. |
La théorie pharmacologique classique prédit une corrélation directe entre la capacité de signalisation d’un ligand et sa capacité à enclencher des processus de régulation. Toutefois, certaines études ont montré l’absence d’une telle corrélation indiquant que les mécanismes de régulation peuvent également être mis en œuvre spécifiquement en fonction des ligands utilisés. À titre d’exemple, la morphine, qui se comporte comme un agoniste partiel du MOR dans la voie cyclase, produit la phosphorylation du récepteur par un mécanisme dépendant de la PKC et indépendant de GRK2 [
26,
27]. À l’inverse, le DAMGO ([D-Ala2, N-Me-Phe4, Gly
5
-ol]-Enkephalin), qui est agoniste complet sur la voie cyclase, ne peut stimuler la PKC. En revanche, il induit la phosphorylation du MOR par un mécanisme dépendant de GRK2 [26]. Contrairement à la phosphorylation par la PKC, la phosphorylation par GRK2 facilite le recrutement de la P-arrestine vers le MOR, son internalisation, ainsi que son recyclage (Figure 2). Ces deux dernières étapes étant primordiales pour la resensibilisation des récepteurs phosphorylés, le DAMGO serait donc plus efficace que la morphine pour éviter la tolérance analgésique puisqu’il recrute GRK2 [
28]. Un autre exemple de dissociation entre la signalisation et l’internalisation est observé avec l’herkinorine, un agoniste MOR dont on ignore les propriétés analgésiques et de tolérance. Ce ligand possède une efficacité de signalisation comparable à celle du DAMGO, mais n’entraîne ni le recrutement de la β-arrestine, ni l’internalisation du récepteur [
29]. Les agonistes du DOR peuvent également stabiliser différentes conformations de récepteurs dotés de propriétés de régulation distinctes. Les DOR activés par le DPDPE ou le SNC-80, par exemple, sont phosphorylés sur des résidus sérine et/ou thréonine différents. Ainsi peuvent-ils réguler différemment le trafic postendocytique [
30]. Les DOR occupés par le DPDPE sont en effet plus susceptibles d’être recyclés vers la membrane après leur internalisation que ceux activés par le SNC-80. Cette différence a été observée dans des cellules HEK293 et dans des cultures de neurones corticaux (résultats non publiés). Ainsi, les DOR traités avec le SNC-80 sont dégradés par voie lysosomale après leur internalisation, entraînant une extinction rapide du signal et le développement de la tolérance analgésique [19, 30]. À l’inverse, l’internalisation produite par le DPDPE entraîne le recyclage vers la membrane d’une partie des récepteurs qui pourront alors retrouver leur couplage aux protéines G et permettre une certaine résistance à la désensibilisation [
31]. Enfin, la démonstration la plus évidente de la sélectivité fonctionnelle des ligands concernant la désensibilisation du DOR a été fournie par la comparaison du SNC-80 avec son métabolite M100390. Alors que ces deux ligands activent les protéines G et induisent de l’analgésie avec la même efficacité, seul le SNC-80 produit la phosphorylation du récepteur, sa désensibilisation et engendre la tolérance [19]. Ces résultats suggèrent que la tolérance à l’analgésie pourrait être réduite grâce à des ligands dont la sélectivité fonctionnelle permettrait de dissocier les processus de signalisation de ceux qui conduisent à la désensibilisation des récepteurs opiacés. Selon cette hypothèse, la mise au point d’agonistes n’induisant pas la phosphorylation et/ou ciblant le recyclage des récepteurs permettrait de diminuer la tolérance analgésique. Adaptations cellulaires L’action analgésique des opiacés est principalement transmise par les canaux [ 7]. La fermeture des canaux calciques par les opiacés inhibe la libération des neurotransmetteurs à partir des neurones afférents nociceptifs primaires [ 6], et l’activation des canaux potassiques hyperpolarise les relais neuronaux de la voie nociceptive [ 7] (Figure 3). Cependant, une inhibition prolongée de la voie cyclase par les opiacés entraîne des adaptations cellulaires qui aboutiront finalement à une suractivation compensatoire de cette voie [ 28]. Plusieurs études démontrent une corrélation directe entre une production excessive d’AMPc et la tolérance analgésique : l’administration intracérébroventriculaire d’AMPc augmente la tolérance à l’analgésie [
32] ; l’administration intracérébroventriculaire d’inhibiteur de la PKA réduit la tolérance à la morphine [
33] ; les souris génétiquement modifiées qui surexpriment l’AC-VII [
34] et celles qui n’expriment pas les cyclases dépendantes de la calmoduline (AC-I/AC-VIII) [
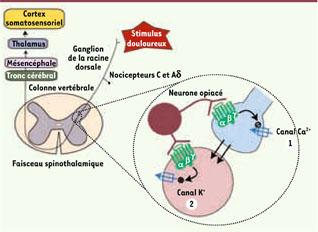
35] présentent respectivement une augmentation et une diminution de la tolérance à l’effet analgésique des opiacés. Ces observations suggèrent qu’en dissociant la signalisation associée aux canaux ioniques de celle associée à la voie cyclase, il serait possible d’élaborer des ligands opiacés aptes à susciter un effet analgésique sans déclencher les adaptations cellulaires qui causent une production exagérée d’AMPc. Par conséquent, un tel type de ligand entraînerait probablement moins de tolérance. 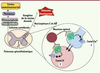 | Figure 3
Rôle des signaux induits par les récepteurs opiacés dans la régulation de l’activité du circuit de perception de la douleur. Les récepteurs opiacés sont présents à la fois sur les terminaisons des neurones ganglionnaires, les neurones postsynaptiques de la moelle épinière et les interneurones spinaux. La moelle épinière joue donc un rôle de plaque tournante dans les régulations ascendantes et descendantes de la douleur. L’activation des récepteurs opiacés (1) entraîne la fermeture des canaux calciques réduisant la libération de neurotransmetteurs par les nocicepteurs et (2) active les canaux potassiques causant une réduction de l’excitabilité des neurones postsynaptiques. |
|
Les études qui ont été citées dans cette synthèse démontrent que les récepteurs opiacés peuvent adopter différentes conformations actives possédant des propriétés de signalisation et de régulation spécifiques. L’utilisation de modèles animaux a permis d’établir qu’en exploitant la sélectivité fonctionnelle des ligands du DOR, les effets analgésiques produits par ce récepteur pourraient être dissociés des effets conduisant à la tolérance. Le défi consiste maintenant à appliquer ce nouveau concept de sélectivité fonctionnelle afin de mettre au point de nouveaux analgésiques, en séparant les effets désirés des effets néfastes des opiacés. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Les auteurs remercient chaleureusement le Dr Robert Élie pour sa relecture attentive et critique de ce manuscrit ainsi que le Conseil de recherches en sciences naturelles et en génie (CRSNG) pour son soutien financier.
|
Footnotes |
1. Urban JD, Clarke WP, von Zastrow M, et al. Functional selectivity and classical concepts of quantitative pharmacology. J Pharmacol Exp Ther 2007 ; 320 : 1-13. 2. Audet N, Paquin-Gobeil M, Landry-Paquet O, et al. Internalization and Src activity regulate the time course of ERK activation by delta opioid receptor ligands. J Biol Chem 2005 ; 280 : 7808-16. 3. Kenakin T. Functional selectivity through protean and biased agonism: who steers the ship? Mol Pharmacol 2007 ; 72 : 1393-401. 4. May LT, Hill SJ. ERK phosphorylation: spatial and temporal regulation by G protein-coupled receptors. Int J Biochem Cell Biol 2008 ; 40 : 2013-7. 5. Mathews JL, Smrcka AV, Bidlack JM. A novel G-betagamma-subunit inhibitor selectively modulates mu-opioid-dependent antinociception and attenuates acute morphine-induced antinociceptive tolerance and dependence. J Neurosci 2008 ; 28 : 12183-9. 6. McDowell TS. Fentanyl decreases Ca2+ currents in a population of capsaicin-responsive sensory neurons. Anesthesiology 2003 ; 98 : 223-31. 7. Marker CL, Lujan R, Loh HH, Wickman K. Spinal G-protein-gated potassium channels contribute in a dose-dependent manner to the analgesic effect of mu- and delta- but not kappa-opioids. J Neurosci 2005 ; 25 : 3551-9. 8. Zheng H, Loh HH, Law Py. Beta-arrestin-dependent mu-opioid receptor-activated extracellular signal-regulated kinases (ERK) Translocate to Nucleus in Contrast to G protein-dependent ERK activation. Mol Pharmacol 2008 ; 73 : 178-90. 9. Kieffer BL, Gaveriaux-Ruff C. Exploring the opioid system by gene knockout. Prog Neurobiol 2002 ; 66 : 285-306. 10. Negus SS, Schrode K, Stevenson GW. Micro/kappa opioid interactions in rhesus monkeys: implications for analgesia and abuse liability. Exp Clin Psychopharmacol 2008 ; 16 : 386-99. 11. Beaudry H, Proteau-Gagné A, Li S, et al. Differential noxious and motor tolerance of chronic delta opioid receptor agonists in rodents. Neuroscience 2009 ; 161 : 381-91. 12. Walsh SL, Strain EC, Abreu ME, Bigelow GE. Enadoline, a selective kappa opioid agonist: comparison with butorphanol and hydromorphone in humans. Psychopharmacology (Berl) 2001 ; 157 : 151-62. 13. McLaughlin JP, Myers LC, Zarek PE, et al. Prolonged kappa opioid receptor phosphorylation mediated by G-protein receptor kinase underlies sustained analgesic tolerance. J Biol Chem 2004 ; 279 : 1810-8. 14. Bruchas MR, Land BB, Aita M, et al. Stress-induced p38 mitogen-activated protein kinase activation mediates kappa-opioid-dependent dysphoria. J Neurosci 2007 ; 27 : 11614-23. 15. May CN, Dashwood MR, Whitehead CJ, Mathias CJ. Differential cardiovascular and respiratory responses to central administration of selective opioid agonists in conscious rabbits: correlation with receptor distribution. Br J Pharmacol 1989 ; 98 : 903-13. 16. Porreca F, Mosberg HI, Hurst R, et al. Roles of mu, delta and kappa opioid receptors in spinal and supraspinal mediation of gastrointestinal transit effects and hot-plate analgesia in the mouse. J Pharmacol Exp Ther 1984 ; 230 : 341-8. 17. Cowan A, Zhu XZ, Mosberg HI, et al. Direct dependence studies in rats with agents selective for different types of opioid receptor. J Pharmacol Exp Ther 1988 ; 246 : 950-5. 18. Broom DC, Nitsche JF, Pintar JE, et al. Comparison of receptor mechanisms and efficacy requirements for delta-agonist-induced convulsive activity and antinociception in mice. J Pharmacol Exp Ther 2002 ; 303 : 723-9. 19. Pradhan AA, Becker JA, Scherrer G, et al. In vivo delta opioid receptor internalization controls behavioral effects of agonists. PLoS One 2009 ; 4 : e5425. 20. Alves ID, Ciano KA, Boguslavski V, et al. Selectivity, cooperativity, and reciprocity in the interactions between the delta-opioid receptor, its ligands, and G-proteins. J Biol Chem 2004 ; 279 : 44673-82. 21. Audet N, Gales C, Archer-Lahlou E, et al. Bioluminescence resonance energy transfer assays reveal ligand-specific conformational changes within preformed signaling complexes containing deltaopioid receptors and heterotrimeric G proteins. J Biol Chem 2008 ; 283 : 15078-88. 22. Allouche S, Polastron J, Hasbi A, et al. Differential G-protein activation by alkaloid and peptide opioid agonists in the human neuroblastoma cell line SK-N-BE. Biochem J 1999 ; 342 : 71-8. 23. Stanasila L, Lim WK, Neubig RR, Pattus F. Coupling efficacy and selectivity of the human muopioid receptor expressed as receptor-Galpha fusion proteins in Escherichia coli. J Neurochem 2000 ; 75 : 1190-9. 24. Gupta A, Decaillot FM, Devi LA. Targeting opioid receptor heterodimers: strategies for screening and drug development. AAPS J 2006 ; 8 : E153-9. 25. Fan T, Varghese G, Nguyen T, et al. A role for the distal carboxyl tails in generating the novel pharmacology and G protein activation profile of mu and delta opioid receptor hetero-oligomers. J Biol Chem 2005 ; 280 : 38478-88. 26. Johnson EA, Oldfield S, Braksator E, et al. Agonist-selective mechanisms of mu-opioid receptor desensitization in human embryonic kidney 293 cells. Mol Pharmacol 2006 ; 70 : 676-85. 27. Gabra BH, Bailey CP, Kelly E, et al. Pre-treatment with a PKC or PKA inhibitor prevents the development of morphine tolerance but not physical dependence in mice. Brain Res 2008 ; 1217 : 70-7. 28. Pineyro G. Fonctional selectivity at opioid receptors. In : Neve KA, ed. Fonctional selectivity of G protein-coupled receptor ligands. New york : Humana Press, 2009 : 243-66. 29. Groer CE, Tidgewell K, Moyer RA, et al. An opioid agonist that does not induce micro-opioid receptor: arrestin interactions or receptor internalization. Mol Pharmacol 2007 ; 71 : 549-57. 30. Okura T, Varga EV, Hosohata y, et al. Agonist-specific down-regulation of the human delta-opioid receptor. Eur J Pharmacol 2003 ; 459 : 9-16. 31. Archer-Lahlou E, Audet N, Amraei MG, et al. Src promotes delta opioid receptor (DOR) desensitization by interfering with receptor recycling. J Cell Mol Med 2009 ; 13 : 147-63. 32. Ho IK, Loh HH, Way EL. Effects of cyclic 3’, 5’-adenosine monophosphate on morphine tolerance and physical dependence. J Pharmacol Exp Ther 1973 ; 185 : 347-57. 33. Bernstein MA, Welch SP. Effects of spinal versus supraspinal administration of cyclic nucleotide-dependent protein kinase inhibitors on morphine tolerance in mice. Drug Alcohol Depend 1997 ; 44 : 41-6. 34. yoshimura M, Wu PH, Hoffman PL, Tabakoff B. Overexpression of type 7 adenylyl cyclase in the mouse brain enhances acute and chronic actions of morphine. Mol Pharmacol 2000 ; 58 : 1011-6. 35. Li S, Lee ML, Bruchas MR, et al. Calmodulin-stimulated adenylyl cyclase gene deletion affects morphine responses. Mol Pharmacol 2006 ; 70 : 1742-9. |