| |
| Med Sci (Paris). 2010 August; 26(8-9): 753–759. Published online 2010 August 15. doi: 10.1051/medsci/2010268-9753.O-GlcNAc glycosylation et régulation de la signalisation cellulaire Tarik Issad* Institut Cochin, 22, rue Méchain, 75014 Paris, France Université Paris Descartes, CNRS (UMR 8104), Paris Inserm, U1016, Paris, France |
Le séquençage du génome humain, au début des années 2000, a révélé que notre patrimoine génétique comprenait moins de 40 000 gènes (20-25 000 gènes codant pour des protéines selon des estimations plus récentes [
1]) alors que les cellules vivantes sont des systèmes sophistiqués comprenant un nombre très important d’activités biologiques complexes. Cette grande diversité des activités cellulaires, surprenante au regard du faible nombre de gènes qui codent pour les protéines, peut en partie s’expliquer par les nombreuses modifications post-traductionnelles (phosphorylation, glycosylation, sumoylation, acétylation, ubiquitinylation, nitrosylation, palmitoylation, farnésylation, méthylation, ADP-ribosylation, hydroxylation, oxydation, etc.) qui augmentent de façon importante les potentialités fonctionnelles des protéines. Ces modifications contrôlent en particulier leur localisation dans différents compartiments cellulaires et leur interaction avec différents partenaires au sein d’assemblages multimoléculaires, permettant la mise en place de réseaux de signalisation complexes. Les phosphorylations et glycosylations constituent les modifications post-traductionnelles les plus abondantes et les mieux connues. Cependant, alors que les phosphorylations sont généralement considérées comme étant des modifications rapides et réversibles, permettant à la cellule de répondre à divers stimulus et de s’adapter aux variations de son environnement, les glycosylations ont longtemps été considérées comme des modifications stables, impliquant l’ajout de chaînes complexes d’hydrates de carbone, qui généralement restent présentes sur la protéine mature tout au long de son existence. Ces glycosylations complexes, sur des résidus sérine/thréonine (O-glycosylations) ou asparagine (N-glycosylations), ne se rencontrent que dans certains compartiments cellulaires (réticulum endoplasmique, appareil de Golgi, face externe de la membrane plasmique) et concernent essentiellement les protéines membranaires ou sécrétées. Cependant, en 1984, en étudiant la distribution des résidus N-Acétylglucosamine terminaux à la surface des lymphocytes T, G. W. Hart [
2] a découvert un type de glycosylation original, la O-N-Acétylglucosaminylation (O-GlcNAcylation), qui consiste en l’addition d’un monosaccharide, la N-acétyl-glucosamine, sur le groupement hydroxyl d’acides aminés sérine ou thréonine (Figure 1). Il s’est ensuite rendu compte que, contrairement aux glycosylations « classiques », cette modification était observée essentiellement dans le cytoplasme et le noyau de la cellule [
3,
4].  | Figure 1
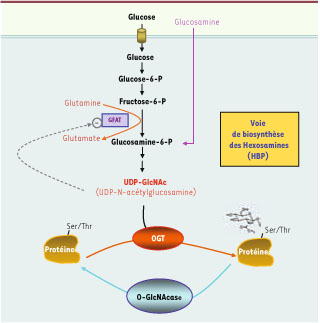
Voie de biosynthèse des hexosamines. Deux à 3 % du glucose entrant dans la cellule est dirigé vers la voie de biosynthèse des hexosamines (HBP). Cette voie, qui débute avec la synthèse de glucosamine 6-P à partir de fructose 6-P et de glutamine, conduit à la production d’UDP-GlcNAc (uridine 5-diphospho N-acétylglucosamine), substrat utilisé par l’OGT pour réaliser la O-GlcNAcylation des protéines cytosoliques ou nucléaires. L’UDP-GlcNAc est également le donneur de GlcNAc pour d’autres types de glycosylations non figurés sur ce schéma (glycosylations classiques dans le réticulum endoplasmique et le Golgi, glycolipides, etc.). L’étape limitante de la voie HBP est celle catalysée par la GFAT (glutamine fructose-6-phosphate amidotransférase) qui utilise la glutamine pour convertir le fructose-6 phosphate en glucosamine-6 phosphate. L’UDP-GlcNAc est un inhibiteur allostérique de la GFAT, permettant un rétrocontrôle négatif de la voie HBP. |
Il est alors rapidement apparu que la O-GlcNAcylation des protéines cytosoliques ou nucléaires était une modification dynamique, dont le turn-over était beaucoup plus élevé que celui de la protéine ellemême [
5]. De fait, on sait maintenant que la O-GlcNAcylation est une modification réversible qui, de façon analogue à la phosphorylation, contrôle l’activité des protéines et les interactions entre protéines au sein d’assemblages moléculaires [
6]. Cependant, contrairement aux phosphorylations/déphosphorylations qui sont régulées par une myriade de kinases et phosphatases, deux enzymes seulement, l’OGT (O-linked N-acetyl-glucosaminyltransferase) et la N-Acétyl-β-D glucosaminidase (O-GlcNAcase ou OGA), dont les gènes ont été clonés respectivement en 1997 [
7,
8] et 2001 [
9], contrôlent le niveau de O-GlcNAcylation des protéines (Figure 1).
Bien que cette modification soit connue depuis maintenant un quart de siècle, la communauté scientifique commence tout juste à prendre conscience de son importance dans la plupart des processus biologiques. Le rôle fondamental de cette modification, que l’on retrouve chez pratiquement tous les êtres vivants (animaux, végétaux, bactéries, champignons, etc.), est probablement lié au fait qu’elle pourrait constituer un mécanisme ancestral de régulation de l’activité des protéines en fonction de l’environnement énergétique de la cellule. En effet, le glucose est l’un des substrats énergétiques les plus largement utilisés par les êtres vivants. Une fraction (2-3 %) du glucose entrant dans la cellule est converti en UDP-N-Acétyl-glucosamine (UDP-GlcNAc) par la voie de biosynthèse des hexosamines [
10]. Le niveau d’UDP-GlcNAc dans la cellule reflète donc le flux de glucose à travers cette voie. L’UDP-GlcNAc est le substrat de l’OGT, qui peut donc être considérée comme un « senseur métabolique du glucose », capable de modifier les protéines en fonction de changements de disponibilité en glucose (Figure 1). L’UDP-GlcNAc se trouve en outre au carrefour de plusieurs voies métaboliques (métabolisme du glucose, des acides gras - fonction acétyl -, des acides aminés - fonction amine - et des bases azotées - uridine -) et pourrait de ce fait constituer un intégrateur de l’état nutritionnel général de la cellule (Figure 2). 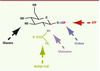 | Figure 2
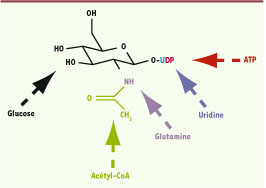
L’UDP-GlcNAc : un « senseur » de l’état nutritionnel. L’activité de l’OGT dépend de la concentration intracellulaire d’UDP-GlcNAc qui peut être considéré comme un intégrateur de l’environnement nutritionnel de la cellule. En effet, la concentration d’UDP-GlcNAc dépend du flux de glucose dans la voie HBP, mais aussi de la disponibilité en acétyl-CoA (produit dans le cycle de Krebs ou par oxydation des acides gras), ainsi que de la disponibilité en glutamine, en uridine et en ATP. |
|
La O-GlcNAcylation modifie l’activité des protéines De nombreux travaux ont montré que les O-GlcNAcylations régulent les fonctions cellulaires en modulant la stabilité des protéines, leur activité enzymatique, leur localisation subcellulaire et leurs interactions avec différents partenaires protéiques [6,
11,
12]. Ainsi, la O-GlcNAcylation de certains facteurs de transcription peut conduire à une augmentation de leur stabilité [
13,
14], à leur relocalisation dans le noyau [
15,
16], ou à une augmentation de leur activité transcriptionnelle [
17,
18]. En outre, un raffinement supplémentaire dans les possibilités de régulation des protéines est introduit par le fait qu’un même résidu sérine ou thréonine peut être soit O-GlcNAcylé, soit phosphorylé, les deux modifications étant mutuellement exclusives (phénomène de Yin-Yang). Ainsi, la O-GlcNAcylation de l’enzyme eNOS (endothelial nitric oxide synthase) sur le résidu phosphorylé par Akt en réponse aux facteurs de croissance empêche sa phosphorylation et donc son activation [
19,
20]. L’OGT a d’ailleurs été retrouvée dans des complexes protéiques, associée à la protéine phosphatase PP1 (isoformes β et γ), suggérant une action coordonnée dans laquelle une déphosphorylation préalable de la protéine substrat par la PP1 permettrait ensuite sa O-GlcNAcylation sur les sites déphosphorylés [
21]. |
O-GlcNAcylation et pathologies humaines L’importance biologique de cette modification post-traductionnelle est soulignée par le fait que des anomalies de la O-GlcNAcylation des protéines ont été impliquées dans un certain nombre de pathologies humaines [11]. De telles anomalies semblent jouer un rôle particulièrement important dans un grand nombre de complications diabétiques [11, 12,
22]. Le gène codant pour l’enzyme O-GlcNAcase a d’ailleurs été montré comme étant un locus de susceptibilité pour le diabète de type 2 dans une population d’Américains d’origine mexicaine [
23]. La O-GlcNAcylation pourrait par ailleurs jouer un rôle important dans les maladies neurodégénératives [
24]. Le gène codant pour l’OGT est un candidat dans la dystonie parkinsonienne liée à l’X, alors que le gène codant pour l’O-GlcNAcase se trouve proche d’une région candidate dans la maladie d’Alzheimer. Des défauts de O-GlcNAcylation semblent contribuer à la toxicité de certaines protéines observée dans les maladies neurodégénératives. Ainsi, dans la maladie d’Alzheimer, un défaut de O-GlcNAcylation de la protéine Tau, probablement dû à la diminution d’utilisation du glucose dans le cerveau des personnes âgées, semble contribuer à l’hyperphosphorylation de cette protéine, conduisant ainsi aux dysfonctionnements qui aboutissent au développement de la maladie neurodégénérative. Une relation réciproque, de type Yin-Yang, a en effet été décrite [
25], la O-GlcNAcylation de la protéine Tau ayant un effet protecteur, en réduisant sa phosphorylation sur de nombreux résidus [
26]. Enfin, dans la mesure où plusieurs oncogènes et suppresseurs de tumeur sont modifiés par O-GlcNAcylation, un rôle dans les processus cancéreux semble également assez probable [6, 17]. L’implication des O-GlcNAcylations dans des pathologies aussi diverses est probablement liée au fait que ces modifications peuvent réguler un nombre important de voies de signalisation. L’analogie entre O-GlcNAcylations et phosphorylations est très frappante. Il faut cependant garder à l’esprit que contrairement aux phosphorylations, les O-GlcNAcylations, qui ne sont réalisées que par une seule enzyme (l’OGT), ne peuvent s’organiser en cascades de signalisation, dans lesquelles une protéine O-GlcNAcylée irait à son tour transmettre un signal en O-GlcNAcylant une autre protéine (comme c’est le cas pour les cascades de phosphorylations impliquant les protéines kinase s). Il semblerait plutôt qu’il faille considérer la O-GlcNAcylation comme un mécanisme de régulation transversal, une sorte de « rhéostat » qui contrôlerait, en fonction de l’état nutritionnel de la cellule, l’intensité du signal passant à travers différentes voies de signalisation. Nous illustrerons notre propos, dans le paragraphe suivant, en présentant certains aspects de la régulation de la voie de signalisation de l’insuline par les O-GlcNAcylations. |
O-GlcNAcylation et signalisation de l’insuline La résistance à l’insuline, que l’on définit comme une diminution de l’efficacité de l’action de l’insuline sur ses tissus cibles, est une caractéristique majeure de maladies comme le diabète de type 2 et l’obésité. On sait depuis de nombreuses années que l’hyperglycémie chronique a, par elle-même, des effets délétères sur la sensibilité à l’insuline [12]. L’implication de la voie de biosynthèse des hexosamines dans la résistance à l’insuline induite par le glucose avait été proposée dès 1991 par Marshall et al. qui avaient observé qu’une diminution de sensibilité à l’insuline dans les adipocytes primaires pouvait être obtenue par la présence concomitante, dans le milieu de culture, de glutamine, de fortes concentrations de glucose et d’insuline. L’effet de ces agents était inhibé par des drogues agissant sur la GFAT (glutamine : fructose-6-phosphate aminotransférase) (Figure 1), enzyme limitante de la voie de biosynthèse des hexosamines. En outre, la glucosamine, qui entre dans la voie HBP (hexosamine biosynthetic pathway) en aval de la GFAT (Figure 1) était, à elle seule, beaucoup plus efficace que les trois agents réunis pour induire l’insulinorésistance [10]. Ces résultats ont permis aux auteurs de proposer que la voie HBP joue un rôle important dans la résistance à l’insuline, alors que les mécanismes moléculaires sous-jacents n’étaient pas encore connus [10]. Des modèles de souris transgéniques, réalisés par McClain et al. [
27,
28], surexprimant dans différents tissus la GFAT ou l’OGT, ont permis de confirmer le fait qu’une suractivation de la voie dans le muscle, le tissu adipeux, le foie ou la cellule β du pancréas conduisait à des phénotypes similaires à ceux observés dans le diabète de type 2 et l’obésité (Figure 3). Ces observations ont tout naturellement conduit à l’étude de la O-GlcNAcylation potentielle des protéines impliquées dans la signalisation de l’insuline.  | Figure 3 Surexpression de la GFAT ou de l’OGT dans des modèles de souris transgéniques. Différents modèles de souris transgéniques ont permis de montrer qu’une augmentation de l’expression des enzymes-clés impliquées dans la O-GlcNAcylation des protéines conduit à des altérations du métabolisme énergétique similaires à celles observées chez les patients obèses ou diabétiques, suggérant un rôle important de cette voie dans ces pathologies. GFAT : glutamine-fructose-6-phosphate aminotransférase ; PEPCK : phosphoénolpyruvate carboxykinase. |
La liaison de l’insuline à son récepteur stimule son activité tyrosine kinase envers des substrats intracellulaires comme IRS1 (insulin receptor substrate 1) ou Shc, qui vont alors activer des voies de signalisation impliquées dans les effets métaboliques et mitogéniques de l’insuline [
29]. Il est apparu que de nombreux acteurs de la signalisation de l’insuline, allant de la membrane cellulaire au noyau, pouvaient être O-GlcNAcylés (Figure 4). De fait, la sous-unité β intracellulaire du récepteur de l’insuline, les protéines IRS 1 et 2, les sous-unités p85 et p110 de la PI-3 kinase, la PDK-1 (3-phosphoinositide-dependent kinase-1), la protéine kinase PKB/Akt, la Gsk3 (glycogen synthase kinase 3), et le facteur de transcription FoxO1 (forkhead box O1) sont des cibles de l’OGT et, dans la plupart des cas, ces O-GlcNAcylations ont des effets opposés à ceux qu’induit l’insuline [11]. 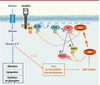 | Figure 4
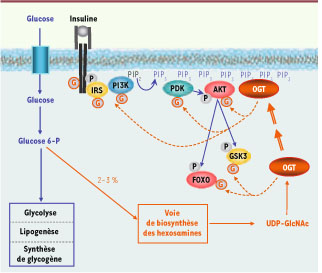
Rétrocontrôle négatif de la signalisation de l’insuline par l’OGT. L’insuline, en activant la voie PI-3 kinase/Akt, stimule l’entrée de glucose dans la cellule. Une fraction de ce glucose, entrant dans la voie HBP, va permettre la synthèse d’UDP-GlcNAc, substrat de l’OGT. L’OGT, qui possède des séquences de reconnaissance des PIP3 membranaires, est en partie relocalisée à la membrane suite à l’activation de la PI-3 kinase par l’insuline. Elle pourra alors O-GlcNAcyler les éléments proximaux de la signalisation de l’insuline, conduisant à une atténuation du signal. Dans les situations d’hyperglycémie chronique (résistance à l’insuline) et/ou lorsque les apports alimentaires sont trop élevés (sociétés occidentales), l’excès de glucose (et d’autres nutriments) pourrait alors favoriser la synthèse d’UDP-GlcNAc, aboutissant à une O-GlcNAcylation anormale des protéines de la signalisation et à une détérioration de la sensibilité à l’insuline. OGT : O-linked N-acetyl-glucosaminyltransferase ; IRS : insulin response substrate. |
Une étude récente a jeté un éclairage nouveau sur le mécanisme par lequel l’OGT est adressée à la membrane plasmique, à proximité des protéines impliquées dans les évènements précoces de la signalisation de l’insuline [
30]. À l’état de repos, l’OGT à une localisation essentiellement cytosolique et nucléaire. Sous l’action de l’insuline, la production membranaire de phosphatidyl-inositol 3-phosphate (PIP3) par la PI-3 kinase permet de recruter l’OGT à la membrane plasmique par l’intermédiaire d’un domaine particulier dénommé PPO (PIP-binding domain of OGT), situé dans la partie carboxy-terminale de la protéine. Le recrutement de l’OGT à la membrane va alors favoriser la O-GlcNAcylation des protéines intervenant dans la voie de la signalisation de l’insuline, conduisant ainsi à une atténuation du signal (Figure 4). Ce rétrocontrôle négatif pourrait être exacerbé dans les situations où la cellule baigne dans un environnement cellulaire anormalement riche en glucose, du fait de l’hyperglycémie chronique observée chez les patients obèses ou diabétiques. Ceci entraînerait une diminution de l’efficacité de la signalisation de l’insuline, conduisant à une résistance cellulaire à l’insuline et à la mise en place d’un cercle vicieux dans lequel l’hyperglycémie entraînerait une aggravation de l’hyperglycémie (glucotoxicité) [12, 22]. |
O-GlcNAcylation des protéines par l’OGT : quelle spécificité ? L’une des difficultés dans la compréhension des mécanismes de la régulation des activités cellulaires par O-GlcNAcylation est liée à la spécificité d’action de l’OGT. Dans la mesure où une seule enzyme assure la O-GlcNAcylation d’un très grand nombre de protéines (plus de 600 identifiées à ce jour), il est difficile de comprendre par quel mécanisme est assuré le contrôle de la spécificité d’action de l’OGT vis-à-vis de différents substrats en fonction de différents stimulus. Variations de concentrations d’UDP-GlcNAc Il faut tout d’abord noter que les changements intracellulaires de concentration en UDP-GlcNAc pourraient participer à la régulation de la spécificité de l’OGT vis-à-vis de différents substrats. En effet, il a été montré que l’OGT possède trois constantes de liaison différentes pour l’UDP-GlcNAc [
31], suggérant que la concentration d’UDP-GlcNAc peut directement moduler l’activité de l’enzyme (Km de l’OGT pour l’UDP-GlcNAc de 6, 35 et 217 μm lorsqu’un peptide dérivé de la caséine kinase 2 est utilisé comme substrat). Ainsi, certaines protéines pourraient être des substrats de l’enzyme à faible concentration d’UDP-GlcNAc alors que d’autres protéines ne seraient modifiées par l’enzyme que lorsque le niveau d’UDP-GlcNAc atteint un certain seuil dans la cellule. Il s’agit donc là d’un mécanisme à la fois simple et efficace par lequel l’OGT pourrait affecter, selon l’environnement nutritionnel de la cellule, l’activité de certaines protéines plutôt que d’autres. Isoformes de l’OGT Un certain niveau de spécificité pourrait aussi être lié à l’existence de trois isoformes de l’OGT, générées par épissage alternatif de son ARN messager. En effet, outre la forme longue nucléocytoplasmique de l’OGT (ncOGT, de poids moléculaire 116 kDa), constituée d’un domaine catalytique en carboxy-terminal et de 12 domaines TPR (tetra-tricopeptide repeats) en amino-terminal, deux autres isoformes, qui diffèrent par leur région amino-terminale, ont été mises en évidence : une forme mitochondriale (mOGT, de poids moléculaire 103 kDa, comprenant en amino-terminal une séquence d’adressage à la mitochondrie suivie de 9 TPR) et une forme courte (sOGT, de poids moléculaire 78 kDa, comprenant seulement 3 TPR en amino-terminal et ayant une localisation cellulaire similaire à celle de la forme ncOGT) [ 28,
32]. Les domaines TPR sont considérés comme étant importants pour les interactions protéine-protéine et pourraient donc constituer un élément clé dans la régulation de la spécificité de l’OGT vis-à-vis de différents substrats. Ainsi, la délétion des trois premiers TPR de ncOGT n’a pas d’effet sur son activité vis-à-vis de peptides substrats, mais inhibe totalement son activité vis-à-vis de certaines protéines comme la caséine kinase II et la nucléoporine p62 [
33]. En outre, l’adressage spécifique de mOGT à la mitochondrie permet également de cibler plus spécifiquement un groupe particulier de substrats [32,
34]. Par ailleurs, des changements de localisation cellulaire de la forme nucléocytoplasmique de l’OGT, induits par les ligands hormonaux, permettent de diriger l’OGT vers certains substrats spécifiques. Ainsi, comme nous l’avons souligné précédemment, la production de PIP3 membranaire constitue un mécanisme par lequel l’OGT est spécifiquement adressée vers un certain sous-groupe de substrats cellulaires lors de l’activation d’une voie de signalisation donnée (Figure 4). Des partenaires spécifiques pour les différents substrats d’OGT L’association spécifique de l’OGT avec différents partenaires d’interaction constitue également un des mécanismes par lesquels l’OGT est adressée vers certains substrats. Ainsi, l’association de l’OGT à la protéine TRAK1 (trafficking protein kinesis binding 1) permettrait son adressage à l’ARN polymérase II, suggérant un mécanisme potentiel de régulation de la transcription [
35]. De même, dans les cellules neuroblastiques Neuro-2a, l’association de l’OGT à la p38 MAPkinase permet d’adresser l’OGT à la protéine de neurofilament NF-H, conduisant à sa O-GlcNAcylation et à sa dépolymérisation [
36]. De nombreux autres partenaires potentiels de l’OGT ont été identifiés par double-hybride dans la levure et pourraient également jouer un rôle dans l’adressage de l’OGT à différents substrats [
37]. Ainsi, les auteurs ont montré que deux de ces partenaires, MYPT1 (myosin phosphatase targeting subunit 1) et CARM1 (co-activator-associated arginine methyltransferase 1), augmentent fortement l’efficacité de l’OGT vis-à-vis de certaines protéines cellulaires [ 37]. Modifications post-traductionnelles de l’OGT Enfin, l’OGT est elle-même régulée par modification post-traductionnelle. Ainsi est-elle capable de s’autoGlcNAcyler, bien que les conséquences de cette modification ne soient pas encore élucidées [ 8, 33]. L’OGT est également régulée par phosphorylation. Sa phosphorylation par la sérine-thréonine kinase CaMKIV (calcium/calmodulin-dependant protein kinase IV) augmente son activité dans les cellules neuronales NG10815 [
38]. En outre, l’OGT est phosphorylée sur tyrosine en réponse à l’insuline dans les adipocytes 3T3L1, et ceci conduit également à une augmentation de son activité enzymatique [
39]. Ainsi, la combinaison de ces différents modes de régulation de l’OGT (changements de concentration en substrat UDP-GlcNAc, adressage de l’OGT dans différents compartiments cellulaires, relocalisation induite par les PIP3 membranaires, interaction avec des protéines permettant l’adressage vers certains substrats, modifications post-traductionnelles de l’OGT) doivent contribuer à établir, selon les conditions dans lesquelles se trouve la cellule à un moment donné, une spécificité d’action dont la complexité nous échappe encore largement. |
La présence de groupements phosphates sur les protéines est connue depuis le début du XXe siècle [
40]. Cependant, ce n’est que vers le milieu des années 1950, avec en particulier les travaux pionniers de E. G. Krebs et E. H. Fsher sur la régulation, par phosphorylation, de l’activité d’une enzyme du métabolisme (la glycogen phosphorylase), que l’on commença à prendre conscience de l’importance de cette modification post-traductionnelle (Krebs et Fisher obtinrent, en 1992, le prix Nobel de physiologie/médecine pour leurs découvertes concernant la phosphorylation réversible des protéines comme mode de régulation biologique [
41]). Il apparaît clairement maintenant que la O-GlcNAcylation des protéines joue un rôle fondamental dans de nombreux aspects de la vie de la cellule. Cette modification, découverte beaucoup plus récemment, semble tout aussi importante que la phosphorylation dans les régulations biologiques. L’explosion de ce domaine de recherche ces dernières années laisse en effet entrevoir d’importants bouleversements dans notre conception des mécanismes de régulation des signaux intracellulaires. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Notre travail est soutenu par l’Alfediam-SFD (Société francophone du diabète), l’ANR (ANR Genopath 2008 « DIAB-O-GLYC »), l’Association pour la recherche sur le cancer (ARC-subvention 1069) et la Région Île-de-France.
|
1. Collins FS, Guyer M, Peterson J, et al. Finishing the euchromatic sequence of the human genome. Nature 2004 ; 431 : 931-45. 2. Torres CR, Hart GW. Topography and polypeptide distribution of terminal N-acetylglucosamine residues on the surfaces of intact lymphocytes. Evidence for O-linked GlcNAc. J Biol Chem 1984 ; 259 : 3308-17. 3. Holt GD, Hart GW. The subcellular distribution of terminal N-acetylglucosamine moieties. Localization of a novel protein-saccharide linkage, O-linked GlcNAc. J Biol Chem 1986 ; 261 : 8049-57. 4. Schindler M, Hogan M, Miller R, et al. A nuclear specific glycoprotein representative of a unique pattern of glycosylation. J Biol Chem 1987 ; 262 : 1254-60. 5. Haltiwanger RS, Kelly WG, Roquemore EP, et al. Glycosylation of nuclear and cytoplasmic proteins is ubiquitous and dynamic. Biochem Soc Trans 1992 ; 20 : 264-9. 6. Hanover JA. Glycan-dependent signaling: O-linked N-acetylglucosamine. FASEBJ 2001 ; 15 : 1865-76. 7. Lubas WA, Frank DW, Krause M, et al. O-Linked GlcNAc transferase is a conserved nucleocytoplasmic protein containing tetratricopeptide repeats. J Biol Chem 1997 ; 272 : 9316-24. 8. Kreppel LK, Blomberg MA, Hart GW. Dynamic glycosylation of nuclear and cytosolic proteins. Cloning and characterization of a unique O-GlcNAc transferase with multiple tetratricopeptide repeats. J Biol Chem 1997 ; 272 : 9308-15. 9. Gao Y, Wells L, Comer FI, et al. Dynamic O-glycosylation of nuclear and cytosolic proteins: cloning and characterization of a neutral, cytosolic beta-N-acetylglucosaminidase from human brain. J Biol Chem 2001 ; 276 : 9838-45. 10. Marshall S, Bacote V, Traxinger RR. Discovery of a metabolic pathway mediating glucose-induced desensitization of the glucose transport system. Role of hexosamine biosynthesis in the induction of insulin resistance. J Biol Chem 1991 ; 266 : 4706-12. 11. Lefebvre T, Dehennaut V, Guinez C, et al. Dysregulation of the nutrient/stress sensor O-GlcNAcylation is involved in the etiology of cardiovascular disorders, type-2 diabetes and Alzheimer’s disease. Biochim Biophys Acta 2009 ; 1800 : 67-79. 12. Issad T, Kuo M. O-GlcNAc modification of transcription factors, glucose sensing and glucotoxicity. Trends Endocrinol Metab 2008 ; 19 : 380-9. 13. Yang WH, Kim JE, Nam HW, et al. Modification of p53 with O-linked N-acetylglucosamine regulates p53 activity and stability. Nat Cell Biol 2006 ; 8 : 1074-83. 14. Cheng X, Hart GW. Alternative O-glycosylation/O-phosphorylation of serine-16 in murine estrogen receptor beta: post-translational regulation of turnover and transactivation activity. J Biol Chem 2001 : 276 : 10570-5. 15. Andrali SS, Qian Q, Ozcan S. Glucose mediates the translocation of NeuroD1 by O-linked glycosylation. J Biol Chem 2007 ; 282 : 15589-96. 16. Dentin R, Hedrick S, Xie J, et al. Hepatic glucose sensing via the CREB coactivator CRTC2. Science 2008 ; 319 : 1402-5. 17. Kuo M, Zilberfarb V, Gangneux N, et al. Un nouveau mode de régulation de FoxO1 par O-glycosylation : implication dans le phénomène de glucotoxicité. Med Sci (Paris) 2008 ; 24 : 369-71. 18. Kuo M, Zilberfarb V, Gangneux N, et al. O-glycosylation of FoxO1 increases its transcriptional activity towards the glucose 6-phosphatase gene. FEBS Lett 2008 ; 582 : 829-34. 19. Du XL, Edelstein D, Dimmeler S, et al. Hyperglycemia inhibits endothelial nitric oxide synthase activity by posttranslational modification at the Akt site. J Clin Invest 2001 ; 108 : 1341-8. 20. Musicki B, Kramer MF, Becker RE, et al. Inactivation of phosphorylated endothelial nitric oxide synthase (Ser-1177) by O-GlcNAc in diabetes-associated erectile dysfunction. Proc Natl Acad Sci USA 2005 ; 102 : 11870-5. 21. Wells L, Kreppel LK, Comer FI, et al. O-GlcNAc transferase is in a functional complex with protein phosphatase 1 catalytic subunits. J Biol Chem 2004 ; 279 : 38466-70. 22. Kuo M, Zilberfarb V, Gangneux N, et al. O-GlcNAc modification of FoxO1 increases its transcriptional activity: a role in the glucotoxicity phenomenon? Biochimie 2008 : 90 : 679-85. 23. Lehman DM, Fu DJ, Freeman AB, et al. A single nucleotide polymorphism in MGEA5 encoding O-GlcNAc-selective N-acetyl-beta-D glucosaminidase is associated with type 2 diabetes in Mexican Americans. Diabetes 2005 ; 54 : 1214-21. 24. Lefebvre T, Guinez C, Dehennaut V, et al. Does O-GlcNAc play a role in neurodegenerative diseases? Exp RevProteomics 2005 ; 2 : 265-75. 25. Lefebvre T, Ferreira S, Dupont-Wallois L, et al. Evidence of a balance between phosphorylation and O-GlcNAc glycosylation of Tau proteins--a role in nuclear localization. Biochim Biophys Acta 2003 ; 1619 : 167-76. 26. Liu F, Shi J, Tanimukai H, et al. Reduced O-GlcNAcylation links lower brain glucose metabolism and tau pathology in Alzheimer’s disease. Brain 2009 ; 132 : 1820-32. 27. Cooksey RC, McClain DA. Transgenic mice overexpressing the rate-limiting enzyme for hexosamine synthesis in skeletal muscle or adipose tissue exhibit total body insulin resistance. Ann NY Acad Sci 2002 ; 967 : 102-11. 28. Love DC, Hanover JA. The hexosamine signaling pathway: deciphering the O-GlcNAc code. SciSTKE 2005 ; 312 : re13. 29. Combettes-Souverain M, Issad T. Molecular basis of insulin action. Diabetes Metab 1998 ; 24 : 477-89. 30. Yang X, Ongusaha PP, Miles PD, et al. Phosphoinositide signalling links O-GlcNAc transferase to insulin resistance. Nature 2008 ; 451 : 964-9. 31. Kreppel LK, Hart GW. Regulation of a cytosolic and nuclear O-GlcNAc transferase. Role of the tetratricopeptide repeats. J Biol Chem 1999 ; 274 : 32015-22. 32. Hanover JA, Yu S, Lubas WB, et al. Mitochondrial and nucleocytoplasmic isoforms of O-linked GlcNAc transferase encoded by a single mammalian gene. Arch Biochem Biophys 2003 ; 409 : 287-97. 33. Lubas WA, Hanover JA. Functional expression of O-linked GlcNAc transferase. Domain structure and substrate specificity. J Biol Chem 2000 ; 275: 10983-8. 34. Hu Y, Suarez J, Fricovsky E, et al. Increased enzymatic O-GlcNAcylation of mitochondrial proteins impairs mitochondrial function in cardiac myocytes exposed to high glucose. J Biol Chem 2009 ; 284 : 547-55. 35. Iyer SP, Akimoto Y, Hart GW. Identification and cloning of a novel family of coiled-coil domain proteins that interact with O-GlcNAc transferase. J Biol Chem 2003 ; 278 : 5399-409. 36. Cheung WD, Hart GW. AMP-activated protein kinase and p38 MAPK activate O-GlcNAcylation of neuronal proteins during glucose deprivation. J Biol Chem 2008 ; 283 : 13009-20. 37. Cheung WD, Sakabe K, Housley MP, et al. O-linked beta-N-acetylglucosaminyltransferase substrate specificity is regulated by myosin phosphatase targeting and other interacting proteins. J Biol Chem 2008 ; 283 : 33935-41. 38. Song M, Kim HS, Park JM, et al. o-GlcNAc transferase is activated by CaMKIV-dependent phosphorylation under potassium chloride-induced depolarization in NG-108-15 cells. Cell Signal 2008 ; 20 : 94-104. 39. Whelan SA, Lane MD, Hart GW. Regulation of the O-linked beta-N-acetylglucosamine transferase by insulin signaling. J Biol Chem 2008 ; 283 : 21411-7. 40. Plimmer RH, Bayliss WM. The separation of phosphorus from caseinogen by the action of enzymes and alkali. J Physiol 1906 ; 33 : 439-61. 41. Krebs EG. Nobel Lecture. Protein phosphorylation and cellular regulation I. Biosci Rep 1993 ; 13 : 127-42. |