| |
| Med Sci (Paris). 2010 October; 26(10): 797–800. Published online 2010 October 15. doi: 10.1051/medsci/20102610797.Identification d’une nouvelle population de cellules souches musculaires Alice Pannérec1* and David Sassoon1* 1Groupe myologie, UMR S 787 Inserm, Université Pierre et Marie Curie Paris VI, 105, boulevard de l’Hôpital, 75634 Paris Cedex 13, France MeSH keywords: Animaux, Protéines de liaison à l'ADN, génétique, Facteurs de transcription Krüppel-like, Souris, Muscles squelettiques, cytologie, physiologie, Myoblastes, Régénération, Cellules souches |
Chez l’adulte, le muscle strié squelettique est composé de fibres musculaires. Ces fibres ne sont pas capables de proliférer, mais le muscle peut être régénéré grâce aux cellules souches. Les cellules satellites sont définies comme étant les cellules souches du muscle adulte puisqu’elles sont capables d’une part de se différencier en fibres musculaires permettant la régénération du muscle, et d’autre part de s’autorenouveler pour reconstituer leur niche. Les cellules satellites sont localisées entre la lame basale et la membrane plasmique des fibres, et expriment des gènes spécifiques tels que celui codant pour le facteur de transcription Pax7 ou celui codant pour la M-cadhérine [
1,
2]. Lorsque le muscle subit des lésions (blessure, exercice physique ou vieillissement), les cellules souches sont activées, prolifèrent et se différencient pour former de nouvelles fibres. Chez les patients atteints de myopathies, ce processus de réparation est très affecté et l’on observe une atrophie musculaire qui est due à l’incapacité des cellules souches à régénérer correctement le muscle. Dans les années 1990, la greffe des cellules souches fonctionnelles, en l’occurrence des cellules satellites, était envisagée pour la régénération musculaire. Des essais thérapeutiques ont été réalisés, mais les résultats n’étaient pas satisfaisants puisque la majeure partie des cellules greffées mouraient et que les autres restaient près du site d’injection [
3]. Depuis, d’autres populations cellulaires douées de potentiel myogénique ont été découvertes : certaines cellules hématopoïétiques, des cellules dérivées des vaisseaux sanguins (les mésoangioblastes) ou des populations présentes au sein du muscle telles que les cellules SP (side population)1 ou exprimant l’antigène CD133 [
4–
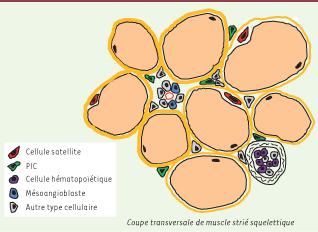
7] (Figure 1). À l’exception des mésoangioblastes dont le potentiel thérapeutique est actuellement en cours d’essais cliniques, le faible nombre de ces précurseurs musculaires et la difficulté de leur obtention soulèvent des difficultés considérables pour une utilisation thérapeutique. L’amélioration des connaissances sur les cellules souches musculaires est donc primordiale pour les progrès dans le domaine des thérapies des myopathies.  | Figure 1
Les progéniteurs musculaires. Il existe plusieurs populations de cellules souches musculaires dans le muscle strié squelettique adulte. Les plus connues et les mieux caractérisées sont les cellules satellites, situées entre la lame basale et la membrane plasmique des fibres musculaires. Mais certaines cellules hématopoïétiques, issues de la moelle osseuse, ainsi que les mésoangioblastes associés aux vaisseaux sanguins, sont également capables de régénérer le muscle. Récemment, nous avons identifié une sous-population de cellules interstitielles, les PIC (PW1
+
interstitial cells), représentant de nouveaux progéniteurs musculaires. |
|
Les PIC, des cellules musculaires dont le potentiel myogénique dépend de Pax7 De précédentes études de notre laboratoire nous ont amenés à considérer le gène PW1 comme un marqueur précoce de la voie musculaire [
8]. Dans le muscle strié squelettique, nous avons remarqué que PW1 (qui code pour une protéine à doigts de zinc) est exprimé non seulement par les cellules satellites, mais également par une sous-catégorie de cellules interstitielles appelées PIC (PW1
+
interstitial cells) (Figure 1). Cependant, contrairement aux cellules satellites, les PIC n’expriment aucun gène relatif au lignage myogénique. Grâce à une technique de séparation des cellules par cytométrie de flux, les PIC et les cellules satellites du muscle peuvent être isolées séparément ce qui permet d’étudier leurs caractéristiques in vitro. Lorsqu’elles sont placées dans des conditions de culture favorables à la différenciation myogénique, chacune de ces populations active les gènes du lignage myogénique (Pax7, MyoD) puis donne naissance à des myotubes par fusion des cellules entre elles [
9]. Pax7 est un marqueur des cellules satellites, mais son rôle dans la spécification des cellules satellites et des PIC reste mal compris. Chez les souris invalidées pour le gène Pax7 (Pax7
−/−
) le nombre de cellules satellites décroît rapidement après la naissance, et les muscles de ces souris sont extrêmement petits et faibles, conduisant généralement à la mort de l’animal en quelques semaines [2]. À l’inverse, on dénombre deux fois plus de PIC chez ces animaux que chez des souris saines. Alors que les cellules satellites issues d’animaux Pax7
-/-
sont parfaitement myogéniques, les PIC sont incapables de se différencier en myotubes, suggérant que Pax7 est nécessaire à la spécification des PIC dans la voie myogénique lors de la croissance post-natale [9]. Au vu de ces résultats, nous nous sommes demandé si les PIC étaient issues des précurseurs musculaires embryonnaires caractérisés par l’expression des gènes Pax3 et Pax7 comme le sont les cellules satellites. |
Les PIC sont distinctes des cellules satellites et possèdent une grande capacité de régénération Chez les vertébrés, les cellules musculaires squelettiques dérivent d’un tissu embryonnaire nommé mésoderme. Au cours du développement, le mésoderme se sépare en deux régions (la tête et le tronc) puis est segmenté le long du tube neural pour former des structures métamériques appelées somites. À ce niveau, certaines cellules exprimant le facteur de transcription Pax3 migrent progressivement vers les bourgeons des membres où elles forment les premières fibres musculaires embryonnaires. Ces myoblastes (Pax3+) sont également à l’origine des cellules satellites chez l’adulte [
10]. Pour savoir si les PIC sont issues du même lignage que les cellules satellites, il suffit donc de déterminer si elles proviennent de cellules ayant exprimé le gène Pax3. Pour cela, nous avons réalisé des expériences de suivi des lignages cellulaires chez la souris en utilisant des souris génétiquement modifiées (souris Pax3-Cre knock-in croisées avec des souris R26R3-LacZ, exprimant le gène de la β-galactosidase à partir du locus Rosa26) permettant de suivre l’expression du gène Pax3 : chaque cellule ayant exprimé Pax3 à un moment donné exprimera définitivement LacZ (cellule bleue). Ainsi, dans le muscle post-natal de ces animaux, toutes les fibres musculaires et les cellules satellites apparaissent bleues [10]. À l’inverse, il n’y a aucune cellule bleue dans le tissu interstitiel : les PIC n’ont donc jamais exprimé Pax3. Nous concluons que les PIC ne partagent pas la même origine embryonnaire que les cellules satellites et que, par conséquent, elles constituent une nouvelle population myogénique bien distincte des cellules satellites. Ces résultats suggèrent également que les PIC sont capables de générer des cellules satellites dans le muscle post-natal. Après avoir démontré le potentiel myogénique des PIC in vitro, nous l’avons exploré in vivo : nous avons injecté des PIC dans des muscles de souris préalablement blessés et dont la réparation requiert une régénération tissulaire massive (Figure 2). Afin de pouvoir suivre les cellules injectées dans l’animal receveur, nous avons isolé les PIC et les cellules satellites de souris exprimant un gène rapporteur (LacZ). Des PIC ou des cellules satellites ont été injectées dans les muscles détruits, et 2 semaines plus tard - afin de laisser le temps nécessaire à la régénération musculaire -, les animaux ont été sacrifiés. Nous avons alors constaté que les muscles dans lesquels des PIC avaient été greffées contenaient autant de fibres exprimant le gène rapporteur que les muscles greffés avec les cellules satellites. Les PIC ont donc un potentiel myogénique in vivo semblable à celui des cellules satellites. Par ailleurs, elles sont, comme les cellules satellites, capables de reconstituer leur niche (Figure 2). En effet, dans les muscles greffés avec des PIC, nous avons retrouvé des cellules exprimant le gène rapporteur en position interstitielle. Ces cellules expriment également PW1, comme les PIC. Dans ces mêmes muscles, nous avons également trouvé des cellules exprimant le gène rapporteur en position satellite, démontrant que les PIC injectées ont aussi formé des cellules satellites. Il est néanmoins important de préciser que nous n’avons pas trouvé de PIC exprimant le gène rapporteur dans les muscles injectés avec des cellules satellites, démontrant que les cellules satellites ne peuvent pas donner naissance à des PIC in vivo. Ces résultats non seulement démontrent la capacité des PIC à régénérer le muscle, mais ils suggèrent également que les PIC constituent une population de cellules moins déterminées et plus « souches » que les cellules satellites dans la hiérarchie du lignage myogénique (Figure 2).
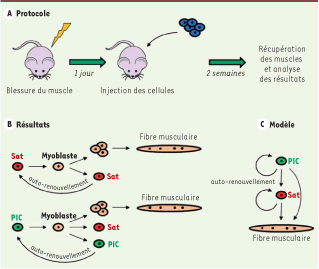
 | Figure 2
Les PIC ont un fort potentiel myogénique in vivo. Afin de tester le potentiel myogénique des PIC, nous avons injecté des cellules exprimant un gène rapporteur (LacZ) dans des souris dont les muscles ont préalablement été blessés (A). Après 2 semaines, période nécessaire à la régénération, l’expression du gène rapporteur a été analysée dans les muscles. Nos résultats démontrent que les PIC ont la même capacité de régénération que les cellules satellites, s’autorenouvellent et sont également capables de former des cellules satellites (B). Ceci suggère que, dans la hiérarchie, les PIC se situent en amont des cellules satellites (C). |
|
Nous avons mis en évidence une nouvelle population de progéniteurs musculaires, les PIC, définis par leur localisation interstitielle et l’expression du gène PW1. Les PIC sont myogéniques in vitro et contribuent de façon importante à la régénération du muscle in vivo, et reconstituent également leur niche. Bien que Pax7 soit nécessaire à la spécification myogénique des PIC, ces dernières ne dérivent pas du même lignage que les cellules satellites et semblent être plus immatures. Les PIC constituent donc de nouveaux candidats pour la thérapie cellulaire des myopathies. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Le travail présenté ici a été réalisé grâce au soutien du NIH (NCI PO1 CA80058-06, sous-projet 3), the Muscular dystrophy asso ciation of America, the European community’s seventh framework programm OPTISTEM (F5-2009-223098), l’Association française contre les myopathies, et une chaire d’excellence accordée à David Sassoon par le ministère de la Recherche. Nous remercions le Dr Rattenbach pour son aide pour la rédaction de cet article.
|
Footnotes |
1. Mauro A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol 1961 ; 9 : 493-5. 2. Seale P, Sabourin LA, Girgis-Gabardo A, et al. Pax7 is required for the specification of myogenic satellite cells. Cell 2000 ; 102 : 777-86. 3. Péault B, Rudnicki M, Torrente Y, et al. Stem and progenitor cells in skeletal muscle development, maintenance and therapy. Mol Ther 2007 ; 5 : 867-77. 4. LaBarge MA, Blau HM. Biological progression from adult bone marrow to mononucleate muscle stem cell to multinucleate muscle fiber in response to injury. Cell 2002 ; 111 : 589-601. 5. De Angelis L, Berghella L, Coletta M, et al. Skeletal myogenic progenitors originating from embryonic dorsal aorta coexpress endothelial and myogenic markers and contribute to postnatal muscle growth and regeneration. J Cell Biol 1999 ; 147 : 869-78. 6. Asakura A, Seale P, Girgis-Gabardo A, Rudnicki MA. Myogenic specification of side population cells in skeletal muscle. J Cell Biol 2002 ; 159 : 123-34. 7. Torrente Y, Belicchi M, Sampaolesi M, et al. Human circulating AC133+ stem cells restore dystrophin expression and ameliorate function in dystrophic skeletal muscle. J Clin Invest 2004 ; 114 : 182-95. 8. Relaix F, Weng X, Marazzi G, et al. Pw1, a novel zinc finger gene implicated in the myogenic and neuronal lineages. Dev Biol 1996 ; 177 : 383-96. 9. Mitchell KJ, Pannérec A, Cadot B, et al. Identification and characterization of a non-satellite cell muscle resident progenitor during postnatal development. Nat Cell Biol 2010 ; 12 : 257-66. 10. Relaix F, Rocancourt D, Mansouri A, Buckingham MA. Pax3/Pax7-dependent population of skeletal muscle progenitor cells. Nature 2005 ; 435 : 948-53. |