| |
| Med Sci (Paris). 2010 October; 26(10): 830–835. Published online 2010 October 15. doi: 10.1051/medsci/20102610830.La dynamique mitochondriale au cours de l’apoptose Céline Castanier and Damien Arnoult* Inserm U1014 et Université Paris-Sud, Hôpital Paul Brousse, bâtiment Lavoisier, 14, avenue Paul Vaillant Couturier, 94807 Villejuif Cedex, France |
Processus apoptotique et mitochondries L’apoptose, une forme de mort cellulaire programmée (MCP), est un programme de suicide cellulaire essentiel pour le développement et l’homéostasie tissulaire des organismes métazoaires. La dérégulation de la MCP (inhibition ou exacerbation) est impliquée dans de nombreuses pathologies comme des maladies neurodégénératives, certains cancers ou le Sida (syndrome d’immunodéficience acquise). La majorité des stimulus pro-apoptotiques est associée à une perméabilisation de la membrane mitochondriale externe (PEMME). Ce processus est régulé par les membres pro- et anti-apoptotiques de la famille Bcl-2 (B-cell lymphoma 2) et conduit à la libération dans le cytosol du cytochrome c qui permet l’activation des caspases (Figure 1), les protéases responsables du phénotype apoptotique [
1]. Néanmoins, les mécanismes par lesquels les membres pro-apoptotiques de la famille Bcl-2 que sont Bax (Bcl2-associated protein X) et Bak induisent la libération du cytochrome c demeurent controversés [
2]. Un modèle suggère que la libération du cytochrome c fait suite à la rupture de la membrane mitochondriale externe en conséquence du gonflement de la matrice mitochondriale après l’ouverture du pore de perméabilité de transition1. Un autre modèle, qui semble se confirmer, propose que Bax et Bak induisent un processus sélectif de PEMME à la suite de la formation de canaux ou pores permettant la libération des protéines solubles, comme le cytochrome c, dans l’espace intermembranaire. Enfin, comme il se produit une fragmentation/fission du réseau mitochondrial [
7] au cours de l’apoptose [
3,
4], ce phénomène a été proposé comme un mécanisme additionnel, alternatif ou complémentaire, dans la voie mitochondriale de l’apoptose [4,
5]. Cette fragmentation du réseau mitochondrial nécessite les effecteurs de la machinerie de fission et fusion mitochondriale [
6, 7] et fait suite soit à une augmentation de la fission, soit à une diminution de la fusion, soit aux deux.  | Figure 1
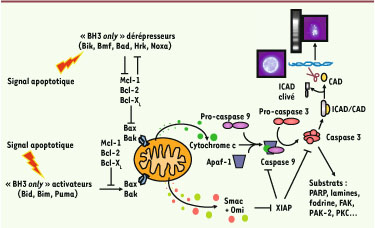
Description schématique de la voie apoptotique. En réponse à un signal apoptotique, on distingue deux cas de figure. Dans le premier, le signal apoptotique active les « BH3-only (Bcl-2 homology 3 only) » dérépresseurs (Bik, Bmf, Bad, Hrk et Noxa), un sous-groupe de la famille Bcl-2, qui neutralisent les protéines anti-apoptotiques que sont Bcl-2, Bc l-XL et Mcl-1 qui maintiennent les protéines pro-apoptotiques Bax et Bak sous une forme inactive. La neutralisation de Bcl-2, Bcl-XL et Mcl-1 par les « BH3-only » dérépresseurs conduit à l’activation de Bax et Bak. Dans le second cas, le signal apoptotique active les « BH3-only » activateurs (Bid, Bim et Puma), lesquels conduisent directement à l’activation de Bax et Bak. La fonction des « BH3-only » activateurs est inhibée par les membres anti-apoptotiques de la famille Bcl-2. Une fois activées, Bax et Bak induisent la déstabilisation de la membrane mitochondriale externe, ce qui aboutit à la libération de cytochrome c. Dans le cytosol, le cytochrome c s’associe à l’adaptateur Apaf-1 (apoptosis protease-activating factor-1), ce qui permet le recrutement puis l’activation de la caspase 9 au sein de ce complexe ternaire nommé « apoptosome ». La caspase 9 active la caspase 3, la principale caspase effectrice qui va cliver différents substrats pour induire le phénotype apoptotique et notamment ICAD, l’inhibiteur de CAD (caspase activated DNAse), une nucléase qui induit une dégradation oligonucléosomale de l’ADN. L’activation des caspases 9 et 3 est inhibée par XIAP (X-linked inhibitor of apoptosis protein) mais pour neutraliser cette inhibition, les protéines Smac et Omi sont colibérées avec le cytochrome c, favorisant alors l’activation des caspases. |
|
La perméabilisation de la membrane mitochondriale externe, libération de cytochrome c et apoptose Fission mitochondriale : cause ou conséquence ? Ce n’est que récemment - moins de dix ans - qu’une fragmentation du réseau mitochondrial a été décrite au cours de l’apoptose [ 3, 4] (Figure 2). Avant de rechercher les causes possibles de cette fragmentation mitochondriale, il faut s’interroger sur sa signification au cours de l’apoptose, et cette question divise la communauté scientifique : ce phénomène est-il simplement une cause de l’apoptose ou bien joue-t-il un rôle plus actif dans ce processus de suicide cellulaire ? Certains chercheurs ont suggéré que la fission mitochondriale permettait la libération du cytochrome c et par conséquent interviendrait dans le contrôle de l’activation des caspases au cours de l’apoptose [ 4, 5]. Cependant, d’autres résultats font de la fission mitochondriale associée à l’apoptose une conséquence plus qu’une cause de l’apoptose : elle ne ferait que traduire une certaine connexion, jusqu’ici non reconnue, entre les membres de la famille Bcl-2, la PEMME et la machinerie de morphogenèse mitochondriale [
8–
10].  | Figure 2
La fragmentation du réseau mitochondrial au cours de l’apoptose. Des cellules HeLa ont été transfectées avec un plasmide permettant l’expression d’une protéine GFP (green fluorescent protein) localisée dans la matrice mitochondriale afin de marquer les mitochondries. Dix-huit heures plus tard, les cellules ont été exposées aux rayonnements ultraviolets pour induire l’apoptose et trois heures plus tard, la morphologie des mitochondries a été observée par fluorescence. |
La fragmentation mitochondriale précède la libération du cytochrome c Indépendamment du rôle fonctionnel de la fission mitochondriale associée à l’apoptose, un consensus existe maintenant pour reconnaître qu’il s’agit d’un phénomène général associé à l’apoptose dans pratiquement tous les types cellulaires et en réponse à la plupart, si ce n’est à tous les stimulus pro-apoptotiques [ 4, 10–
12]. Deux questions importantes demeurent : pourquoi et comment se déroule la fission/fragmentation des mitochondries lors de l’apoptose ? Dans une série d’études pionnières, Youle et ses collaborateurs ont démontré de manière convaincante que l’activation de Bax et/ou de Bak conduit rapidement à la fragmentation mitochondriale [ 4, 12,
13]. De plus, cet événement se déroule dans la même fenêtre de temps que la PEMME [
11]. Il est également important de noter que la forme activée de Bax est fréquemment localisée aux sites de scission des mitochondries lors de l’apoptose, ce qui implique cette protéine dans le processus de fission mitochondriale [ 12]. Argument supplémentaire, la fragmentation mitochondriale associée à l’apoptose se déroule en amont de l’activation des caspases puisque l’inhibition de l’activité des caspases en aval de l’activation de Bax/Bak ne permet pas de bloquer la fragmentation. Enfin, l’expression d’un mutant dominant négatif (le mutant Drp1 K38A) de Drp1 ( dynamin-relatedprotein 1) - une protéine de la machinerie de fission mitochondriale -, mutant qui induit une fusion du réseau mitochondrial mais altère également la fission mitochondriale observée au cours de l’apoptose [ 4], inhibe la libération du cytochrome c et retarde la mort cellulaire en réponse à certains agents pro-apoptotiques [ 4, 5,
14]. L’ensemble de ces données a conduit à l’hypothèse selon laquelle la fragmentation mitochondriale induite par Bax/Bak contribuerait à la PEMME et favoriserait la libération du cytochrome c et d’autres constituants de l’espace mitochondrial intermembranaire que l’on voit au cours de l’apoptose [ 3, 5] (Figure 3A). Dans certaines conditions, il se produit une libération du Ca 2+ stocké dans le réticulum endoplasmique, ce qui conduit à une activation de la fission mitochondriale induite par Drp1. Cette fragmentation mitochondriale précède alors l’activation de Bax et la libération du cytochrome c [
15,
16] (Figure 3B).
 | Figure 3
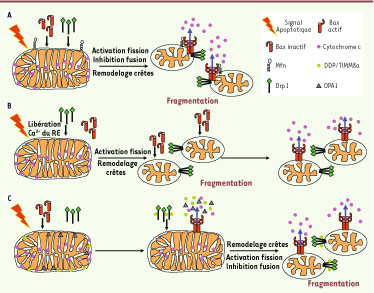
Modèles proposés pour l’induction de la fragmentation et sa relation avec la PEMME, le remodelage des crêtes et la libération du cytochrome c au cours de l’apoptose. A. Le signal apoptotique déclenche la translocation de Bax et de Drpl aux mitochondries. Ensuite, Bax activée participe à l’activation de la fission induite par Drpl et pourrait également inhiber la fusion en interagissant avec Mfn2. Le remodelage des crêtes se produit selon un mécanisme inconnu probablement lié à l’activation de la fission et/ou à l’inhibition de la fusion. Bax activée forme des canaux à travers la membrane mitochondriale externe, induisant la PEMME et la libération du cytochrome c. B. Un signal apoptotique induit la libération du calcium stocké dans le réticulum endoplasmique (RE), induisant la translocation de Drp1 aux mitochondries et l’induction de la fragmentation. Drp1 déclenche alors, via un mécanisme indéterminé, le remodelage des crêtes. Ensuite, se produisent la translocation de Bax, la formation de canaux permettant la PEMME et la libération du cytochrome c. C. Le signal apoptotique déclenche la translocation de Bax. Bax activée forme des canaux qui induisent la PEMME et la libération de protéines solubles localisées dans l’espace intermembranaire comme le cytochrome c, une partie d’OPA1 et DDP/TIMM8a. La libération d’OPA1 déclenche le remodelage des crêtes ce qui permet la libération du cytochrome c restant dans les crêtes ; ce processus est associé à une inhibition de la fusion mitochondriale. En parallèle, une fois dans le cytosol, DDP/TIMM8a se fixe à Drp1, induisant sa translocation aux mitochondries et l’activation de la fission induite par Drp1. Au final, l’inhibition de la fusion mitochondriale et l’activation de la fission induisent de façon synergique une importante fragmentation mitochondriale. |
La fragmentation mitochondriale contribue à la PEMME, mais n’est pas déterminante Il est important de noter que le retard de la libération du cytochrome c qu’entraîne l’expression du mutant de Drp 1 est relativement modeste et il n’a pas été prouvé que cela permet une survie de la cellule à long terme. De plus, les souris Drp1
−/− présentent un taux élevé d’apoptose, ce qui suggère que Drp1 n’est pas indispensable à la PEMME [
17]. Le retard dans la cinétique de libération du cytochrome c qui est observé lorsque l’expression de Drp1 est éliminée (dans des cellules issues de souris Drp1
−/− ou en présence d’un ARN interférant dans des cellules en culture), ou fonctionnellement altérée (expression du mutant Drp1 K38A), pourrait traduire une modification de l’ultrastructure mitochondriale dans de telles cellules. En effet, dans les mêmes conditions, les cinétiques de libération d’autres protéines de l’espace intermembranaire comme Smac (second mitochondrial activator of caspases), Omi (une sérine protéase mitochondriale proapoptotique), AK2 (adenylate kinase 2) et DDP/TIMM8a 2, ne sont pas modifiées [ 17–
19]. Comme les protéines cytochrome c, Smac, Omi, AK2 et DDP/TIMM8a sont libérées simultanément et par un processus qui dépend de Bax/Bak [
18], le retard dans la cinétique de libération du cytochrome c dans les cellules défectueuses en Drp1 pourrait être artificiel. Il est possible que dans ces cellules, le remodelage des crêtes - dont on pense qu’il est nécessaire à la libération complète du cytochrome c [
20] - soit altéré. Toutefois, comme la cinétique de libération de Smac, Omi, AK2 et DDP/TIMM8a est manifestement normale, ceci suggère que la PEMME n’est pas affectée par la perte de Drp1. Enfin, il a été montré que l’expression de Mfn1 (mitofusin 1) ou de Mfn2, qui induit une forte fusion des mitochondries, retarde la libération du cytochrome c dans certaines conditions [5]. D’autres auteurs ont trouvé que l’apoptose n’était que faiblement inhibée en réponse à l’expression de Mfn1, Mfn2 mais également de Drp1K38A [10]. Ces observations conduisent à faire l’hypothèse que la fission mitochondriale ne serait probablement pas nécessaire à la PEMME et à l’apoptose, mais qu’elle pourrait agir comme un facteur contribuant à la libération de facteurs mitochondriaux plutôt qu’être un acteur principal dans ce processus. |
Le rôle du remodelage des crêtes dans la libération du cytochrome c Les mécanismes par lesquels la fission mitochondriale pourrait participer à la libération du cytochrome c au cours de l’apoptose n’ont pas été élucidés et demeurent pour le moment spéculatifs. Comme nous l’avons mentionné précédemment, l’altération de la libération du cytochrome c qui est observée dans les cellules où la fission mitochondriale induite par Drp1 est inhibée pourrait être due à des perturbations dans l’ultrastructure mitochondriale, notamment des crêtes mitochondriale. Ces dernières sont des invaginations de la membrane mitochondriale interne où se situent les différents complexes respiratoires. Le cytochrome c sert de navette à électrons entre les complexes III et IV, si bien que plus de 80 % du cytochrome c est localisé au niveau des crêtes. Ainsi, des études ont montré qu’un remodelage des crêtes semble nécessaire à une libération rapide et complète du cytochrome c au cours de l’apoptose [11, 20-
22]. Ce remodelage des crêtes impliquerait la protéine mitochondriale OPAl (optic atrophy 1), protéine de la machinerie de fusion mitochondriale qui régule également la morphologie des crêtes [6, 7]. OPAl se présente sous forme d’hétéro-oligomères, une forme soluble courte d’OPAl s’associant avec une forme longue d’OPAl. Les caractéristiques des isoformes d’OPAl sont détaillées par G. Lenaers et al., et C. Sauvanet et al., dans les deux revues qui accompagnent ce manuscrit [6, 7]. Il a été montré que les hétéro-oligomères d’OPAl régulent l’ouverture de la jonction des crêtes et, rapidement après la PEMME, se dissocient. Cela entraîne l’ouverture de la jonction des crêtes et la libération complète du cytochrome c et des formes solubles d’OPAl [11, 2l, 22]. De façon intéressante, OPAl contrôle le remodelage des crêtes au cours de l’apoptose indépendamment de sa fonction dans la fusion mitochondriale [2l]. Ceci suggère que pour le processus de libération du cytochrome c, les changements de la morphologie des crêtes sont plus importants que les changements dans l’équilibre fission-fusion mitochondrial [8]. Enfin, il a été montré que l’inhibition de la fission régulée par Drpl modifie la configuration des isoformes d’OPAl [18], si bien que l’altération de la libération du cytochrome c observée au cours de l’apoptose dans ces conditions ne serait pas liée à la prévention de la fragmentation mitochondriale mais plutôt, indirectement, à l’empêchement du réarrangement des crêtes nécessaire à la libération complète du cytochrome c. |
Implication de Bax/Bak dans la fission mitochondriale au cours de l’apoptose Bax est normalement localisée dans le cytosol alors que Bak est majoritairement associée à la membrane mitochondriale externe. Lors des étapes précoces de l’apoptose, Bax se relocalise au niveau de la mitochondrie ; Bax et Bak forment alors des agrégats à la surface de la membrane mitochondriale externe [1, 2] où ils colocalisent avec Drp1 et Mfn2 [12]. Il y aurait donc un lien entre les membres pro-apoptotiques de la famille Bcl-2 et la machinerie de fusion-fission des mitochondries. Depuis, les résultats de différents travaux suggèrent que Bax et Bak, mais également Bcl-2 et Bcl-XL
(B-cell lymphoma-extra large), régulent la morphologie mitochondriale en favorisant la fusion [
9, 10,
23,
24]. On a ainsi montré que Bak interagit avec Mfn1 et Mfn2 [14], Bcl-XL et Bcl-2 avec Mfn2 [
25] et Bcl-XL avec Drp1 [23]. Parallèlement à cette possible régulation de la morphologie des mitochondries par les membres de la famille Bcl-2, Bax et Bak sont aussi capables d’activer la fission induite par Drp1, et ce de façon indirecte. En effet, la PEMME déclenchée par Bax/Bak permet aussi la libération de DDP/TIMM8a dans le cytosol ; DDP/TIMM8a s’y fixe à Drp1 et lui permet de s’associer aux mitochondries pour activer la fission [
26] (Figure 3C). Un blocage de la fusion mitochondriale se produit également très rapidement après la PEMME [13], qui permet d’expliquer la fragmentation mitochondriale au cours de l’apoptose. Comme la PEMME conduit à la dissociation des hétéro-oligomères d’OPA1 et à la libération de la forme courte et soluble d’OPA1 dans le cytosol [11], cette perte d’OPA1 pourrait alors être responsable de la fragmentation mitochondriale car une diminution de l’expression d’OPA1 conduit à une fragmentation des mitochondries [11]. |
Pourquoi une fragmentation des mitochondries se produit-elle invariablement au cours de la mort cellulaire ? On sait que les mitochondries peuvent être sélectivement éliminées lors de la mort cellulaire programmée (MCP), même en l’absence d’activation de caspases [
27]. Cette élimination sélective des mitochondries (nommée mitoptose, ou plus couramment mitophagie) est augmentée dans les cellules où la fission induite par Drp1 est accrue, alors qu’au contraire, elle est empêchée dans les cellules où la fission induite par Drp1 est inhibée [26,
28]. Ceci suggère que la fission/fragmentation est une étape nécessaire à la mitophagie. De nombreux rapports ont décrit une mort cellulaire autophagique comme une forme alternative de MCP [
29]. Comme la mitophagie débute après la PEMME induite par Bax/Bak, la mort cellulaire autophagique pourrait être également une conséquence de la PEMME [8]. Comme la mitophagie participe à cette forme de mort cellulaire alternative, des cellules dans lesquelles la mitophagie est augmentée sont plus sensibles à la mort cellulaire indépendante des caspases alors qu’au contraire, une diminution de la mitophagie rend les cellules plus résistantes à ce processus autophagique [26, 28]. Ainsi, en réponse à la PEMME induite par Bax/Bak, deux voies de mort cellulaire semblent être engagées. D’une part, le cytochrome c est libéré dans le cytoplasme, conduisant à l’activation des caspases et à l’apoptose [1]. D’autre part, d’autres protéines comme DDP/TIMM8a et OPA1 sont libérées avec le cytochrome c, ce qui déclenche respectivement l’activation de la fission [26] et un blocage de la fusion mitochondriales [11]. L’ensemble de ces événements aboutit à une fragmentation mitochondriale et finalement à une élimination sélective des mitochondries [26]. Dans des conditions normales, l’activation des caspases induit l’apoptose et la mort cellulaire en quelques heures. Cependant, quand l’activation des caspases est inhibée ou bien n’a pas lieu, la mitophagie se déroule et de fait participe à une voie alternative de mort cellulaire [8]. |
Conclusion et perspectives Il se produit invariablement une fragmentation du réseau mitochondrial au cours de l’apoptose, mais les mécanismes et la signification de ce processus ne sont pas encore clairement définis. En effet, il semble que des membres de la famille Bcl-2 interagissent avec des protéines de la machinerie de fusion et de fission des mitochondries. Cependant, de nouvelles études sont nécessaires pour explorer l’étendue de ces interactions et pour clarifier leur impact fonctionnel. De plus, la fragmentation n’est apparemment pas un déterminant majeur dans l’exécution de l’apoptose. Des études complémentaires doivent néanmoins permettre de déterminer avec précision l’impact de la fission mitochondriale dans la PEMME et la libération des facteurs apoptogènes comme le cytochrome c qui en résulte. L’implication du changement de morphologie des crêtes mitochondriales dans la libération complète du cytochrome c demeure un champ d’investigation très intéressant. Enfin, le rôle de la fragmentation mitochondriale dans la mitophagie et la mort cellulaire autophagique doit encore être exploré avec précision. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Nous tenons à remercier les associations qui nous financent : la Ligue contre le cancer (équipe labellisée), la Fondation pour la recherche médicale (FRM) et l’ANRS.
|
Footnotes |
1. Danial NN, Korsmeyer SJ. Cell death: critical control points. Cell 2004 ; 116 : 205-19. 2. Green DR, Kroemer G. The pathophysiology of mitochondrial cell death. Science 2004 ; 305 : 626-9. 3. Desagher S, Martinou JC. Mitochondria as the central control point of apoptosis. Trends Cell Biol 2000 ; 10 : 369-77. 4. Frank S, Gaume B, Bergmann-Leitner ES, et al. The role of dynamin-related protein 1, a mediator of mitochondrial fission, in apoptosis. Dev Cell 2001 ; 1 : 515-25. 5. Youle RJ, Karbowski M. Mitochondrial fission in apoptosis. Nat Rev Mol Cell Biol 2005 ; 6 : 657-63. 6. Lenaers G, Amati-Bonneau P, Delettre C, et al. De la levure aux maladies neurodégénératives : 10 ans d’exploration des pathologies de la dynamique mitochondriale. MedSci (Paris) 2010 ; 26 : 836-41. 7. Sauvanet C, Arnauné-Pelloquin L, David C, et al. Dynamique et morphologie mitochondriales : acteurs, mécanismes et pertinence fonctionnelle. Med Sci (Paris) 2010 ; 26 : 823-9. 8. Arnoult D. Mitochondrial fragmentation in apoptosis. Trends Cell Biol 2007 ; 17 : 6-12. 9. Autret A, Martin SJ. Emerging role for members of the Bcl-2 family in mitochondrial morphogenesis. Mol Cell 2009 ; 36 : 355-63. 10. Sheridan C, Delivani P, Cullen SP, Martin SJ. Bax- or Bak-induced mitochondrial fission can be uncoupled from cytochrome c release. Mol Cell 2008 ; 31 : 570-85. 11. Arnoult D, Grodet A, Lee YJ, et al. Release of OPA1 during apoptosis participates in the rapid and complete release of cytochrome c and subsequent mitochondrial fragmentation. J Biol Chem 2005 ; 280 : 35742-50. 12. Karbowski M, Lee YJ, Gaume B, et al. Spatial and temporal association of Bax with mitochondrial fission sites, Drp1, and Mfn2 during apoptosis. J Cell Biol 2002 ; 159 : 931-8. 13. Karbowski M, Arnoult D, Chen H, et al. Quantitation of mitochondrial dynamics by photolabeling of individual organelles shows that mitochondrial fusion is blocked during the Bax activation phase of apoptosis. J Cell Biol 2004 ; 164 : 493-9. 14. Brooks C, Wei Q, Feng L, et al. Bak regulates mitochondrial morphology and pathology during apoptosis by interacting with mitofusins. Proc Natl Acad Sci USA 2007 ; 104 : 11649-54. 15. Breckenridge DG, Stojanovic M, Marcellus RC, Shore GC. Caspase cleavage product of BAP31 induces mitochondrial fission through endoplasmic reticulum calcium signals, enhancing cytochrome c release to the cytosol. J Cell Biol 2003 ; 160 : 1115-27. 16. Germain M, Mathai JP, McBride HM, Shore GC. Endoplasmic reticulum BIK initiates DRP1-regulated remodelling of mitochondrial cristae during apoptosis. EMBOJ 2005 ; 24 : 1546-56. 17. Ishihara N, Nomura M, Jofuku A, et al. Mitochondrial fission factor Drp1 is essential for embryonic development and synapse formation in mice. Nat Cell Biol 2009 ; 11 : 958-66. 18. Estaquier J, Arnoult D. Inhibiting Drp1-mediated mitochondrial fission selectively prevents the release of cytochrome c during apoptosis. Cell Death Differ 2007 ; 14 : 1086-94. 19. Parone PA, James DI, Da Cruz S, et al. Inhibiting the mitochondrial fission machinery does not prevent Bax/Bak-dependent apoptosis. Mol Cell Biol 2006 ; 26 : 7397-408. 20. Scorrano L, Ashiya M, Buttle K, et al. A distinct pathway remodels mitochondrial cristae and mobilizes cytochrome c during apoptosis. Dev Cell 2002 ; 2 : 55-67. 21. Frezza C, Cipolat S, Martins de Brito O, et al. OPA1 controls apoptotic cristae remodeling independently from mitochondrial fusion. Cell 2006 ; 126 : 177-89. 22. Yamaguchi R, Lartigue L, Perkins G, et al. Opa1-mediated cristae opening is Bax/Bak and BH3 dependent, required for apoptosis, and independent of Bak oligomerization. Mol Cell 2008 ; 31 : 557-69. 23. Berman SB, Chen YB, Qi B, et al. Bcl-xL increases mitochondrial fission, fusion, and biomass in neurons. J Cell Biol 2009 ; 184 : 707-19. 24. Karbowski M, Norris KL, Cleland MM, et al. Role of Bax and Bak in mitochondrial morphogenesis. Nature 2006 ; 443 : 658-62. 25. Delivani P, Adrain C, Taylor RC, et al. Role for CED-9 and Egl-1 as regulators of mitochondrial fission and fusion dynamics. Mol Cell 2006 ; 21 : 761-73. 26. Arnoult D, Rismanchi N, Grodet A, et al. Bax/Bak-dependent release of DDP/TIMM8a promotes Drp1-mediated mitochondrial fission and mitoptosis during programmed cell death. Curr Biol 2005 ; 15 : 2112-8. 27. Xue L, Fletcher GC, Tolkovsky AM. Mitochondria are selectively eliminated from eukaryotic cells after blockade of caspases during apoptosis. Curr Biol 2001 ; 11 : 361-5. 28. Barsoum MJ, Yuan H, Gerencser AA, et al. Nitric oxide-induced mitochondrial fission is regulated by dynamin-related GTPases in neurons. EMBOJ 2006 ; 25 : 3900-11. 29. Kroemer G, Levine B. Autophagic cell death: the story of a misnomer. Nat Rev Mol Cell Biol 2008 ; 9 : 1004-10. |