| |
| Med Sci (Paris). 2010 October; 26(10): 855–860. Published online 2010 October 15. doi: 10.1051/medsci/20102610855.Maladie de Rendu-Osler Dysfonctionnement de la signalisation TGFβ dans les cellules endothéliales Sabine Bailly,1,2,3 Sophie Dupuis-Girod,4,5 and Henri Plauchu4,5* 1Inserm, U878, 17, rue des Martyrs, 38054 Grenoble 2Commissariat à l’énergie atomique et aux énergies alternatives (CEAEA), Institut de recherches en technologies et sciences pour le vivant (iRTSV)/laboratoire angiogenèse et physiopathologie vasculaire (LAPV) 3Université Joseph Fourier, Grenoble, France 4Hospices civils de Lyon, Hôpital de l’Hôtel Dieu, service de génétique et centre de référence national Maladie de Rendu-Osler, Lyon F-69288 5Université Lyon 1, F-69008, France |
Maladie de Rendu-Osler : principales caractéristiques cliniques et génétiques Rappels cliniques et épidémiologiques Parmi les 6 000 à 8 000 maladies rares dont plus de 80 % sont d’origine génétique (voir la base de données OMIM, online mendelian inheritance in man), qu’est-ce qui a décidé l’équipe lyonnaise du service de génétique médicale du Pr J.M. Robert à s’intéresser à la maladie de Rendu-Osler, rapidement rebaptisée aux États-Unis télangiectasie hémorragique héréditaire (HHT) ? C’est la découverte, dans les années 1970, d’une concentration géographique de malades dans les départements de l’Ain et du Jura, signalée dès 1978 dans La Nouvelle Presse médicale [
1] et dans la revue Médecine et Hygiène [
2]. Sous le titre « Étude généalogique de la maladie de Rendu-Osler dans une population rurale », la découverte de l’équipe lyonnaise était la conséquence d’un effet fondateur [
3] d’une maladie transmissible, prouvé ensuite par l’identification, dès 2000, de la mutation dominante dans un gène responsable de la maladie. Celle-ci, initialement définie par Henri Rendu en 1896 à Paris, puis par William Osler en 1902 à Baltimore, et enfin par Francis P. Weber en 1907 à Londres, repose sur trois signes cliniques essentiels très fréquents [
4] : les épistaxis (présents chez 95 % des patients), les télangiectasies1 (84 %) et la présence de ces deux signes chez un des deux parents (98 %) [
5]. La maladie de Rendu-Osler, rare puisque ne touchant qu’une personne sur 5 à 6 000 en France, a été l’objet d’une exception-nelle étude épidémiologique sur la France entière [
6]. Des critères diagnostiques ont été établis lors d’une conférence de consensus à Curaçao [
7]. Les épistaxis spontanées, irrégulières, récidivantes, entraînent anémie et asthénie et sont socialement gênantes. Elles obligent le patient à une reconstitution continuelle des réserves de fer durant la vie entière (apport de fer per os ou par voie intraveineuse ou via des transfusions). Elles sont dues à des télangiectasies disséminées dans la tache rouge nasale. Les télangiectasies cutanées et muqueuses de localisations typiques au visage, aux doigts et au carrefour aérodigestif (lèvres, langue) atteignent ensuite l’estomac et accessoirement l’intestin [5]. Les manifestations viscérales patentes sont plus rares (de 3 % à 50 %) et n’ont été décrites que dans la deuxième moitié du XXe siècle. Chacune d’elles peut remplacer un des trois signes essentiels [
8]. La lésion de base, la fistule artérioveineuse (FAV), est aussi une télangiectasie qui évolue en grossissant à cheval sur la jonction capillaire qu’elle élargit, créant ainsi un shunt artérioveineux dans l’intestin, le foie, le poumon ou le système nerveux central. Les conséquences sont trompeuses et dépendent du nombre, de la taille et de la localisation de ces FAV, appelées malformations artérioveineuses (MAV), mais qui sont exceptionnellement présentes et patentes dès la naissance. Données moléculaires et génétiques La transmission héréditaire autosomique dominante implique de toujours retrouver un parent du patient qui soit atteint. D’autres apparentés ascendants ou descendants peuvent être atteints : en moyenne quatre par famille [ 6]. Deux gènes responsables de la maladie de Rendu-Osler non syndromique sont connus : ENG (endogline) [
9] et ACVRL1 (activin A receptor type II-like 1) [
10]. Ces gènes sont impliqués dans la voie de signalisation du TGFβ (transforming growth factor beta). Un troisième gène, MADH4 (mothers against decapentaplegic homolog 4) ou SMAD4, est responsable d’une forme syndromique de Rendu-Osler puisqu’il réalise une association avec la polypose juvénile [
11]. Une mutation d’un de ces gènes est trouvée dans près de 90 % des familles (une mutation différente par famille), ce qui permet de confirmer le diagnostic, et surtout de permettre le diagnostic intrafamilial avant l’apparition des signes cliniques ou lorsqu’ils sont rares. Ainsi, la prévention des complications, surtout neurologiques chez l’enfant et pneumologiques chez l’enfant et l’adulte, peut être organisée même en cas de forme incomplète. Les corrélations phénotype-génotype entre les types cliniques HHT1 (mutations de ENG) et HHT2 (mutations de ACVRL1) ne portent que sur le pourcentage respectif des diverses complications qui peuvent toutes être présentes avec chaque gène (par exemple : FAV pulmonaire chez 50 % des patients HHT1 mais 18 % des HHT2 ; majorité d’atteinte hépatique avec HHT2). La population responsable de l’effet fondateur du Jura [6] se reconnaît à l’unique mutation 1112-1113 dupG d’ACVRL1 présente chez plus de 120 sujets actuellement répertoriés dans le Centre de référence de Lyon [3]. La variation clinique intrafamiliale ou entre ces sujets porteurs de la même mutation oblige à admettre le rôle de gène(s) modificateur(s) ainsi que l’influence du sexe et de l’âge pour les FAV hépatiques. |
Maladie de Rendu-Osler : un dysfonctionnement de la signalisation Smad-dépendante de la famille TGFβ Les trois gènes identifiés dans la maladie de Rendu-Osler (ENG, ACVRL1, MADH4) codent pour des protéines impliquées dans la voie de signalisation de la famille TGFβ. Celle-ci regroupe une trentaine de facteurs peptidiques, qui agissent sous forme d’homodimères. On distingue les TGFβ, les BMP (bone morphogenetic proteins) et les GDF (growth and differentiation factors) [
12]. Parfois, une BMP et un GDF correspondent à la même protéine, comme BMP9 appelée aussi GDF2. Ces facteurs agissent par l’intermédiaire de récepteurs à activité sérine/thréonine kinase [
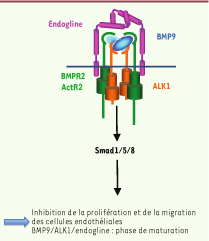
13]. Il existe des récepteurs de type 2 (il y en a cinq) et des récepteurs de type 1 (encore appelés ALK pour activin receptor-like kinase, il en existe sept). En réponse à la fixation des facteurs, un hétérocomplexe se forme, constitué de deux récepteurs de type 1 et deux récepteurs de type 2. Le récepteur de type 2 phosphoryle le récepteur de type 1 qui est alors activé et phosphoryle à son tour des facteurs de transcription spécifiques de la famille TGFβ que l’on appelle Smad (précédemment nommés MAD, mothers against decapentaplegic). On distingue deux voies de signalisation Smad selon le récepteur de type 1 activé. La voie dite du TGFβ (ALK4, 5, 7) phosphoryle les Smad 2 et 3, et la voie des BMP (ALK1, 2, 3, 6) phosphoryle les Smad 1, 5, 8 (Figure 1). Ces protéines Smad, une fois phosphorylées, s’associent à une Smad commune, Smad4, migrent dans le noyau pour se fixer aux régions promotrices des gènes cibles en association avec d’autres facteurs ou cofacteurs de transcription et induisent ou répriment un grand nombre de gènes. Il existe également des voies de signalisation indépendantes des Smad. Des récepteurs de type 3 sont également connus, ce sont en fait des corécepteurs qui ne sont pas capables de transduire le signal par eux-mêmes mais qui peuvent augmenter l’affinité du ligand pour son récepteur. C’est le cas de l’endogline, ici concernée, et du bêtaglycan.  | Figure 1 Implication de la voie BMP9/ALK1/endogline dans la maladie de Rendu-Osler. Le BMP9 se lie sur un hétérocomplexe constitué de deux récepteurs ALK1 et deux récepteurs de type 2 (BMPR2 ou ActR2). Le récepteur de type 2 phosphoryle ALK1 qui à son tour phosphoryle les facteurs de transcription Smad1/5/8. L’addition de BMP9 entraîne l’inhibition de la migration et de la prolifération des cellules endothéliales, ce qui suggère un rôle pour cette voie de signalisation dans la phase de maturation de l’angiogenèse. |
ENG (endogline) Le gène codant pour l’endogline a été le premier gène identifié dans la maladie de Rendu-Osler de type HHT1 [ 9]. L’endogline est un corécepteur spécifiquement exprimé à la surface des cellules endothéliales [
14]. C’est un homodimère de 633 acides aminés (aa) dont la plus grande partie est extracellulaire (561 aa). Le domaine cytoplasmique est composé de 47 aa et peut être phosphorylé par le récepteur de type 2 du TGFβ (TβR2) et par ALK1 [
15]. Il existe également une forme minoritaire tronquée due à un épissage alternatif (le domaine cytoplasmique est composé de 14 aa). Les mutations de l’ENG sont pour la plupart des mutations non-sens qui entraînent l’absence d’expression de la protéine à la surface cellulaire et donc une haplo-insuffisance. ACVRL1 (ALK1) Le deuxième gène identifié dans la maladie de Rendu-Osler de type HHT2 est ACVRL1 qui code pour le récepteur de type 1, ALK1 [ 10]. Ce récepteur, comme l’endogline, est principalement exprimé à la surface des cellules endothéliales. La plupart des mutations d ’ACVRL1 sont des mutations faux-sens. La protéine ALK1 mutée dans la plupart des cas semble exprimée à la surface des cellules, mais serait non fonctionnelle [
16]. Il s’agirait donc dans ce cas d’une haplo-insuffisance fonctionnelle. MADH4 (Smad4) Le troisième gène identifié dans une forme de maladie de Rendu-Osler syndromique est MADH4 qui code pour le facteur de transcription Smad4 commun aux deux voies de signalisation de la famille du TGFβ [ 11]. L’implication de deux récepteurs de la famille du TGFβ dans la maladie de Rendu-Osler, le fait que ces deux récepteurs soient plus particulièrement exprimés dans les cellules endothéliales et que des mutations de Smad4 soient également associées permet de proposer que le développement de la maladie de Rendu-Osler est dû à un dysfonctionnement de la signalisation Smad-dépendante de la famille TGFβ dans la cellule endothéliale. |
Modèles animaux de maladie de Rendu-Osler Modèles murins L’implication de l’endogline et d’ALK1 dans la maladie de Rendu-Osler a été confirmée par leur invalidation dans des modèles murins. L’invalidation homozygote d’Alk1 ou du gène ENG entraîne une létalité embryonnaire d’origine cardiovasculaire autour de E11,5 alors que les souris hétérozygotes Alk1+/-
ou Eng+/-
présentent un phénotype qui ressemble à celui des patients atteints de la maladie de Rendu-Osler. L’âge du développement de la maladie, la gravité des syndromes et la sévérité sont variables et dépendent du bruit de fond génétique des souris [
17]. Ce dernier point suggère la possibilité d’un second hit génétique ou environnemental qui serait indispensable au déclenchement de la maladie mais non encore identifié. Une augmentation de la pression systolique du ventricule droit chez les souris Eng+/-, associée à des défauts de réponse à l’acétylcholine, a été mise en évidence, et il a été proposé que l’endogline permette le couplage de la eNOS (endothelial nitric oxide synthase) avec la protéine de choc thermique Hsp90 [
18]. On a aussi mis en évidence une altération de la régénération cardiaque après ischémie chez les souris Eng+/-
[
19]. Dans ce même modèle, les cellules mononucléées circulantes issues de patients HHT1 avaient une moindre capacité de stimulation de la régénération du muscle cardiaque ischémié que des cellules provenant de donneurs sains. Plus récemment, l’invalidation ciblée d’Alk1, d’Alk5 ou TβR2 dans les cellules endothéliales a été réalisée en utilisant une recombinase Cre sous contrôle du promoteur d’Alk1 [
20]. Les souris invalidées pour Alk1 ont un phénotype vasculaire marqué, contrairement aux souris invalidées pour Alk5 ou TβR2. Ce travail montre que la voie TGFβ/ALK5/TβR2 ne semble pas impliquée dans cette pathologie (voir discussion plus loin). Enfin, l’année dernière, une souris dont l’invalidation de Alk1 est inductible a été générée, ce qui permit d’étudier le rôle d’ALK1 chez la souris adulte [
21]. Ces travaux montrent que ces souris forment des shunt artérioveineux en réponse à une blessure. La blessure pourrait donc être un des second hit impliqués dans l’étiologie de la maladie de Rendu-Osler. Modèle du poisson zèbre et maladie de Rendu-Osler L’invalidation d’Alk1 [mutant violet beauregarde (vbg)] a également été réalisée chez le poisson zèbre [
22]. Elle entraîne des défauts dès le deuxième jour post-fertilisation avec une circulation sanguine perturbée, limitée à la tête, et les vaisseaux sont dilatés, suggérant une hyperprolifération des cellules endothéliales. |
Identification des ligands du récepteur ALK1 : BMP9 et BMP10 BMP9, un ligand de ALK1 Pendant de nombreuses années, ALK1 a été un récepteur orphelin, puis un modèle a été proposé dans lequel TGFβ, en association avec ALK5, pouvait être un ligand d’ALK1 [
23]. Ce modèle est actuellement remis en cause car en 2006, notre groupe a identifié les facteurs BMP9 et BMP10 comme des ligands spécifiques et de forte affinité d’ALK1 [
24]. Ces résultats ont été confirmés depuis par un autre groupe [
25]. L’expression de BMP10 semble restreinte au stade embryonnaire et jouerait un rôle dans le développement du cœur. BMP9, en revanche, est produite chez l’adulte dans le foie et circule dans le plasma et le sérum (5 ng/ml) [
26]. L’ensemble de ces données suggère que BMP9 serait le ligand d’ALK1 impliqué dans la maladie de Rendu-Osler. La liaison de BMP9 à l’endogline, et l’augmentation par l’endogline de la réponse Smad dépendante de BMP9 en aval d’ALK1 ont aussi été démontrées [ 22]. Aucune compensation du taux circulant de BMP9 n’a été mis en évidence chez les patients atteints de la maladie de Rendu-Osler [ 26]. Implication d’ALK1 et de l’endogline dans la phase de maturation de l’angiogenèse L’angiogenèse est la formation de nouveaux vaisseaux sanguins à partir d’un réseau vasculaire existant. On distingue deux phases au cours de l’angiogenèse : tout d’abord une phase d’activation où la matrice extracellulaire est dégradée et les cellules endothéliales migrent et prolifèrent. Le VEGF (vascular endothelial growth factor) est un des facteurs-clés de cette phase d’activation. Cette phase est suivie par une phase de maturation où les cellules endothéliales arrêtent de migrer et de proliférer, la matrice cellulaire est reconstituée et il y a un recrutement de cellules mésenchymateuses qui se différencient en péricytes ou en cellules musculaires lisses suivant le type de vaisseaux. L’angiogenèse est normalement quiescente chez l’adulte. On parle de balance angiogénique qui résulte d’une homéostasie entre les facteurs impliqués dans la phase d’activation et ceux impliqués dans la phase de maturation de l’angiogenèse. Le rôle du récepteur ALK1, en l’absence de ligand spécifique, a longtemps été débattu dans la littérature [
27,
28]. L’identification de son ligand BMP9 a permis de confirmer clairement son rôle dans l’inhibition de la prolifération, de la migration et du bourgeonnement des cellules endothéliales in vitro ainsi que de la néo-angiogenèse in vivo [24–26]. Ces données indiquent que BMP9 serait un facteur-clé de la phase de maturation de l’angiogenèse (Figure 1) et sa présence dans le sang suggère son rôle dans le maintien de la quiescence vasculaire chez l’adulte [26]. Ces résultats nous permettent de proposer le modèle suivant : lorsque la voie BMP9/ALK1/endogline est perturbée, la quiescence est diminuée, ce qui entraîne un dérèglement de la balance angiogénique et donc une néoactivation de l’angiogenèse (Figure 2A et B).  | Figure 2
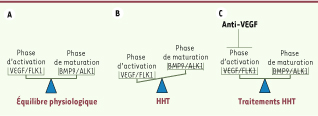
Balance angiogénique dans la maladie de Rendu-Osler. A. Chez l’adulte sain, la balance angiogénique est équilibrée entre la phase d’activation et la phase de maturation,et le réseau vasculaire est quiescent. B. Chez les patients HHT, la voie de signalisation BMP9/ALK1/endogline est déficiente, ce qui entraîne une diminution de la phase de maturation et donc un déséquilibre de la balance angiogénique en faveur de la phase d’activation (VEGF). C. Une nouvelle approche thérapeutique de cette maladie est donc de diminuer la phase d’activation de l’angiogenèse en apportant des facteurs anti-VEGF afin de rétablir cet équilibre. |
|
La prise en charge de la maladie de Rendu-Osler Une revue détaillée sur les approches thérapeutiques a été récemment publiée [
29]. Le traitement martial traite l’anémie, mais la diminution relative des épistaxis peut être obtenue par l’action de différents lasers ou de produits sclérosants injectés dans ou autour des télangiectasies. Cette action peut être répétée dans le temps, contrairement à la possibilité d’emboliser les artérioles ou de ligaturer les artères à destinée nasale. D’autres techniques plus difficiles et traumatisantes consistent à changer la muqueuse nasale par une greffe cutanée, ou à réaliser une fermeture nasale chirurgicale. Le traitement des MAV viscérales est adapté à l’organe concerné. Pour les MAV pulmonaires, la vaso-occlusion a clairement montré son efficacité sur la prévention des complications (hémorragies, abcès cérébraux, accidents vasculaires cérébraux). La vaso-occlusion des MAV neurologiques doit être discutée par des équipes spécialisées pour chaque patient, en fonction du risque hémorragique, de la symptomatologie et de la localisation. Enfin, les MAV hépatiques sont le plus souvent asymptomatiques et ne justifient alors qu’une surveillance. Seules les MAV hépatiques ayant un retentissement clinique cardiaque ou biliaire sévère peuvent justifier un traitement spécifique et parfois une transplantation hépatique. Dans tous les cas, un avis multidisciplinaire dans des centres compétents est nécessaire. Plus récemment, la découverte fortuite de l’action d’un anticorps monoclonal anti-VEGF (bévacizumab) [
30] sur les symptômes HHT d’un patient atteint d’un cancer [
31] et les dernières connaissances concernant le rôle possible de l’angiogenèse dans la physiopathologie de la maladie permettent d’envisager l’utilisation des traitements anti-angiogéniques dans la maladie de Rendu-Osler (Figure 2C). L’utilisation du bévacizumab a été rapportée chez une personne en attente d’une greffe hépatique [
32] et dans le traitement des épistaxis [
33,
34]. Les premiers essais semblent très encourageants et un essai de phase II est en cours dans le Centre de référence, à Lyon. D’autres agents anti-angiogéniques tels que la thalidomide ou le lénalidomide ont été utilisés et semblent donner des résultats intéressants chez des patients atteints de maladie de Rendu-Osler [
35]. |
Lors de la prise en charge des patients et de l’observation de l’histoire naturelle de la maladie, des questions ou hypothèses pathogéniques apparaissent : la localisation des télangiectasies cutanées correspond-elle à une exposition solaire ou à un facteur extérieur traumatisant agissant comme un second hit ? Les télangiectasies sur les cornets du nez semblent indiquer que les turbulences desséchantes des flux respiratoires représentent une agression favorisant les saignements de nez. En effet, l’humidification ou la fermeture des fosses nasales aboutit à une amélioration, voire même à un arrêt des saignements de nez, tandis que la muqueuse digestive, constamment humidifiée par les sécrétions, semble mieux résister. Les localisations des FAV viscérales sont inégales selon les viscères : éparses pour le système nerveux, disséminées surtout dans les bases des poumons mais parfois uniques ou parfois presque confluentes. Enfin, les lésions hépatiques sont franchement confluentes et généralisées dans tout l’organe. Une telle variation d’expression amène à proposer le rôle de facteurs génétiques ou extérieurs ayant une influence différente d’un viscère à l’autre. Enfin, la possibilité de formes néonatales neurologiques ou pulmonaires montre que nous sommes à la limite de la malformation en relation avec une anomalie de l’induction vasculaire. Cependant, les fistules découvertes chez l’adulte sont-elles le résultat de la croissance de lésions initiales toutes présentes à la naissance ou peuvent-elles apparaître avec le temps à des âges successifs de la vie ? Et ce jusqu’à quel âge ? Et sous l’influence de quels facteurs locaux ? Le fait que ces fistules occluses puissent se reperméabiliser soulève la question d’une croissance évolutive étayant alors la deuxième hypothèse, comme la preuve de l’apparition de nouvelles fistules dans des champs pulmonaires déjà complètement explorés par des scanners précédents. Cette meilleure connaissance des mécanismes de la maladie suppose de colliger soigneusement les indices de son évolution tout en assurant la prise en charge des malades, ce qui est possible en utilisant une base de données sécurisée. Celle-ci, appelée CIROCO (clinical investigations in Rendu-Osler cohorte) est accessible en ligne pour toutes les équipes du réseau Rendu-Osler. L’identification, dans les années 1994-1996, des gènes impliqués dans la maladie de Rendu-Osler, codant pour des récepteurs impliqués dans la signalisation de la famille TGFβ (endogline, ALK1, Smad4), puis dix ans plus tard du ligand de ces récepteurs (BMP9), et plus récemment des fonctions cellulaires de ces récepteurs dans l’angiogenèse, devraient permettre de proposer rapidement de nouveaux traitements pour ces patients. Il reste cependant à identifier les cibles moléculaires de ces récepteurs. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Plauchu H, Bideau A, Robert JM. Nouv Presse Med 1978 ; 7 : 1723-5. 2. Plauchu H, Bideau A, Revol L, Robert JM. Étude généalogique de la maladie de Rendu-Osler dans une population rurale (ou « Quand un Haut-Jurassien saigne du nez »). Med Hyg 1978 ; 36 : 1223-9. 3. Brunet G, Lesca G, Genin E, et al. Trente ans d’étude de la maladie de Rendu-Osler en France : démographie historique, génétique des populations et biologie moléculaire. Population 2009 ; 62 : 305-26. 4. Plauchu H, Brunet G, Bideau A, Robert JM. La maladie de Rendu-Osler. Le Concours Médical 1992 ; 114 : 2469-76. 5. Plauchu H, de Chadarevian JP, Bideau A, Robert JM. Age-related clinical profile of hereditary hemorrhagic telangiectasia in an epidemiologically recruited population. Am J Med Genet 1989 ; 32 : 291-7. 6. Bideau A, Plauchu H, Brunet G, Robert J. Epidemiological investigation of Rendu-Osler disease in France: its geographical distribution and prevalence. Population 1989 ; 44 : 3-22. 7. Shovlin CL, Guttmacher AE, Buscarini E, et al. Diagnostic criteria for hereditary hemorrhagic telangiectasia (Rendu-Osler-Weber syndrome). Am J Med Genet 2000 ; 91 : 66-7. 8. Plauchu H, Saurin JC, Henry L, et al. Maladie de Rendu-Osler ou télangiestasie hémorragique héréditaire : complications et traitements. Med Ther 1998 , 4 : 223-9. 9. McAllister KA, Grogg KM, Johnson DW, et al. Endoglin, a TGF-beta binding protein of endothelial cells, is the gene for hereditary haemorrhagic telangiectasia type 1. Nat Genet 1994 ; 8 : 345-51. 10. Johnson DW, Berg JN, Baldwin MA, et al. Mutations in the activin receptorlike kinase 1 gene in hereditary haemorrhagic telangiectasia type 2. Nat Genet 1996 ; 13 : 189-95. 11. Gallione CJ, Repetto GM, Legius E, et al. A combined syndrome of juvenile polyposis and hereditary haemorrhagic telangiectasia associated with mutations in MADH4 (SMAD4). Lancet 2004 ; 363 : 852-9. 12. Feige J, Quirin N, Souchelnitskiy S. TGFβ, un peptide biologique sous contrôle : formes latentes et mécanisme d’activation. Med Sci (Paris) 1996 ; 12 : 929-39. 13. David L, Feige JJ, Bailly S. Emerging role of bone morphogenetic proteins in angiogenesis. Cytokine Growth Factor Rev 2009 ; 20 : 203-12. 14. Letarte M. Le rôle de l’endogline dans le système vasculaire et cardiovasculaire. Med Sci (Paris) 2000 ; 16 : 968-73. 15. Koleva RI, Conley BA, Romero D, et al. Endoglin structure and function: Determinants of endoglin phosphorylation by TGFbeta receptors. J Biol Chem 2006 ; 281 : 25110-23. 16. Ricard N, Bidart M, Mallet C, et al. Functional analysis of the BMP9 response of ALK1 mutants from HHT2 patients: a diagnostic tool for novel ACVRL1 mutations. Blood 2010 (sous presse). 17. Sorensen LK, Brooke BS, Li DY, Urness LD. Loss of distinct arterial and venous boundaries in mice lacking endoglin, a vascular-specific TGFbeta coreceptor. Dev Biol 2003 ; 261 : 235-50. 18. Toporsian M, Jerkic M, Zhou YQ, et al. Spontaneous adult-onset pulmonary arterial hypertension attributable to increased endothelial oxidative stress in a murine model of hereditary hemorrhagic telangiectasia. Arterioscler Thromb Vasc Biol 2010 ; 30 : 509-17. 19. van Laake LW, van den Driesche S, Post S, et al. Endoglin has a crucial role in blood cell-mediated vascular repair. Circulation 2006 ; 114 : 2288-97. 20. Park SO, Lee YJ, Seki T, et al. ALK5- and TGFBR2-independent role of ALK1 in the pathogenesis of hereditary hemorrhagic telangiectasia type 2. Blood 2008 ; 111 : 633-42. 21. Park SO, Wankhede M, Lee YJ, et al. Real-time imaging of de novo arteriovenous malformation in a mouse model of hereditary hemorrhagic telangiectasia. J Clin Invest 2009 ; 119 : 3487-96. 22. Roman BL, Pham VN, Lawson ND, et al. Disruption of acvrl1 increases endothelial cell number in zebrafish cranial vessels. Development 2002 ; 129 : 3009-19. 23. Goumans MJ, Valdimarsdottir G, Itoh S, et al. Activin receptor-like kinase (ALK)1 is an antagonistic mediator of lateral TGFbeta/ALK5 signaling. Mol Cell 2003 ; 12 : 817-28. 24. David L, Mallet C, Mazerbourg S, et al. Identification of BMP9 and BMP10 as functional activators of the orphan activin receptor-like kinase 1 (ALK1) in endothelial cells. Blood 2007 ;109 : 1953-61. 25. Scharpfenecker M, van Dinther M, Liu Z, et al. BMP-9 signals via ALK1 and inhibits bFGF-induced endothelial cell proliferation and VEGF-stimulated angiogenesis. J Cell Sci 2007 ; 120 : 964-72. 26. David L, Mallet C, Keramidas M, et al. Bone morphogenetic protein-9 is a circulating vascular quiescence factor. Circ Res 2008 ; 102 : 914-22. 27. Lamouille S, Mallet C, Feige JJ, Bailly S. Activin receptor-like kinase 1 is implicated in the maturation phase of angiogenesis. Blood 2002 ; 100 : 4495-501. 28. Goumans MJ, Valdimarsdottir G, Itoh S, et al. Balancing the activation state of the endothelium via two distinct TGF- beta type I receptors. EMBO J 2002 ; 21 : 1743-53. 29. Dupuis-Girod S, Bailly S, Plauchu H. Hereditary hemorrhagic telangiectasia (HHT): from molecular biology to patient care. J Thromb Haemost 2010 ; 8 : 1447-56. 30. Cézé N, Lecomte T, Watier H. Anticorps monoclonaux thérapeutiques et ciblage vasculaire. Med Sci (Paris) 2009 ; 25 : 1099-104. 31. Flieger D, Hainke S, Fischbach W. Dramatic improvement in hereditary hemorrhagic telangiectasia after treatment with the vascular endothelial growth factor (VEGF) antagonist bevacizumab. Ann Hematol 2006 ; 85 : 631-2. 32. Mitchell A, Adams LA, Macquillan G, et al. Bevacizumab reverses need for liver transplantation in hereditary hemorrhagic telangiectasia. Liver Transpl 2008 ; 14 : 210-3. 33. Simonds J, Miller F, Mandel J, Davidson TM. The effect of bevacizumab (Avastin) treatment on epistaxis in hereditary hemorrhagic telangiectasia. Laryngoscope 2009 ; 119 : 988-92. 34. Davidson TM, Olitsky SE, Wei JL. Hereditary hemorrhagic telangiectasia/avastin. Laryngoscope 2010 ; 120 : 432-5. 35. Bowcock SJ, Patrick HE. Lenalidomide to control gastrointestinal bleeding in hereditary haemorrhagic telangiectasia: potential implications for angiodysplasias? Br J Haematol 2009 ; 146 : 220-2. |