| |
| Med Sci (Paris). 2010 November; 26(11): 906–909. Published online 2010 November 15. doi: 10.1051/medsci/20102611906.Génération de cellules β-pancréatiques par conversion spontanée de cellules α chez des souris diabétiques Fabrizio Thorel1 and Pedro L. Herrera1* 1Département de physiologie cellulaire et métabolisme, Faculté de médecine, Université de Genève, 1, rue Michel-Servet, CH 1211 Genève-4, Suisse MeSH keywords: Animaux, Maladies auto-immunes, immunologie, anatomopathologie, physiopathologie, Diabète expérimental, génétique, thérapie, Diabète de type 1, Glucagon, sécrétion, Cellules à glucagon, cytologie, physiologie, Insuline, Cellules à insuline, Souris, Phénotype, Régénération |
Fonctions endocrines et exocrines du pancréas Le pancréas est une glande qui remplit deux fonctions métaboliques importantes. La première est la production, par les cellules acinaires pancréatiques, des enzymes digestives nécessaires à la dégradation des aliments. Ces enzymes sont excrétées et acheminées au travers d'un réseau de canaux jusqu'à l'intestin, où les aliments seront digérés et absorbés. Les cellules acinaires et canalaires constituent la partie exocrine du pancréas et représentent environ 99 % de toutes les cellules de cet organe. La seconde fonction du pancréas est la synthèse des hormones responsables de la régulation de l'utilisation du sucre issu de la digestion des aliments et donc du contrôle de la glycémie (taux de sucre dans la circulation sanguine). Cette régulation permet de contrebalancer les épisodes d'hyperglycémie après les prises alimentaires et d'augmenter la glycémie à la suite du jeûne. La production d'hormones est assurée par la partie endocrine du pancréas, qui est organisée en groupes de cellules appelés îlots de Langerhans. Ceux-ci ne représentent que 1 % du poids de l'organe. Les cellules α, β, δ et PP synthétisent, respectivement, le glucagon, l'insuline, la somatostatine et le polypeptide pancréatique. Elles constituent les différents types cellulaires endocriniens matures des îlots pancréatiques adultes [
1]. |
Le besoin de nouvelles approches thérapeutiques anti-diabétiques Les cellules β ont une grande longévité et, par conséquent, prolifèrent peu au cours de la vie d'un individu. Lors de circonstances où la demande en insuline est accrue, comme en cas d'obésité ou pendant la grossesse, la taille et le nombre des cellules β peuvent augmenter, respectivement via une augmentation de la production d'insuline et la stimulation de la division cellulaire. Un déficit en cellules β, ou l'incapacité de celles-ci à produire suffisamment d'insuline, conduit à une augmentation soutenue de la glycémie se traduisant par une production élevée d'urine, c'est-à-dire un diabète. Dans le diabète de type 1, maladie auto-immune qui représente la forme la plus courante de la maladie chez l'enfant, les cellules β sont éliminées complètement par le système immunitaire. Par conséquent, ces patients doivent recevoir des injections quotidiennes d'insuline pendant toute leur vie. Cependant, cette stratégie thérapeutique ne permet pas un contrôle précis de la glycémie et n'évite pas les effets nocifs sur les vaisseaux sanguins qui peuvent conduire à l'insuffisance rénale, la cécité ou la gangrène. Ces complications justifient le développement de nouveaux traitements, plus adaptés, dont des approches innovantes de médecine régénérative. Dans ce contexte, notre laboratoire cherche depuis de nombreuses années à explorer si le pancréas adulte possède la capacité intrinsèque de générer de nouvelles cellules β après leur perte totale, c’est-à-dire dans une situation similaire à celle du diabète de type 1. Ceci impliquerait forcément que la formation de ces nouvelles cellules passe par des mécanismes autres que la prolifération des cellules β elles-mêmes. Pour explorer cette hypothèse, nous avons produit une souris transgénique chez laquelle on peut induire l’élimination sélective de quasiment toutes les cellules β, mais en l’absence de processus auto-immun. De cette façon nous avons pu étudier la régénération des cellules endocrines car, si de nouvelles cellules productrices d’insuline venaient à se différencier, elles ne seraient pas détruites par le système immunitaire [
2]. |
Un nouveau modèle animal de diabète de type 1 Divers modèles expérimentaux de diabète de type 1 chez les rongeurs ont montré qu’une forte réduction (50 %-80 %) du nombre de cellules sécrétrices d’insuline induit une augmentation du taux de prolifération des cellules β qui persistent [
3]. Afin de déterminer si le pancréas est capable de générer de nouvelles cellules sécrétrices d’insuline lorsque celles-ci sont complètement détruites, et ce à partir d’une autre source cellulaire (non β), nous avons développé un nouveau modèle de souris diabétique chez laquelle plus de 99 % des cellules β peuvent être éliminées [2]. Ceci a été possible grâce à l’expression par transgenèse du récepteur humain de la toxine diphtérique (DTR) à la surface des cellules β. Alors que l’administration de toxine diphtérique (DT) n’a aucun effet sur les souris normales puisqu’elles n’ont pas le récepteur DTR (souris DTR-), elle induit la mort de la quasi-totalité des cellules β présentes chez les souris transgéniques (DTR+). Les souris DTR+ traitées par la DT deviennent rapidement hyperglycémiques, développent tous les symptômes liés au diabète, et meurent en peu de temps si elles ne sont pas traitées avec de l’insuline. |
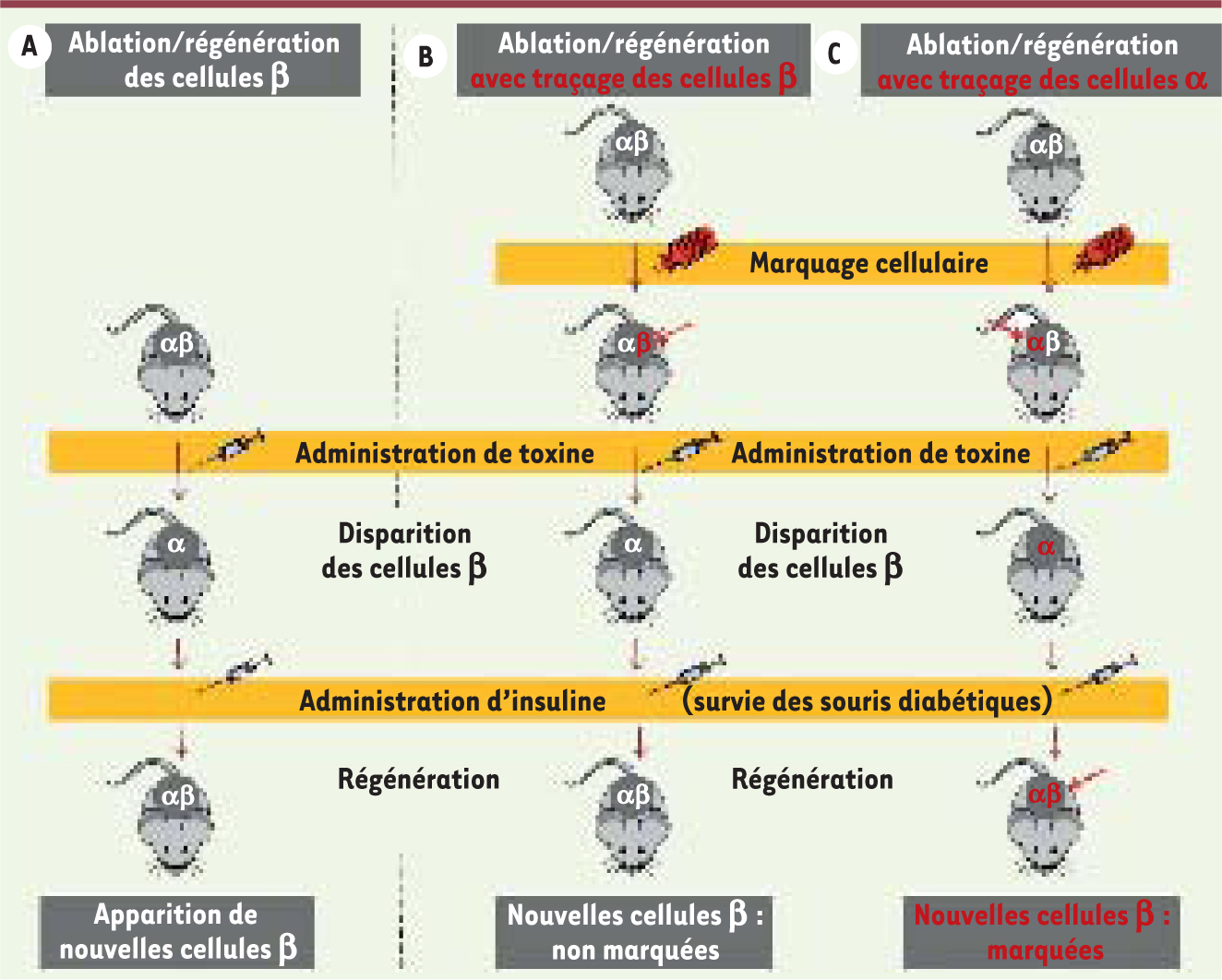
Mécanismes de la régénération des cellules β En réponse à l’élimination de la quasitotalité des cellules β, nous avons constaté que de nouvelles cellules productrices d’insuline apparaissaient progressivement dans les îlots des souris DTR+ (Figure 1A). Étonnamment, certaines de ces cellules contenaient simultanément de l’insuline et du glucagon. De telles cellules « hybrides » ou bi-hormonales ne sont jamais observées dans le pancréas adulte sain. Par ailleurs, chez toutes ces souris DTR+ rendues diabétiques, on constatait une amélioration du contrôle glycémique après quelques mois, contemporaine de la capacité de restauration des cellules à insuline. De fait, toutes les souris DTR+ montraient des signes évidents de régénération cellulaire. Ainsi, le pancréas adulte possède la faculté de générer de nouvelles cellules à insuline après la disparition complète de celles-ci.  | Figure 1
Un nouveau modèle murin de diabète de type 1. Les souris transgéniques expriment le récepteur de la toxine diphtérique à la surface des cellules β (transgène sous contrôle du promoteur de l’insuline). A. L’expression du DTR à la surface des cellules β les rend sensibles à la toxine diphtérique (DT). Lorsque la souris est traitée avec DT, l’ensemble des cellules β meurent. Les souris diabétiques maintenues en vie par un traitement à l’insuline régénèrent de nouvelles cellules β. B. Le marquage des cellules β préexistantes préalablement à l’ablation cellulaire montre que les cellules à insuline nouvellement formées ne dérivent pas de l’expansion des très rares cellules β ayant échappé à DT. C. Le marquage des cellules α exprimant le glucagon préalablement à l’ablation révèle, en revanche, que la majorité des nouvelles cellules β dérivent des cellules α (adapté à partir de
http://www.betacell.org
). |
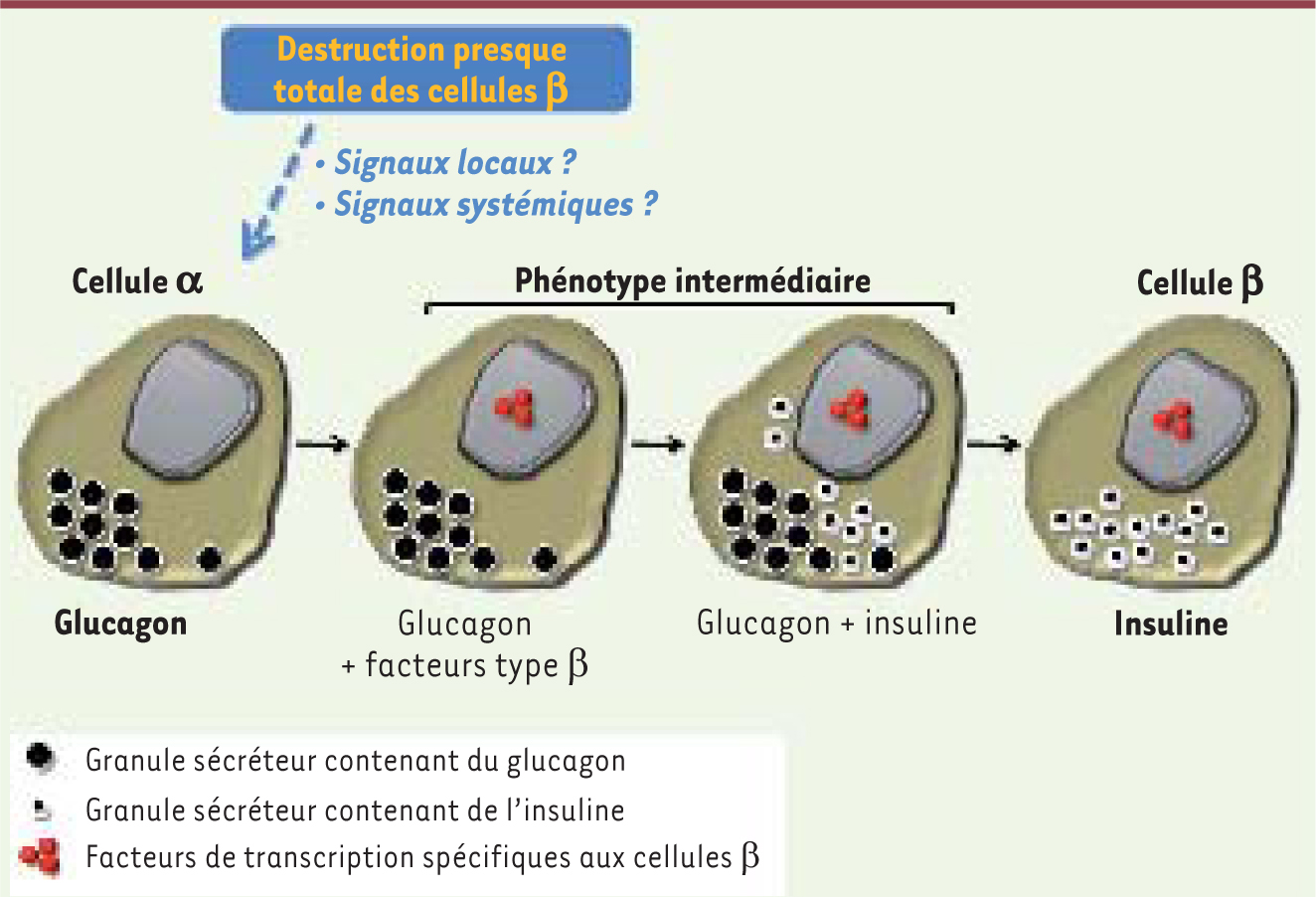
Nous avons ensuite réalisé des expériences de traçage des lignages cellulaires pancréatiques afin de déterminer l’origine des nouvelles cellules sécrétrices d’insuline observées après traitement par la DT. Le marquage irréversible des cellules β à l’aide d’un traceur fluorescent avant leur destruction a montré que les cellules β néoformées ne dérivent pas de l’expansion des très rares cellules β ayant échappé à la mort induite par la toxine (Figure 1B). En revanche, le traçage des cellules α a révélé sans équivoque que ces dernières étaient à l’origine non seulement des cellules « bi-hormonales », c’est-à-dire exprimant le glucagon et l’insuline, mais aussi de la plupart des cellules contenant uniquement de l’insuline (Figure 1C). Au cours de ce processus de régénération, les cellules α expriment, en plus de l’insuline, une multitude de facteurs connus pour être indispensables au bon fonctionnement des cellules β. Citons le transporteur Glut2 permettant l’entrée du glucose dans les cellules et des facteurs de transcription, tels que Pdx1 et Nkx6.1, nécessaires à la production et au contrôle de la sécrétion d’insuline. Ainsi, une fraction des cellules α change spontanément d’identité cellulaire après la destruction des cellules β préexistantes, afin de pallier le manque d’insuline. Au cours de ce processus de reprogrammation cellulaire, les cellules α démarrent un programme génétique conduisant à la production d’insuline et engendrant une population de cellules bi-hormonales. Cette nouvelle entité cellulaire dont le phénotype est intermédiaire ou hybride, à mi-chemin entre une cellule α et β, semble poursuivre sa métamorphose afin d’acquérir, à terme, l’ensemble des caractéristiques fonctionnelles des cellules β originelles (Figure 2).  | Figure 2
Reprogrammation des cellules pancréatiques endocrines α vers β. Séquence proposée de conversion sans dédifférenciation et sans prolifération, selon les analyses de traçage cellulaire et de coexpression de marqueurs sélectifs des cellules α et β. La perte massive des cellules β pourrait influencer les cellules α de façon directe (locale), ou indirecte (systémique), ou des deux façons simultanément. Nos observations non publiées suggèrent que dans les cellules bi-hormonales les deux hormones sont stockées dans des granules différents. |
|
Exploiter la plasticité cellulaire à des fins thérapeutiques ? La conversion d’un type cellulaire adulte en un autre différent, aussi appelée transdifférenciation ou reprogrammation cellulaire, est un phénomène très rare et mal compris, à peine décrit in vivo [
4] (→). La transdifférenciation de cellules acinaires adultes en cellules productrices d’insuline, induite par la surexpression combinée des facteurs Pdx1, Ngn3 et MafA, en est un exemple dans le pancréas [
5]. En revanche, alors que l’expression constitutive forcée du facteur de transcription Pax4 convertit artificiellement les cellules α embryonnaires en cellules productrices d’insuline, comme cela a été récemment démontré [
6] et rapporté dans ces colonnes [
7], nos résultats montrent qu’une conversion spontanée de cellules α adultes survient en réponse à une perte extrême de cellules β. Dans ce contexte d’ablation cellulaire, les rares cellules β épargnées ne semblent pas contribuer à la formation de nouvelles cellules à insuline ; celles-ci dérivent en effet pour la plupart, mais pas exclusivement, de la conversion de cellules α. D’autres sources cellulaires, non encore identifiées, seraient donc également « réquisitionnées » par le pancréas pour compenser le déficit en cellules β. Des expériences additionnelles de traçage cellulaire sont nécessaires pour déterminer si d’autres cellules insulaires (δ ou PP) ou exocrines (acinaires ou canalaires) sont aussi susceptibles de se transdifférencier en cellules productrices d’insuline dans ces circonstances.
(→) Voir la Nouvelle de John De Vos, page 904 de ce numéro
Nos observations indiquent que, dans une situation proche du diabète de type 1 mais en l’absence de réaction autoimmune, le pancréas adulte possède la capacité de générer de nouvelles cellules à insuline à partir de cellules non-β. Ce degré de plasticité cellulaire confère au pancréas adulte des propriétés régénératives intrinsèques jusqu’alors méconnues, qui pourraient être exploitées pour développer de nouvelles thérapies contre le diabète. Par exemple, ces résultats chez la souris suggèrent que si l’on arrivait à endiguer la réaction auto-immunitaire chez les personnes atteintes de diabète de type 1, le pancréas pourrait peut-être générer naturellement quelques cellules productrices d’insuline. La compréhension des diverses voies de signalisation et des évènements moléculaires impliqués dans ce processus de régénération devrait nous permettre d’agir sur ces mécanismes afin de les améliorer. Ces connaissances devraient également être utiles pour produire de nouvelles cellules à insuline en culture à partir de cellules pancréatiques adultes issues du patient, ou de cellules pluripotentes induites (iPS), dans une perspective de thérapie cellulaire. La possibilité de régénérer ne serait-ce que quelques nouvelles cellules β permettrait d’améliorer la qualité de vie des patients diabétiques en les soustrayant aux complications liées à un contrôle imparfait de la glycémie. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Nous remercions Delphine Baronnier pour ses commentaires sur le manuscrit. Le travail résumé dans cet article a été réalisé avec le financement de la Juvenile Diabetes Research Foundation, le Beta Cell Biology Consortium du NIH/NIDDK, et le Fonds national suisse de la recherche scientifique.
|
1. Orci L. Macro- and micro-domains in the endocrine pancreas. Diabetes 1982 ; 31 : 538-65. 2. Thorel F, Népote V, Avril I, et al. Conversion of adult pancreatic alpha-cells to beta-cells after extreme beta-cell loss. Nature 2010 ; 464 : 1149-54. 3. Dor Y, Brown J, Martinez OI, Melton DA. Adult pancreatic beta-cells are formed by self-duplication rather than stem-cell differentiation. Nature 2004 ; 429 : 41-6. 4. Zhou Q, Melton DA. Extreme makeover: converting one cell into another. Cell Stem Cell 2008 ; 3 : 382-8. 5. Zhou Q, Brown J, Kanarek A, et al. In vivo reprogramming of adult pancreatic exocrine cells to beta-cells. Nature, 2008 ; 455 : 627-32. 6. Collombat P, Xu X, Ravassard P, et al. The ectopic expression of Pax4 in the mouse pancreas converts progenitor cells into alpha and subsequently beta cells. Cell 2009 ; 138 : 449-62. 7. Collombat P, Mansouri A. Conversion de cellules alpha pancréatiques en cellules bêta. Med Sci (Paris) 2009 ; 25 : 763-5. |