| |
| Med Sci (Paris). 2010 November; 26(11): 911–914. Published online 2010 November 15. doi: 10.1051/medsci/20102611911.Leucémie myéloïde chronique et thérapeutiques ciblées Bientôt l’embarras du choix ? Gabriel Etienne1* and Françoise Huguet2* 1Service d’hémato-oncologie, Institut Bergonié, Centre de lutte contre le cancer de Bordeaux et du Sud-Ouest, 229 cours de l’Argonne, 33076 Bordeaux Cedex, France 2Service d’hématologie, CHU Purpan, Place du Dr Baylac, 31059 Toulouse Cedex, France MeSH keywords: Antinéoplasiques, usage thérapeutique, Benzamides, Dasatinib, Tolérance aux médicaments, Humains, Mésylate d'imatinib, Leucémie myéloïde chronique BCR-ABL positive, thérapie, Pipérazines, Protein-tyrosine kinases, antagonistes et inhibiteurs , Pyrimidines, Thiazoles, Facteurs temps, Résultat thérapeutique |
La suprématie de l’imatinib remise en cause Situation presque inédite dans une maladie modèle, les résultats de deux essais thérapeutiques internationaux de phase III menés par l’industrie pharmaceutique sont publiés simultanément dans le prestigieux New England Journal of Medecine [
1,
2]. Ils comparent respectivement l’efficacité du nilotinib et du dasatinib, deux inhibiteurs de tyrosine kinase, à celle de l’imatinib chez des patients présentant une leucémie myéloïde chronique en phase chronique (LMC-PC) au diagnostic (voir Encadré) [
10]. Bien qu’inscrit dans une certaine logique de développement industriel, le défi était de taille et la question posée en apparence simple : peut-on faire mieux que l’imatinib (voir Encadré) ? En effet, les résultats de l’étude IRIS (international randomised study of interferon and STI571), débutée en 2001 et qui comparait de manière randomisée chez 1 106 patients présentant une LMC-PC au diagnostic l’imatinib au traitement médical de référence de l’époque, l’association interféron alpha plus aracytine à faible dose, ont consacré l’imatinib comme traitement de référence de première ligne de la maladie [
3]. Le suivi à 6 ans des patients traités dans le bras imatinib de l’étude montre que 63 % des patients traités d’emblée par imatinib sont toujours traités dans le cadre de l’étude par imatinib. S’y associent un meilleur taux cumulatif de réponse cytogénétique complète de 82 %, une survie sans progression de 93 % et une survie globale de 88 % (95 % si l’on ne considère que les décès en rapport avec la maladie) [
4]. Dès 2004, d’autres inhibiteurs oraux de l’activité tyrosine kinase d’ABL vont émerger. Parmi ceux-ci, le nilotinib et le dasatinib, dont l’effet anti-leucémique est plus marqué in vitro que celui de l’imatinib, vont rapidement s’imposer comme une option thérapeutique majeure chez les patients résistants ou intolérants à l’imatinib [
5,
6]. L’absence d’intolérance croisée entre ces deux molécules et l’imatinib, leur efficacité en cas de mutation du domaine tyrosine kinase d’ABL - principale cause de résistance à l’imatinib identifiée à ce jour [
11] - rendent compte de leur efficacité dans ces situations. La question de l’intérêt de ces deux molécules dans le traitement de la maladie, et ce dès le diagnostic, va être rapidement soulevée par les premiers résultats des essais de phase II, montrant des taux et une rapidité de réponse, tant sur le plan cytogénétique que moléculaire, largement supérieurs à ceux historiquement observés avec l’imatinib [
7–
9]. La comparaison prospective et randomisée s’imposait. Deux essais cliniques internationaux nous livrent leurs premiers résultats.

|
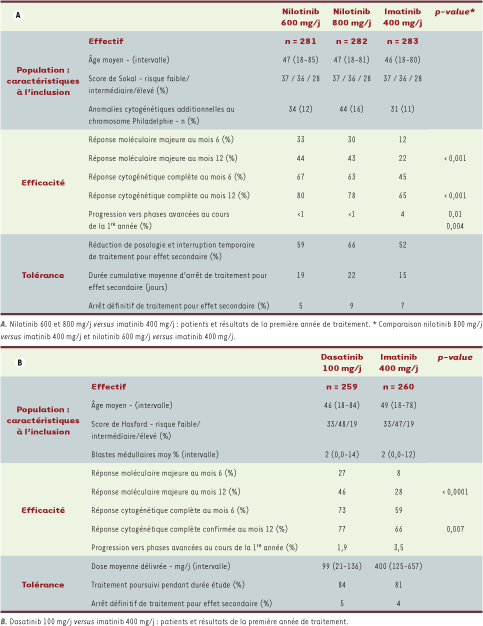
Critères d’évaluation de l’efficacité des nouveaux inhibiteurs de l’activité tyrosine kinase Imatinib versus Nilotinib L’objectif de l’essai était de comparer l’efficacité de l’imatinib (400 mg/j) à celle du nilotinib (administré aux posologies de 600 mg/j ou 800 mg/j) chez des patients présentant une LMC-PC au diagnostic. Le critère principal de jugement était le taux de réponse moléculaire majeure, définie par une diminution supérieure ou égale à 3 log du taux de transcrits BCR-ABL, au terme de la première année de traitement. L’étude a inclus 846 patients. Les caractéristiques des patients et les principaux résultats sont présentés dans le Tableau IA.
 | Tableau I
Résultats des essais cliniques comparant le nilotinib et le dasatinib à l’imatinib chez des patients présentant une leucémie myéloïde chronique en phase chronique au diagnostic : patients et résultats au terme de la première année de traitement (d’après [ 1, 2]). |
Imatinib versus Dasatinib L’objectif de l’essai était de comparer l’efficacité de l’imatinib (400 mg/j) au dasatinib à la posologie de 100 mg/j chez des patients présentant une LMCPC au diagnostic. Le critère principal de jugement était le taux de réponse cytogénétique complète confirmée, définie par l’absence de détection du chromosome Philadephie à l’examen cytogénétique des métaphases de cellules médullaires à 28 jours d’intervalle, au terme de la première année de traitement. L’étude a inclus 519 patients. Les caractéristiques des patients et les principaux résultats sont présentés dans le Tableau IB.
Avec un an de suivi minimum pour la totalité des patients, ces deux études montrent la supériorité des inhibiteurs de tyrosine kinase de « deuxième génération » nilotinib et dasatinib sur l’imatinib tant en termes de réponse cytogénétique complète que de réponse moléculaire majeure dès la fin de la première année de traitement, et ce pour tous les sous-groupes de patients définis par les scores de Sokal ou de Hasford. Le risque de progression vers les phases accélérée ou blastique de la maladie apparaît également inférieur chez les patients traités par nilotinib et dasatinib. Par ailleurs, aucune progression de la maladie n’a été observée chez les patients ayant obtenu une réponse moléculaire majeure sous traitement. Si l’efficacité de ces deux molécules semble proche au vu de ces résultats préliminaires, leur profil de tolérance diffère quelque peu. Ainsi la toxicité hématologique apparaît plus fréquente et plus marquée chez les patients traités par dasatinib, les éruptions cutanées et les perturbations des enzymes hépatiques et pancréatiques plus fréquentes chez les patients traités par nilotinib, la posologie de 600 mg/j étant globalement mieux supportée. L’incidence et la gravité des épanchements pleuraux sous dasatinib apparaissent, avec un an de recul, inférieures aux données précédemment rapportées [9]. |
Et maintenant, quelle démarche thérapeutique ? Au-delà des différences méthodologiques et de présentation des résultats entre ces deux essais, la supériorité démontrée des inhibiteurs de tyrosine kinase de deuxième génération sur l’imatinib pose dans cette indication plusieurs questions de fond :
-
la rapidité d’efficacité de ces nouvelles molécules se traduira-t-elle par un bénéfice durable pour les patients ? Le suivi médian pour l’instant court le suggère, montrant un taux de progression vers les phases avancées de la maladie inférieur à celui observé sous imatinib et ce dès la fin de la première année de traitement ;
-
quels seront, à efficacité équivalente, les déterminants du choix de l’une ou l’autre de ces molécules si leur supériorité sur l’imatinib se confirme et valide leur utilisation dans cette indication ? Nul doute que leur profil de tolérance respectif et leur coût pour la collectivité seront des arguments de poids.
L’avenir proche ne manquera pas de répondre à ces questions. Après dix ans d’un succès thérapeutique inégalé, la suprématie de l’imatinib est remise en cause. Au-delà d’une compétition industrielle intense, ces deux essais thérapeutiques internationaux menés en parallèle confirment l’intérêt toujours vif porté à une maladie rare mais néanmoins modèle. |
les auteurs déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
1. Saglio G, Kim DW, Issaragrisil S, et al. Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med 2010 ; 362 : 2251-9. 2. Kantarjian H, Shah NP, Hocchaus A, et al. Dasatinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2010 ; 362 : 2260-70. 3. O’Brien SG, Guilhot F, Larson RA, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2003 ; 348 : 994-1004. 4. Hochhaus A, O’Brien SG, Guilhot F, et al. Six-year follow-up of patients receiving imatinib for the first-line treatment of chronic myeloid leukemia. Leukemia 2009 ; 23 : 1054-61. 5. Kantarjian H, Giles F, Wunderle L, et al. Nilotinib in imatinib-resistant CML and Philadelphia chromosome-positive ALL. N Engl J Med 2006 ; 354 : 2542-51. 6. Talpaz M, Shah NP, Kantarjian H, et al. Dasatinib in imatinib-resistant Philadelphia chromosome-positive leukemias. N Engl J Med 2006 ; 354 : 2531-41. 7. Rosti G, Palandri F, Castagnetti F, et al. Nilotinib for the frontline treatment of Ph+ chronic myeloid leukemia. Blood 2009 ; 114 : 4933-8. 8. Cortes JE, Jones D, O’Brien S, et al. Nilotinib as front-line treatment for patients with chronic myeloid leukemia in early chronic phase. J Clin Oncol 2010 ; 28 : 392-7. 9. Cortes JE, Jones D, O’Brien S, et al. Results of dasatinib therapy in patients with early chronic-phase chronic myeloid leukemia. J Clin Oncol 2010 ; 28 : 398-404. 10. Turhan A. Imatinib mesylate: a major breakthrough in the treatment of chronic myelogenous leukemia. Med Sci (Paris) 2003 ; 19 : 667-8 11. Roche-Lestienne C, Mahon FX, Preudhomme C. Origin of resistance to Imatinib mesylate: lessons learned from this experience. Med Sci (Paris) 2004 ; 20 : 1125-30 |