| |
| Med Sci (Paris). 2010 November; 26(11): 930–935. Published online 2010 November 15. doi: 10.1051/medsci/20102611930.Résistance aux antibiotiques chez les bactéries d’origine animale Actions en cours dans le secteur vétérinaire Pascal Sanders* Agence Nationale de Sécurité Sanitaire (ANSES),
Alimentation-Environnement-Travail Laboratoire de Fougères, La Haute Marche, F-35305 Fougères, France |
Progrès majeur en médecine pour le traitement chez l’homme et chez l’animal des infections bactériennes, les antibiotiques ont été également utilisés à des fins zootechniques comme facteurs de croissance. La prise de conscience dans les années 1990 des risques pour la santé publique associés au développement de la résistance aux antibiotiques a amené a une révision des politiques d’usage des antibiotiques dans l’Union européenne. Ces derniers sont aujourd’hui strictement utili Depuis le 1er juillet 2010, l’AFSSA (Agence française de sécurité sanitaire des aliments) est devenue l’ sés à des fins thérapeutiques et prophylactiques, sous prescription vétérinaire. Au cours de ces dix dernières années, des progrès ont été réalisés dans la collecte d’informations sur leur utilisation et sur la surveillance de la résistance chez les bactéries pathogènes des animaux, chez les bactéries zoonotiques et chez des bactéries dites indicatrices. Notre propos est de présenter les modalités de cette surveillance, les principales données en matière de résistance aux antibiotiques, les risques associés à l’usage des antibiotiques chez les animaux et les actions destinées à promouvoir leur usage prudent. À la suite de leur découverte au milieu du XXe siècle, les antibiotiques ont été rapidement utilisés sous forme de médicaments vétérinaires parallèlement à leur utilisation médicale. Les réglementations se sont développées pour encadrer le développement pharmaceutique des médicaments vétérinaires en garantissant leur qualité, leur sécurité (pour l’animal, l’utilisateur et le consommateur) et leur efficacité. Dans l’Union européenne, la réglementation est harmonisée et équivalente à celle qui est appliquée au médicament destiné à l’homme sous l’égide de l’Agence européenne du médicament. En France, l’Agence nationale du médicament vétérinaire (ANMV) au sein de l’Agence nationale de sécurité sanitaire (ANSES) délivre les autorisations de mise sur le marché (AMM). Dans les années 1950, en souhaitant exploiter les sous-produits de fermentation des organismes producteurs d’antibiotiques, l’industrie pharmaceutique a proposé leur usage comme additif à l’alimentation animale, conduisant à la découverte fortuite de leur effet bénéfique sur la croissance des animaux dans une phase de développement de l’élevage dit « industriel ». Les études menées à l’époque ont montré l’effet « facteur de croissance » associé à des faibles teneurs en antibiotiques. Ces découvertes ont conduit à utiliser les antibiotiques comme additifs à l’alimentation animale. Très rapidement dans la communauté européenne, cet usage a été limité à quelques molécules actives sur les bactéries de coloration Gram positif à la suite d’une première prise de conscience des risques sanitaires [
1]. À la demande de la Suède, lors de son entrée dans l’Union européenne, cet usage a été révisé et suspendu en 1997 pour l’avoparcine (de la famille des glycopeptides), en 1998 pour l’ardacine, en 1999 pour la virginiamycine (de la famille des streptogramines), de la spiramycine, du phosphate de tylosine (macrolides) et de la bacitracine zinc et enfin en 2006 pour l’avilamycine et le flavophospholipol. Seules les molécules antibiotiques ionophores actives contre les coccidies restent aujourd’hui autorisées comme additifs à l’alimentation animale en tant qu’anticoccidiens après une évaluation du risque par l’Autorité européenne de sécurité des aliments (EFSA). |
Utilisation des antibiotiques chez les animaux Aujourd’hui en Europe, les antibiotiques sont utilisés comme médicaments vétérinaires et soumis à prescription vétérinaire pour les animaux producteurs de denrées alimentaires et les animaux de compagnie. Leurs indications thérapeutiques et prophylactiques sont le traitement et la prévention des infections bactériennes. L’application thérapeutique concerne des animaux présentant des signes cliniques de maladies pouvant être d’étiologie bactérienne. Dans les productions animales où des groupes d’animaux de même âge sont élevés ensemble, des traitements antibiotiques prophylactiques sont prescrits par les vétérinaires sur la base de leur connaissance épidémiologique des infections bactériennes récurrentes de l’élevage. Dans ces situations, le vétérinaire doit définir avec l’éleveur des mesures d’amélioration zootechniques, hygiéniques (barrière sanitaire, désinfection) et médicales (vaccination) pour réduire ce type d’utilisation des antibiotiques. De même, en cas de diagnostic d’une maladie infectieuse sur une partie des animaux, le vétérinaire peut mettre en œuvre un traitement antibiotique collectif du groupe dit de contrôle ou métaphylactique. Une étude comparative des molécules autorisées comme médicament pour l’homme et pour les animaux, en France, montrait que les principales familles antibiotiques étaient partagées [
2] par les deux médecines. L’étude comparaît les tonnages consommés chaque année. Sur la période de 1999 à 2005, la quantité totale d’antibiotiques utilisés comme médicaments vétérinaires représentait 60 % du tonnage total. La famille des bêta-lactamines représentait 50 % de la quantité totale d’antibiotiques utilisée chez l’homme tandis que les tétracyclines représentaient 50 % de la consommation totale chez l’animal. Les auteurs soulignaient la difficulté qu’il y a à comparer des indicateurs de natures très différentes entre l’homme et l’animal du fait de la diversité des espèces cibles (bovins, porcins, volailles, ovins, caprins, équins, chiens, chats, poissons) et des posologies des traitements. Si, chez l’homme, des indicateurs d’exposition tels que la dose définie journalière sont établis et harmonisés internationalement, de tels indicateurs font l’objet de débats et ne sont pas harmonisés au niveau vétérinaire [
3,
4]. |
Surveillance de la résistance aux antibiotiques En France, la surveillance de la résistance aux antibiotiques est réalisée avec trois outils complémentaires s’inscrivant pour une partie dans une démarche de surveillance européenne harmonisée. Le réseau de laboratoires «Resapath» (Réseau de surveillance de l’antibiorésistance des bactéries pathogènes) Animé par les laboratoires de l’AFSSA de Ploufragan et de Lyon, ce réseau collecte les données sur la résistance aux antibiotiques chez des bactéries isolées d’animaux malades dans le cadre du diagnostic bactériologique vétérinaire réalisé par la cinquantaine de laboratoires publics et privés membres du réseau. Ces antibiogrammes sont réalisés par la méthode par diffusion en gélose, en respectant les principes techniques décrits dans la norme U47-107 et sont interprétés selon les recommandations du groupe de travail vétérinaire du comité de l’antibiogramme de la Société française de microbiologie. La réalisation de ces analyses est encadrée par des démarches de contrôle qualité interne et de participation à des essais d’aptitude externe, contribuant à la qualité des données générées par le réseau. Les données sont analysées et rapportées aux membres du réseau et communiquées sous forme de rapports par l’ANSES [
5,
6]. Le Resapath fait partie de l’ONERBA 1. Actuellement en Europe, des surveillances équivalentes existent dans quelques États membres mais ce type de surveillance ne fait pas l’objet d’une coordination européenne. Depuis 1999, les plans de surveillance annuels mis en place par la Direction générale de l’alimentation (ministère de l’Agriculture), en collaboration avec les laboratoires de l’ANSES de Fougères, de Lyon et de Ploufragan, permettent la récolte, à l’abattoir, des fèces ou caeca d’animaux sains des filières bovine, porcine et aviaire (poulet de chair, dinde), desquels sont isolées des souches de bactéries sentinelles (Escherichia coli, Enterococcus sp.) ou responsables de zoonoses (Campylobacter sp.). Ces plans s’inscrivent aujourd’hui dans le cadre de la directive 2003/99 sur la surveillance des zoonoses et des agents zoonotiques. Les concentrations minimales inhibitrices (CMI) de ces souches sont déterminées vis-a-vis d’un panel d’antibiotiques défini au niveau européen [
7,
8]. Les données issues de ce plan sont ensuite collectées et analysées au niveau européen par l’Autorité européenne de sécurité des aliments (EFSA). Les souches sont analysées par des méthodes standardisées de détermination des CMI et les interprétations sont établies selon le référentiel établi par l’EFSA. Les laboratoires de l’ANSES ont été désignés laboratoire national de référence pour cette surveillance et collaborent avec le laboratoire de référence de l’Union européenne qui organise annuellement des essais de contrôle qualité externe [
9]. Les laboratoires de l’AFSSA collaborent avec les centres nationaux de référence pour comparer, pour chaque espèce bactérienne, les souches isolées chez l’homme et chez l’animal et contribuer ainsi aux évaluations de risque [
10,
11]. La résistance aux antibiotiques des salmonelles isolées d’animaux, de produits animaux ou de leur environnement est surveillée par l’ANSES-Lerqap (Maisons-Alfort) selon deux modalités dépendant du contexte du prélèvement. La première approche s’appuie sur un réseau d’épidémio-surveillance animé par l’ANSES-Lerqap depuis 1997 [
12]. Un antibiogramme par diffusion en gélose est réalisé sur une partie des souches collectées par le réseau. Cette surveillance alimente une base de données sur les salmonelles isolées de tous les secteurs de la chaîne agroalimentaire. Il s’agit d’une surveillance passive, reposant sur le volontariat de laboratoires d’analyses (139 laboratoires privés et publics en 2008) transmettant a l’ANSES des souches de Salmonella accompagnées d’informations épidémiologiques caractérisant le prélèvement. Cette surveillance qualitative s’attache principalement a détecter l’émergence de nouvelles résistances d’intérêt pour la santé publique et de suivre les tendances en matière d’évolution de la résistance dans les principaux sérotypes. La deuxième modalité de surveillance Elle repose sur un système de surveillance active, mis en place depuis 2008 en collaboration avec le laboratoire national de référence (LNR) Salmonella (ANSES de Ploufragan) et les services de contrôles vétérinaires. Il s’agit de la surveillance de souches isolées dans le cadre des programmes officiels de maîtrise de Salmonella en élevage ou issues des enquêtes de prévalence communautaires ou des plans de surveillance nationaux relatifs a certaines denrées alimentaires. Ces données quantitatives sont transmises annuellement a l’EFSA. Les collaborations avec le Centre national de référence (Institut Pasteur) et l’Institut de veille sanitaire permettent d’enquêter sur les toxi-infections alimentaires collectives et de comparer régulièrement les taux de résistance des souches isolées chez l’homme, l’animal et les produits animaux [
13,
14]. Études de prévalence Des études de prévalence peuvent être également mises en place pour étudier plus particulièrement une espèce bactérienne et un profil de résistance particulier. C’est le cas par exemple des études menées sur la présence de Staphylococcus aureus résistant a la méticilline (SARM) en production porcine dans le cadre d’un programme de surveillance européen coordonné par l’EFSA [
15,
31] (→)
(→) Voir l’article de Oana Dumitrescu et al., page 943 de ce numéro,
|
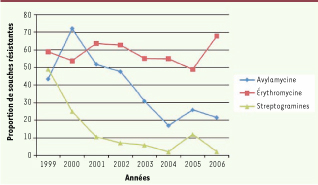
Effet des politiques européennes sur l’usage et la résistance aux antibiotiques Relations entre l’usage d’un antibiotique dans un élevage et l’émergence de souches résistantes À la suite de l’arrêt de l’utilisation des antibiotiques comme additifs a l’alimentation animale (facteurs de croissance), l’effet de cette politique a pu être mesuré sur le taux de résistance des souches d’ Enterococcus faecium isolées a l’abattoir a partir des fèces de porcs ou de caeca de poulets (Figure 1). Une réduction de la résistance aux streptogramines a été observée après le retrait de la virginiamycine, fin 1998, et on note une réduction de la résistance a l’avilamycine a partir de 2001 du fait de l’anticipation par les producteurs de son arrêt d’utilisation programmée pour 2005 [ 15]. Malgré l’arrêt d’utilisation, en 1998, de deux macrolides (spiramycine et phosphate de tylosine), la résistance a l’érythromycine (marqueur pour cette classe) est restée stable sans évolution vers la réduction car ces molécules continuent d’être utilisées comme médicament vétérinaire (Figure 1). Ces résultats observés en France sont comparables a ceux observés au Danemark, pays pionnier dans la mise en œuvre de dispositifs de surveillance. Les souches ont été isolées de caecums de poulet après arrêt de l’utilisation de facteurs de croissance de la famille des macrolides et streptogramines (spiramycine, tylosine, virginiamycine, 1998) et de l’avilamycine (données de 2005).  | Figure 1 Évolution du pourcentage de résistance des souches d’Enterococcus faecium. |
L’enseignement tiré de ces études est que l’obtention d’une réduction d’un taux de résistance nécessite plusieurs années après l’arrêt de l’utilisation quelle que soit la production animale. La réduction de ce taux de résistance ne signifie pas la disparition de souches résistantes au sein des élevages. En effet, des isolats résistants sont encore ponctuellement détectés et la présence de souches résistantes résidentes peut être mise en évidence avec l’utilisation de milieux sélectifs. Des souches résistantes continuent donc a résider dans les élevages et leur environnement. Les données collectées au niveau français en aviculture ont permis d’étudier plus en détail la relation existant entre l’usage d’un antibiotique dans un élevage et la probabilité d’isoler une souche résistante a cet antibiotique dans le même élevage [
16]. L’usage d’un antibiotique dans un élevage sur un lot d’animaux est effectivement un facteur de risque d’isolement d’une souche résistante au même antibiotique [
17]. L’étude met en évidence que cet usage est aussi un facteur de risque d’isoler des souches résistantes a d’autres familles d’antibiotiques. Ce phénomène est associé au fait qu’une souche bactérienne peut être résistante simultanément a plusieurs familles d’antibiotiques (multirésistance) et que l’usage d’un antibiotique cosélectionnera la résistance aux autres familles d’antibiotiques, contribuant a enrichir progressivement la population bactérienne en souches multirésistantes [
32] (→). Quel que soit l’antibiotique util isé, il contribue donc globalement a la sélection de souches résistantes.
(→) Voir l’article de Patrice Nordmann, page 950 de ce numéro
Détection de nouveaux phénotypes de résistance Les dispositifs de surveillance nationaux ont également contribué adétecter l’apparition récente de nouveaux hénotypes de résistance chez E. coli. Ainsi l’émergence de souches porteuses de bêta-lactamases a spectre étendu (BLSE) a été observée d’abord chez les isolats cliniques d’E. coli recueillis par le réseau Resapath [
18] puis, peu après, par les dispositifs de surveillance a l’abattoir [32] (→). Les taux de résistance au céfotaxime chez E. coli augmentent très rapidement en production avicole, puisque ce type de résistance n’était pas observé avant 2005 et concernait plus de 4 % des souches isolées des caeca de poulets de chair prélevés aléatoirement a l’abattoir en 2007. Il faut noter que les céphalosporines ne sont pas autorisées chez la volaille et que le phénomène observé signe probablement un usage hors AMM des céphalosporines, probablement sous forme d’injection in ovo [
19,
20]. Ce type de pratique révèle un usage imprudent mais toutefois possible en médecine vétérinaire dans le cadre de l’application de la « cascade » 2 du fait qu’un faible nombre de molécules antibiotiques est autorisé chez les poules pondeuses. Les risques associés a l’émergence de ce nouveau phénotype de résistance sont de deux types : pour la santé animale, il s’agit d’un risque de perte d’efficacité clinique des bêta-lactamines utilisées comme traitement de colibacilloses chez les animaux avec la possibilité d’avoir des souches multirésistantes impossibles a traiter ; pour la santé publique, la diffusion vers l’homme de salmonelles résistantes et/ou de gènes de résistance transmissibles soit par contact avec les animaux soit via l’alimentation. Cette évaluation du risque doit s’effectuer dans le contexte d’un développement de la résistance chez E. coli en médecine de ville. En effet, une grande partie des E. coli présents dans la flore intestinale humaine ont pour origine notre alimentation [
21]. Certaines de ces souches pourraient être responsables d’infections urinaires [
22] ou transmettre leur gène de résistance a des souches d’entérobactéries (E. coli, Salmonella sp., Proteus sp., Klebsiella sp.) pathogènes pour l’homme [
23]. La surveillance des phénotypes de résistance doit être combinée a l’identification précise des génotypes de résistance et du typage clonal des souches pour déterminer la part relative de ce risque associée aux usages vétérinaires et celle qui est associée aux pratiques médicales [ 32,
33] (→).
(→) Voir l’article de Patrice Nordmann, page 950 de ce numéro
(→) Voir l’article de Patrice Nordmann, page 950 de ce numéro et l’article de Vincent Cattoir et Roland Leclercq, page 936 de ce numéro
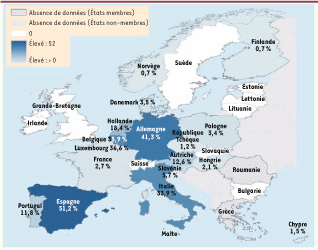
Ces dernières années, les études menées dans l’Union européenne ont montré la présence de souches de Staphylococcus aureus résistantes a la méticilline (SARM) chez l’animal, notamment chez le porc. De nombreuses études menées aux Pays-Bas et en Allemagne ont contribué a mieux caractériser ce risque. La plupart des souches font partie d’un complexe clonal particulier (CC398) présent en portage chez le porc et d’autres espèces animales avec risque de portage des personnes travaillant au contact des animaux (éleveur, vétérinaire, personnel d’abattoir). La mise en évidence de ce portage dans le nord de l’Europe (Pays-Bas, Belgique, Allemagne, Danemark) a conduit a une enquête de prévalence dans l’Union européenne [
24]. Cette étude montre des prévalences très différentes entre les États membres reflétant une situation épidémiologique très différente entre ces États allant d’une absence de mise en évidence à une présence dans les poussières de plus de la moitié des élevages prélevés (Figure 2). Cette forte variation ne serait pas le reflet des usages antibiotiques mais des pratiques d’élevage, notamment des échanges d’animaux entre les élevages. La présence de ces souches chez l’homme est un facteur de risque pour le porteur car ces souches ont un génotype de résistance aux antibiotiques qui les rend plus difficiles à traiter en cas d’infection (→). Le risque potentiel pour la santé publique est que ces souches acquièrent des facteurs de virulence les rendant plus pathogènes pour l’homme [24] ou pour les animaux. L’évaluation du risque est différente selon la situation épidémiologique vis-à-vis du SARM à l’hôpital(→) Dans les pays à faible incidence du SARM à l’hôpital comme les Pays-Bas, elle conduit à définir comme populations à risque les personnes travaillant auprès des animaux (vétérinaire, éleveur) et leurs familles [
25].  | Figure 2Prévalence des SARM ^Staphylococcus aureus résistant à la méticilline) dans la poussière des élevages de porcs hébergeant des animaux reproducteurs (reproduit de [ 15], données de l’Union européenne). Les données des DOM-TOM n’ont pas été indiquées.
http://www.efsa.europa.eu/en/efsajournal/scdoc/1376.htm
|
(→) Voir l’article de Patrice Nordmann, page 950 de ce numéro
(→) Voir l’article de Oana Dumitrescu et al., page 943 de ce numéro
Démarches pharmaco-épidémiologiques de surveillance Parallèlement au renforcement des dispositifs de surveillance et à l’harmonisation technique, des réflexions ont été menées au niveau international pour évaluer les risques pour la santé publique. Dans ce cadre, des organisations internationales (OMS, OIE, FAO) 3, des travaux ont été menés pour mieux caractériser les risques associés à la présence de bactéries résistantes aux antibiotiques et la notion d’antibiotiques critiques a été définie pour la médecine humaine et pour la médecine vétérinaire [
26]. Plusieurs classes d’antibiotiques sont définies comme antibioti-ques critiques pour les deux médecines démontrant l’importance du partage d’un même arsenal thérapeutique. Le développement des démarches pharmaco-épidémiologiques de surveillance de l’usage vétérinaire des antibiotiques doit être combiné au renforcement des outils épidémiologiques de surveillance de la résistance [
27]. Ces sources de données sont nécessaires pour les évaluations du risque, la communication avec les gestionnaires et pour choisir et évaluer l’effet des mesures de gestion de risque. Ces mesures doivent favoriser l’usage prudent des antibiotiques et peuvent concerner l’encadrement de la prescription vétérinaire. Elles sont basées sur le renforcement des règles de biosécurité des élevages et peuvent conduire à modifier le contrôle des échanges commerciaux des animaux [
28] ou des denrées alimentaires [
29] en étant proportionnées aux enjeux de santé publique. |
Depuis 1999, les outils de surveillance nationaux et européens de la résistance aux antibiotiques se sont structurés et sont coordonnés. La résistance aux antibiotiques fait désormais partie du contrôle des zoonoses. Parallèlement, le recueil de données sur l’usage des antibiotiques a progressé dans plusieurs États membres mais est incomplet en comparaison du travail de structuration réalisé pour l’usage chez l’homme [
30]. Le mandat a été récemment donné à l’Agence européenne du médicament de développer un outil européen de collecte de données en matière d’usage vétérinaire auprès des États membres. Un travail très important reste cependant à réaliser pour définir un ou des indicateurs de mesure de cet usage, pertinents en santé animale pour comparer les pratiques. Si le retrait des antibiotiques utilisés comme facteurs de croissance a été suivi d’un effet démontré sur le taux de résistance chez Enterococcus sp, les bénéfices en termes de santé publique restent controversés car difficiles à estimer. Via la structuration des dispositifs de surveillance de la résistance aux antibiotiques, la vigilance a été renforcée. Ainsi, il est aujourd’hui possible d’étudier, a l’échelle européenne, l’émergence de nouveaux phénotypes de résistance et d’en estimer la prévalence [15]. Les instances nationales, européennes et internationales peuvent donc mieux évaluer le risque associé. Il s’agit désormais de mieux sensibiliser et mobiliser les décideurs dans les filières de production animale pour soutenir l’appropriation et l’application des concepts d’usage prudent avec un objectif partagé : préserver l’efficacité des antibiotiques. Des démarches adaptées au contexte de la médecine vétérinaire chez les animaux de compagnie (chiens, chats, etc.) et de loisirs (chevaux) sont également a encourager. Pour atteindre cet objectif, les ministères de l’agriculture et de la santé travaillent avec la profession vétérinaire pour développer un plan d’action miroir a celui existant dans le monde médical. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Swann M. Report of the Joint Committee on the use of antibiotics in animal husbandry and veterinary medicine. London : Her Majesty’s Stationary Office, 1969. 2. Moulin G, Cavalie P, Pellanne I, et al. A comparison of antimicrobial usage in human and veterinary medicine in France from 1999 to 2005. J Antimicrob Chemother 2008; 62 : 617-25. 3. Chauvin C, Madec F, Guittet M, Sanders P. Pharmaco-epidemiology and -economics should be developed more extensively in veterinary medicine. J Vet Pharmacol Ther 2002; 25 : 455-9. 4. Grave K, Fr0kjœr V, Mcewen S, Kruse H. Monitoring of antimicrobial drug usage in animals: methods and applications. In : Aarestrup FM ed. Antimicrobial resistance in bacteria of animal origin. Washington : ASM Press, 2006 : 375-95. 5. Jouy E, Meunier D, Martel J, et al. Méthodologie du Réseau national de surveillance de la résistance aux antibiotiques chez les principales bactéries pathogènes des animaux de rente (Resapath). Bulletin de l’Académie vétérinaire pratique de France 2002; 155 : 259-66. 6. Chazel M, Jouy E, Meunier D, et al. Resapath : réseau d’épidémiosurveillance de l’antibiorésistance des bactéries pathogènes animales. Bulletin Epidémiologique 2009; 34 : 7-8. 7. EFSA (Autorité européenne de sécurité des aliments). Report from the task force on zoonoses data collection including guidance for harmonized monitoring and reporting of antimicrobial resistance in commensal Escherichia coli and Enterococcus spp. from food animals. The EFSA Journal 2008; 141 : 144 ( http://www.efsa.europa.eu/en/efsajournal) 8. EFSA. Report of the task force of zoonoses data collection including a proposal for a harmonized monitoring scheme of antimicrobial resistance in Salmonella in fowl ( Gallus gallus), turkeys, and pigs and Campylobacter jejuni and C. coli in broilers. The EFSA Journal 2007; 96 : 1-46 ( http://www.efsa.europa.eu/en/efsajournal). 9. Aarestrup F, Battisti A, Bengtsson B, et al. Harmonized monitoring of antimicrobial resistance in Salmonella and Campylobacter isolates from food animals in the European Union. Clin Microbiol Infect 2008; 14 : 522-33. 10. Denis M, Chidaine B, Laisney MJ, et al. Comparison of genetic profiles of Campylobacter strains isolated from poultry, pig and Campylobacter human infections in Brittany. Pathol Biol (Paris) 2009; 57 : 23-9. 11. Petsaris O, Miszczak F, Gicquel-Bruneau M, et al. Combined antimicrobial resistance in Enterococcus faecium isolated from chickens. Appl Environ Microbiol 2005; 71 : 2796-9. 12. Brisabois A, Cazin I, Breuil J, Collatz E. Surveillance of antibiotic resistance in Salmonella. Euro Surveill 1997; 2 : 19-20. 13. Egorova S, Timinouni M, Demartin M, et al. Ceftriaxone-resistant salmonella enterica serotype Newport, France. Emerg Infect Dis 2008; 14 : 954-7. 14. Weill FX, Lailler R, Praud K, et al. Emergence of extended-spectrum-betalactamase (CTX-M-9)-producing multiresistant strains of Salmonella enterica serotype Virchow in poultry and humans in France. J Clin Microbiol 2004; 42 : 5767-73. 15. EFSA. Analysis of the baseline survey on the prevalence of methicillin-resistant Staphylococcus aureus (MRSA) in holdings with breeding pigs, in the EU, 2008, part A : MRSA prevalence estimates; on request from the European Commission. EFSA Journal 2009; 7 : 1376. doi:10.2903/j.efsa.2009.1376. ( http://www.efsa.europa.eu/en/efsajournal/scdoc/1376.html) 16. Chauvin C, Bouvarel I, Beloeil PA, et al. A pharmaco-epidemiological analysis of factors associated with antimicrobial consumption level in turkey broiler flocks. Vet Res 2005; 36 :199-211. 17. Chauvin C, Clement C, Bruneau M, Pommeret D. Time-patterns of antibiotic exposure in poultry production– a Markov chains exploratory study of nature and consequences. Prev Vet Med 2007; 80 : 230-40. 18. Meunier D, Jouy E, Lazizzera C, et al. CTX-M-1and CTX-M-15-type betalactamases in clinical Escherichia coli isolates recovered from food-producing animals in France. Int J Antimicrob Agents 2006; 28 : 402-7. 19. Dutil L, Irwin R, Finley R, et al. Ceftiofur resistance in Salmonella enterica serovar Heidelberg from chicken meat and humans, Canada. Emerg infect Dis 2010 : 16 : 48-54. 20. Hofacre CL. Antimicrobial drug use in poultry. In : Prescott JF, Baggot JD, Walker RD, eds. Antimicrobial therapy in veterinary medicine. Ames, IA : Iowa State University Press, 2000 : 545-53. 21. Corpet DE. Antibiotic residues and drug resistance in human intestinal flora. Antimicrob Agents Chemother 1987; 31 : 587-93. 22. Trobos M, Jakobsen L, Olsen KEP, et al. Prevalence of sulphonamide resistance and class 1 integron genes in Escherichia coli isolates obtained from broilers, broiler meat, healthy humans and urinary infections in Denmark. Int J Antimicrob Agents ; 32 : 367-9. 23. Weill FX, Lailler R, Praud K, et al. Emergence of extended-spectrum-betalactamase (CTX-M-9)-producing multiresistant strains of Salmonella enterica serotype Virchow in poultry and humans in France. J Clin Microbiol 2004; 42 : 5767-73. 24. Wulf M, Voss A. MRSA in livestock animals. An epidemic waiting to happen ? Clin Microbiol infect 2008; 14 : 519-21. 25. Voss A, Loeffen F, Bakker J, et al. Methicillin-resistant Staphylococcus aureus in pig farming. Emerg Infect Dis 2005; 11 : 1965-6. 28. OIE (Organisation internationale des épizooties). Terrestrial animal health code 2008. 29. Codex Alimentarius, Code of practice to minimize and contain antimicrobial resistance, CAC/RCP 61-2005. www.codexalimentarius.net/download/standards/10213/CXP_061e.pdf
30. Goossens H. Antibiotic consumption and link to resistance. Clin Microbiol Infect ; 15 : 12-5. 31. Dumitrescu O, Dauwalder O, Boisset S, et al. Résistance aux antibiotiques chez Staphylococcus aureus : les points-clés en 2010. Med Sci (Paris) 2010; 26 : 943-9. 32. Nordmann P. Résistance aux carbapénèmes chez les bacilles a Gram négatif. Med Sci (Paris) 2010; 26 : 950-9. 33. Cattoir V, Leclercq R. Les entérocoques résistants aux glycopeptides. Med Sci (Paris) 2010; 26 : 936-42. |