| |
| Med Sci (Paris). 2010 November; 26(11): 960–968. Published online 2010 November 15. doi: 10.1051/medsci/20102611960.Multirésistance chez Pseudomonas aeruginosa
Vers l’impasse thérapeutique ? François Barbier and Michel Wolff Service de réanimation médicale et des maladies infectieuses, Hôpital Bichat-Claude Bernard, Assistance publique-Hôpitaux de Paris, 46, rue Henri Huchard, 75018 Paris, France EA3964, faculté de médecine Xavier-Bichat, Université Diderot-Paris 7, Paris, France |
Pseudomonas aeruginosa occupe une position centrale dans la problématique actuelle des infections nosocomiales (IN). Ce bacille à Gram négatif ubiquitaire est responsable de 10 % à 15 % de l’ensemble des infections nosocomiales, une fréquence supérieure étant rapportée chez certaines catégories de patients à haut risque : pathologies broncho-pulmonaires chroniques (notamment la mucoviscidose), immunodépression (neutropénie, syndrome d’immunodéficience acquise), grands brûlés, patients hospitalisés en réanimation [
1–
4]. P. aeruginosa est notamment en cause dans 20 à 30 % des pneumonies acquises sous ventilation mécanique (PAVM). Il est, avec Staphylococcus aureus, le pathogène le plus fréquemment isolé dans cette pathologie [1,
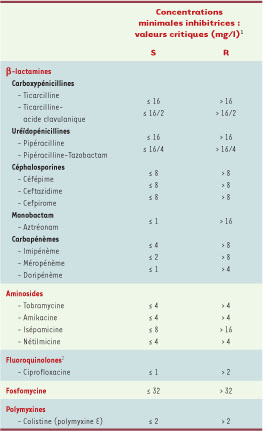
3]. Si la sévérité des infections nosocomiales à P. aeruginosa est conditionnée par la virulence propre à l’espèce et par les comorbidités des patients concernés, elle dépend également de la capacité du pathogène à accumuler les mécanismes de résistance aux antibiotiques et des difficultés thérapeutiques qui en résultent. Ces résistances acquises s’ajoutent aux nombreuses résistances naturelles de l’espèce et peuvent concerner l’ensemble des classes actives sur les souches sauvages (Tableau I).  | Tableau I
Antibiotiques actifs sur les souches sauvages de Pseudomonas aeruginosa. S : sensible ; R : résistant. 1 Selon les recommandations 2009 du Comité de l’antibiogramme de la Société française de microbiologie (www.sfm.asso.fr). 2 Les données sur l’activité de la lévofloxacine sur P. aeruginosa sont insuffisantes pour en recommander l’utilisation dans cette indication. |
La prévalence globale des souches multirésistantes de P. aeruginosa (PAMR) reste actuellement peu élevée, notamment en France, avec d’importantes variations épidémiologiques locales. Elle a cependant augmenté de façon significative au cours des deux dernières décennies, en particulier dans les services de réanimation [4–
7]. La colistine constitue fréquemment la dernière option thérapeutique disponible pour les isolats résistants à toutes les autres molécules. L’objectif de cette revue est de synthétiser les données disponibles sur les mécanismes moléculaires, l’épidémiologie, et les conséquences cliniques et thérapeutiques de la multirésistance chez P. aeruginosa.
|
Multirésistance chez P. aeruginosa : définition et mécanismes En l’absence d’une définition standardisée, la multirésistance chez P. aeruginosa est habituellement décrite comme la résistance ou la diminution de la sensibilité à au moins trois classes d’antibiotiques actifs sur les souches sauvages : (1) β-lactamines hors carbapénèmes (pénicillines, céphalosporines et monobactames) ; (2) carbapénèmes ; (3) fluoroquinolones et (4) aminosides [7–
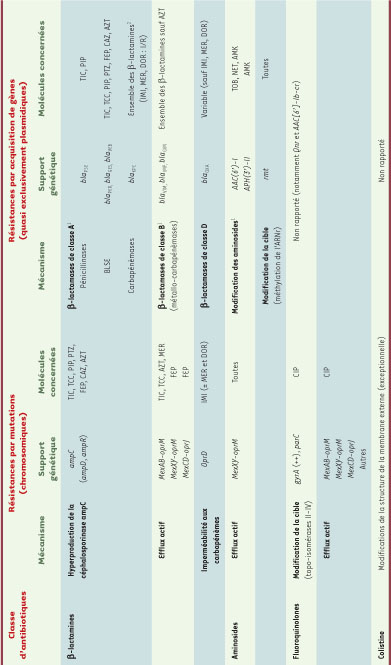
10]. Les principaux mécanismes de résistance acquise sont résumés dans le Tableau II.  | Tableau II
Principaux mécanismes acquis de résistance aux antibiotiques chez Pseudomonas aeruginosa. TIC : ticarcilline ; TCC : ticarcilline-acide clavulanique ; PIP : pipéracilline ; PTZ : pipéracilline-tazobactam ; FEP : céfépime ; CAZ : ceftazidime ; AZT : aztréonam ; MER : méropénème ; IMI : imipénème ; DOR : doripénème ; AMK : amikacine ; TOB : tobramycine ; NET : nétilmicine ; CIP : ciprofloxacine ; BLSE : β-lactamase à spectre élargi ; l/R : sensibilité diminuée ou résistant. 1Seules les enzymes les plus fréquentes sont indiquées. 2Activité variable des inhibiteurs (acide clavulanique, tazobactam). |
Résistance aux β-lactamines Céphalosporinase codée par le gène chromosomique ampC
P. aeruginosa exprime naturellement une céphalosporinase inductible codée par le gène chromosomique ampC, proche de celui qui est retrouvé chez les Enterobacteriaceae du groupe III. Chez les souches sauvages, ampC est réprimé de façon complexe par les produits des gènes qui lui sont associés, ampR et ampD, et n’est que faiblement exprimé [
11]. Son expression peut être fortement induite par certaines P-lactamines, notamment l’imipénème, l’acide clavulanique (à la différence du tazobactam) et les céphamycines. Cette hyperexpression induite et réversible confère une résistance à l’ensemble des pénicillines et des céphalosporines anti- Pseudomonas, et à l’aztréonam. Dans ce cas, seuls les carbapénèmes restent des antibiotiques actifs. Les souches de PAMR surexpriment le plus souvent ampC de façon constitutive et irréversible, conséquence d’une dérépression par mutations de ampC ou de ses gènes régulateurs (principalement ampD). Le profil de résistance conféré est le même que celui qui est observé en cas de surexpression induite : ces mutants déréprimés sont résistants à l’ensemble des β-lactamines à l’exception des carbapénèmes. La fréquence de sélection d’un mutant hyperproducteur d’ampC sous traitement par β-lactamines varie selon les séries entre 15 % et 50 %. Le risque d’échec thérapeutique lié à l’émergence de cette résistance n’est donc pas négligeable et n’est pas complètement contrôlé par l’association avec une autre classe d’antibiotiques (les aminosides notamment) [ 11]. β-lactamases acquises
P. aeruginosa est probablement l’espèce bactérienne pathogène présentant la diversité la plus large en termes de β-lactamases acquises [
12]. Ces enzymes sont quasi exclusivement codées par des plasmides. Les β-lactamases de classe A d’Ambler (sérine-β-lactamases, sensibles aux inhibiteurs) les plus fréquentes chez P. aeruginosa sont celles du groupe PSE (CARB). Il s’agit le plus souvent de pénicillinases à spectre étroit n’hydrolysant que les carboxy- et les uréido-pénicillines, l’activité des inhibiteurs (clavulanate, tazobactam), des céphalosporines, de l’aztréonam et des carbapénèmes étant conservée. De nombreuses β-lactamases à spectre élargi (BLSE) de classe A ont cependant été décrites dans cette espèce. Celles appartenant au groupe PER sont particulièrement répandues, y compris chez les souches multirésistantes épidémiques. Les groupes GES, VEB et IBC sont décrits de façon plus occasionnelle. Les BLSE de types TEM, SHV et CTX-M, endémiques chez les Enterobacteriaceae, sont très rares [
45] (→). Sauf dans des cas exceptionnels (pour GES-2 et imipénème par exemple), ces BLSE de classe A n’hydrolysent pas les carbapénèmes, seule classe d’antibiotique restant active. Cependant, des souches productrices de carbapénémases diffusent actuellement de façon alarmante dans toutes les régions du monde. Si bla
KPC, codant pour une carbapénémase de classe A, a été récemment décrit chez des souches de PAMR, ces carbapénémases appartiennent le plus souvent à la classe B. À l’exception de l’aztréonam, l’ensemble des β-lactamines, y compris les carbapénèmes, sont hydrolysées par ces métallo-β-lactamases, dont VIM et IMP sont les types les plus disséminés. Enfin, des gènes codant pour des β-lactamases de la classe D d’Ambler ( bla
OXA) ont également été décrits chez les PAMR, ces oxacillinases pouvant avoir un spectre d’hydrolyse de type BLSE. (→) Voir l’article de Patrice Nordmann, page 950 de ce numéro
Imperméabilité aux carbapénèmes Le principal mécanisme de résistance aux carbapénèmes chez P. aeruginosa reste l’imperméabilité par mutation inactivatrice d’ oprD, gène codant la protéine D2 [ 11]. La perte de cette porine de la membrane externe confère une résistance de haut niveau à l’imipénème et une diminution variable de la sensibilité au méropénème et au doripénème, mais n’affecte pas l’activité des autres β-lactamines. Le risque de sélection d’un mutant résistant par perte de D2 au cours du traitement d’une infection à P. aeruginosa par imipénème est de l’ordre de 20 à 30 % et ne semble pas significativement réduit par l’association avec un aminoside [
13,
14]. Systèmes d’efflux actif L’hyperexpression acquise des systèmes naturels d’efflux transmembranaire est un mécanisme majeur de multirésistance chez P. aeruginosa [ 11]. Ces systèmes, multiples, déterminent certaines résistances naturelles de l’espèce. Les mutations activatrices portant sur l’opéron MexAB-oprM (expression constitutive faible) sont les plus fréquemment impliquées dans l’émergence de résistances aux β-lactamines. Ce système associe une pompe (MexB), une lipoprotéine de liaison à la membrane (MexA), et la porine (oprM) par laquelle l’antibiotique est expulsé de la cellule. L’hyperexpression de MexAB-oprM confère une diminution de la sensibilité, voire une résistance, à la ticarcilline, à l’aztréonam et au méropénème, l’imipénème n’étant pas un substrat de la pompe MexB. L’hyperexpression du système MexCD-oprJ, plus rare, peut réduire la sensibilité au céfépime. Résistance à la ciprofloxacins La ciprofloxacine est la fluoroquinolone la plus active sur P. aeruginosa, les concentrations minimales inhibitrices (CMI) modales étant de l’ordre de 0,125 à 0,25 mg/l, donc inférieures à celles de la lévofloxacine et très inférieures à celles de l’ofloxacine (1-2 mg/l) [
15]. Les gènes plasmidiques ( Qnr et AAC(6’)Ib-cr) de résistance aux fluoroquinolones décrits chez les Enterobacteriaceae n’ont, à ce jour, pas été décrits chez P. aeruginosa. La résistance à la ciprofloxacine dans cette espèce est exclusivement chromosomique [ 11]. Elle émerge par mutations des gènes des topoisomérases II ( gyrA) et IV ( parC) et/ou de ceux régulant l’expression des systèmes d’efflux. Les mutations de gyrA semblent pouvoir induire seules une résistance de haut niveau. Les systèmes d’efflux actif sont responsables d’une résistance de bas niveau, sauf lorsque leur hyperexpression est associée à des mutations de gyrA et/ou de parC.
Résistance aux aminosides La résistance aux aminosides est liée le plus souvent à l’acquisition d’enzymes inactivatrices (notamment AAC(6’)-I et APH(3’)-II) et/ou d’un efflux actif (MexXYoprM) [ 12]. L’acquisition de plusieurs enzymes peut conférer une résistance croisée à l’ensemble des aminosides. Plus rares sont les résistances de haut niveau dues à l’acquisition de méthylases ( ribosomal methyl transferase ou Rmt) de l’ARNr 16S, cible de cette classe d’antibiotiques. Multirésistance Les souches de PAMR cumulent constamment plusieurs mécanismes de résistance par mutations et acquisitions de gènes. L’analyse moléculaire de souches responsables d’épidémies dans des services de réanimation a par exemple montré l’association d’une dérépression d’ ampC avec la perte de la porine D2 et l’hyperexpression de MexXY-oprM, ou avec l’acquisition d’une carbapénèmase ( bla
VIM, bla
IMP) et d’enzymes inactivant les aminosides [
16–
18]. |
Épidémiologie de la multirésistance chez P. aeruginosa
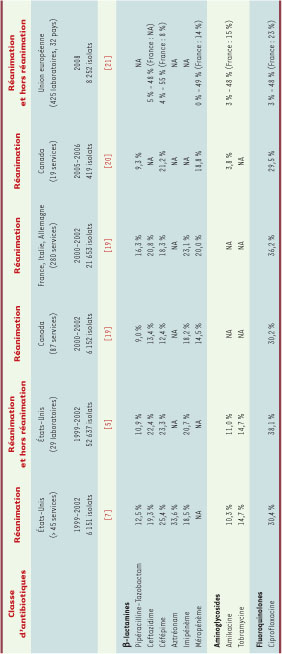
L’épidémiologie de la résistance chez les souches européennes et nord-américaines de P. aeruginosa fait l’objet de publications régulières [
5, 7,
19–
21]. Le Tableau III résume les données multicentriques récentes.  | Tableau III
Fréquences des résistances chez Pseudomonas aeruginosa : données multicentriques récentes (hors mucoviscidose).
|
Dans le rapport de l’European antimicrobial resistance surveillance system (EARSS) pour l’année 2008, les souches multirésistantes représentaient 17 % des 8 252 isolats décrits, toutes infections et origines (pays, services) confondues [21]. Le profil de résistance le plus fréquent (6 % de l’ensemble) était la panrésistance (pipéracilline ± tazobactam, céphalosporines à large spectre, carbapénèmes, aminosides, fluoroquinolones), la colistine n’était pas testée. La prévalence des souches multirésistantes atteignait 30 à 40 % dans certains pays d’Europe de l’Est et en Grèce. En France, elle semble rester stable au cours de la période 2005-2008 (n = 1 110 isolats), de l’ordre de 12 % à 14 %. L’incidence des PAMR dans les services de réanimation est en hausse constante au cours des deux dernières décennies. Dans une étude multicentrique nord-américaine (n = 13 999 isolats), elle a augmenté de 4 % en 1993 à 14 % en 2002 [7]. Cette tendance a été confirmée par d’autres séries [
6,
22]. Des épidémies locales causées par des souches multi- voire panrésistantes sont par ailleurs rapportées de façon croissante [16–18]. Une colonisation bronchique chronique à P. aeruginosa est retrouvée chez environ 40 % des patients atteints de mucoviscidose. La colonisation se fait initialement par des souches environnementales, lesquelles vont ensuite s’adapter à l’hôte en développant des caractères phénotypiques relativement spécifiques à cette population de patients et responsables de la pérennisation de la colonisation : capacité de production du biofilm (rôle de la protéine régulatrice PvrR) et d’alginate (souches « muqueuses ») accrue, diminution de l’expression de la flagelline et de la pilline [
23]. Ce pathogène est le plus fréquemment responsable de surinfections bronchopulmonaires sur ce terrain. L’incidence des résistances, notamment aux aminosides, est en augmentation dans cette population, et la prévalence des souches multirésistantes est actuellement comprise entre 10 % et 20 % [
24,
25]. |
Infections à P. aeruginosa multirésistant : facteurs de risque Les infections à P. aeruginosa chez les patients à risque impliquent le plus souvent une étape préalable de colonisation. Si celle-ci est rare (< 10 %) et transitoire dans les flores digestive et oropharyngée normales, sa fréquence peut être supérieure à 50 %, tous profils de résistance confondus, chez les patients hospitalisés, notamment en cas de dispositifs invasifs, d’immunodépression et de prise d’antibiotiques. L’acquisition peut se faire par transmission manuportée ou à partir d’un réservoir environnemental, notamment hydrique [
26,
27]. D’autres catégories de patients sont à risque de colonisation bronchique par P. aeruginosa : bronchopathies chroniques obstructives (BPCO) et syndrome d’immunodéficience acquise (Sida) évolué. La colonisation à PAMR peut résulter de la sélection de mutants résistants lors d’un traitement antibiotique à partir d’une souche sauvage ou peu résistante préalablement acquise, ou d’une acquisition directe par transmission croisée (35 % à 65 % des cas, hors période épidémique) [13, 26–
29]. La pression de sélection induite par une antibiothérapie préalable est un facteur de risque majeur mais son impact dépend de son type et de sa durée. Dans une étude cas-témoins conduite en réanimation (n = 34 cas, appariement 1:1 sur la durée de séjour et la gravité initiale), la durée d’exposition à une ou plusieurs molécules anti-Pseudomonas était plus longue chez les patients ayant acquis une souche de PAMR après leur admission que chez les sujets contrôles (médianes : 13 versus 2 jours, p = 0,001) [
30]. Dans cette étude, seules les durées de traitement par fluoroquinolones et imipénème étaient associées à l’acquisition de PAMR en analyse multivariée, les durées de traitement par carboxy- et uréido-pénicillines n’ayant pas d’effet indépendant. L’impact d’un traitement antérieur par aminosides ou céphalosporines à large spectre a également été démontré [
8]. L’acquisition de PAMR peut survenir chez des patients n’ayant préalablement reçu qu’une seule ligne d’antibiothérapie : l’exposition à une classe d’antibiotiques peut favoriser l’acquisition d’une souche résistante à toutes les autres (sélection de corésistances). Les autres facteurs de risque de colonisation/infection à PAMR sont l’hospitalisation en réanimation et la durée de séjour, et le recours aux procédures invasives (intubation trachéale et sondage urinaire notamment) et leurs durées [8,
31]. La persistance d’un réservoir environnemental peut être également en cause dans la pérennisation d’une épidémie locale. |
Multirésistance chez P. aeruginosa
: impact pronostique Les études ayant évalué l’impact pronostique de la multirésistance chez P. aeruginosa sont peu nombreuses et difficilement comparables. La plupart d’entre elles ont cependant montré en analyse multivariée une surmortalité hospitalière chez les patients colonisés et/ou infectés par des PAMR par comparaison avec ceux qui étaient porteurs de souches sauvages ou peu résistantes (odds ratio : 1,3-26) [10]. Une augmentation significative de la durée d’hospitalisation, de la durée de ventilation mécanique pour les malades de réanimation, et du coût du séjour a également été rapportée chez ces patients [10]. Ce mauvais pronostic indépendamment associé à la multirésistance peut en partie s’expliquer par le retard de l’administration d’une antibiothérapie adéquate, notamment dans les infections sévères. Une surmortalité de 20 % à 40 % a par exemple été rapportée au cours des PAVM (pneumopathies acquises sous ventilation mécanique) en cas d’antibiothérapie initiale inactive [
32]. Dans les PAVM tardives (survenant après ≥ 5 jours de ventilation assistée), le traitement probabiliste actuellement recommandé associe une β-lactamine à large spectre active sur Pseudomonas (céphalosporine, carbapénème ou tazocilline) et un aminoside ou une fluoroquinolone (ciprofloxacine) [
33]. Ces combinaisons ne couvrant pas les PAMR, l’utilisation probabiliste de la colistine devient donc justifiée lorsqu’une souche multirésistante est possiblement en cause (colonisation connue, épidémie locale) [
34]. |
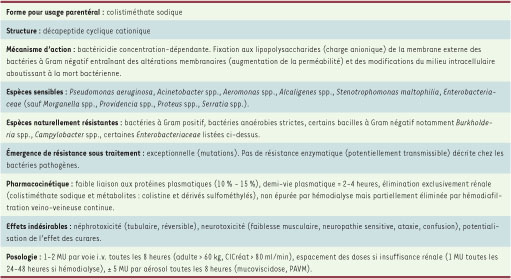
Colistine (polymyxine E) La colistine représente actuellement la principale option pour le traitement des infections à P. aeruginosa multiet panrésistants [
35]. Ce polypeptide cyclique bactéricide reste en effet actif sur la quasi-totalité de ces souches. La polymyxine B, seule autre polymyxine utilisable en pratique, n’est pas disponible en France. Les principales caractéristiques pharmacologiques de la colistine sont résumées dans le Tableau IV.  | Tableau IV
Colistine (polymyxine E) : principales caractéristiques pharmacologiques.
|
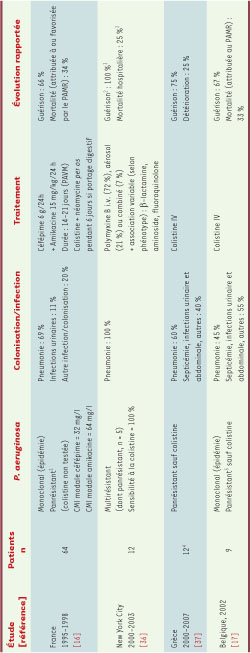
À la différence des données cliniques publiées chez les patients atteints de mucoviscidose, celles qui concernent l’utilisation des polymyxines en réanimation sont rares (Tableau V) [16,
17,
36,
37]. L’efficacité des polymyxines en monothérapie au cours des PAVM à PAMR semble acceptable, la mortalité rapportée (entre 25 et 35 %) étant similaire à celle des pneumonies à souches non multirésistantes et traitées par des antibiotiques anti-Pseudomonas classiques. De nombreuses inconnues persistent cependant quant a la pharmacodynamie de la colistine. L’intérêt potentiel d’une administration par aérosols (si possible par nébuliseurs ultrasoniques) en complément de la voie intraveineuse est controversé [
38,
39]. La durée optimale de traitement de ces PAVM à PAMR reste à définir. En l’absence de recommandations spécifiques, elle doit être identique à celle d’une PAVM à P. aeruginosa sensible (14 jours) [33]. Un traitement plus prolongé pourrait être associé à une clairance bactériologique plus fréquente, mais n’a pas démontré de bénéfice en termes d’efficacité clinique [36]. La toxicité tubulaire de la colistine est sa principale complication potentielle, en particulier chez les patients en réanimation cumulant fréquemment les facteurs d’agression rénale (sepsis, choc, autres médicaments néphrotoxiques, produits de contraste). Facteur indépendant de surmortalité lorsqu’elle est responsable d’une insuffisance rénale aiguë grave, cette néphrotoxicité concerne 8 à 19 % des patients traités [37, 39]. Elle est cependant réversible et n’impose pas systématiquement l’arrêt du traitement dès lors que la posologie est adaptée à la fonction rénale. Les dosages plasmatiques de colistine (méthodes microbiologiques ou high performance liquid chromatography, HPLC) peuvent être utiles dans ce contexte : ils ne sont cependant pas disponibles en routine dans tous les centres. Autres antibiothérapies possibles Plusieurs associations d’antibiotiques inactifs lorsqu’ils sont utilisés seuls ont montré un effet synergique in vitro sur des souches cliniques de PAMR, notamment : ticarcilline/tobramycine/ rifampicine, céphalosporine (céftazidime ou céfépime)/fluoroquinolones et macrolides (clarithromycine ou azithromycine)/tobramycine [
40]. La rifampicine semble également potentialiser l’action de certaines molécules anti -Pseudomonas. Ces combinaisons synergiques, dont les mécanismes sont mal élucidés, n’ont pas démontré leur efficacité in vivo et ne peuvent donc pas être recommandées actuellement. L’association céfépime/amikacine a été utilisée avec un taux de succès clinique de 66 % lors d’une épidémie liée à un clone de PAMR dans un hôpital français (Tableau V) [16]. L’association d’une polymyxine avec certaines β-lactamines pourrait également être intéressante, en particulier avec les carbapénèmes, les altérations membranaires induites par la polymyxine pouvant réverser partiellement les résistances par imperméabilité [37]. Compte tenu de l’épidémiologie actuelle des infections à PAMR, ces observations monocentriques mériteraient d’être vérifiées dans le cadre d’essais prospectifs. La fosfomycine par voie parentérale pourrait constituer une autre option thérapeutique [
41]. Cette molécule est active in vitro sur environ 30 % des isolats de PAMR. Son utilisation a été essentiellement rapportée chez des patients atteints de mucoviscidose, le plus souvent en association (risque majeur d’émergence de résistance en monothérapie). Son efficacité dans ce contexte semble acceptable et justifie, là encore, d’une évaluation prospective.  | Tableau V
Traitement des infections à Pseudomonas aeruginosa multirésistant en réanimation : données cliniques. Les quatre études citées sont monocentriques. CMI : concentration minimale inhibitrice ; PAMR : P. aeruginosa multirésistant. 1Mécanismes de résistance du clone épidémique : hyperproduction de la céphalosporinase chromosomique ampC et des systèmes d’efflux MexAB-oprM et MexEF-oprN, mutation sur oprD (perte de la porine D2), β-lactamase plasmidique PSE-1 ; 2clairance bactériologique (non rapportée dans les autres études) : 41 %. Clairance versus persistance : durée de traitement par polymyxine B = 24 jours versus 16 jours (p = 0,06). Néphrotoxicité attribuée à la polymyxine B : 10 % ; 3le total est >; 100 % car le décès des 25 % de patients n’est pas dû à la pneumonie à pyocyanique ; tous les patients atteints ont été considérés comme guéris à la fin du traitement antibiotique ; les décès ultérieurs ne sont donc pas attribuables au pyocyanique multiR ; 4étude incluant 258 patients infectés par bacilles à Gram négatif multirésistants dont 68 par P. aeruginosa. Association colistine + autre molécule (principalement méropénème ou tazocilline) pour 56 de ces 68 patients, non rapportés dans ce tableau (profils de résistances non détaillés dans la référence) ; 5mécanismes de résistance du clone épidémique : hyperproduction de la céphalosporinase chromosomique ampC et du système d’efflux MexXY-oprM, mutation sur oprD (perte de la porine D2). |
Perspectives immunologiques Les macrolides ont été proposés pour leur effet sur le quorum sensing, système de communication intercellulaire dépendant des acylhomosérines lactones et modulant l’expression de certains gènes impliqués dans la physiopathologie des pneumonies à pyocyanique en fonction de la densité bactérienne [ 23,
42]. Un essai contrôlé au cours des PAVM à bacilles à Gram négatif n’a cependant pas montré d’effet favorable [
43]. Des données expérimentales suggèrent l’efficacité d’anticorps monoclonaux anti-PcrV, facteur-clé de la virulence chez P. aeruginosa (appareil de sécrétion de type III) [
44]. L’utilisation de ces anticorps ainsi que d’autres approches immunologiques font actuellement l’objet d’essais cliniques. |
Les infections à PAMR sont devenues une réalité quotidienne dans de nombreux services de réanimation. Cette situation alarmante justifie plus que jamais le contrôle de la consommation d’antibiotiques et l’application stricte des mesures d’hygiène et d’isolement des patients colonisés ou infectés. Le développement de nouveaux traitements antibiotiques ou immunologiques actifs sur P. aeruginosa est urgent, ceci d’autant plus que l’émergence de la résistance à la colistine a été rapportée dans cette espèce, faisant craindre la diffusion de souches panrésistantes dans un avenir proche. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Richards MJ, Edwards JR, Culver DH, Gaynes RP. Nosocomial infections in medical intensive care units in the United States. National nosocomial infections surveillance system. Crit Care Med 1999; 27 : 887-92. 2. National nosocomial infections surveillance (NNIS) system report, data summary from October 1986- April 1998, issued June 1998. Am J Infect Control 1998; 26 : 522-33. 4. Emerson J, McNamara S, Buccat AM, et al. Changes in cystic fibrosis sputum microbiology in the United States between 1995 and 2008. Pediatr Pulmonol 2010; 45 : 363-70. 5. Flamm RK, Weaver MK, Thornsberry C, et al. Factors associated with relative rates of antibiotic resistance in Pseudomonas aeruginosa isolates tested in clinical laboratories in the United States from 1999 to 2002. Antimicrob Agents Chemother 2004; 48 : 2431-6. 6. Livermore DM. Multiple mechanisms of antimicrobial resistance in Pseudomonas aeruginosa: our worst nightmare? Clin Infect Dis 2002; 34 : 634-40. 7. Obritsch MD, Fish DN, MacLaren R, Jung R. National surveillance of antimicrobial resistance in Pseudomonas aeruginosa isolates obtained from intensive care unit patients from 1993 to 2002. Antimicrob Agents Chemother 2004; 48 : 4606-10. 8. Aloush V, Navon-Venezia S, Seigman-Igra Y, et al. Multidrug-resistant Pseudomonas aeruginosa: risk factors and clinical impact. Antimicrob Agents Chemother 2006; 50 : 43-8. 9. Giske CG, Monnet DL, Cars O, Carmeli Y. Clinical and economic impact of common multidrug-resistant Gram-negative bacilli. Antimicrob Agents Chemother 2008; 52 : 813-21. 10. Shorr AF. Review of studies of the impact on Gram-negative bacterial resistance on outcomes in the intensive care unit. Crit Care Med 2009; 37 : 1463-9. 11. Lister PD, Wolter DJ, Hanson ND. Antibacterial-resistant Pseudomonas aeruginosa: clinical impact and complex regulation of chromosomally encoded resistance mechanisms. Clin Microbiol Rev 2009; 22 : 582-610. 12. Bonomo RA, Szabo D. Mechanisms of multidrug resistance in Acinetobacter species and Pseudomonas aeruginosa. Clin Infect Dis 2006; 43 (suppl 2) : S49-56. 13. Juan C, Gutierrez O, Oliver A, et al. Contribution of clonal dissemination and selection of mutants during therapy to Pseudomonas aeruginosa antimicrobial resistance in an intensive care unit setting. Clin Microbiol Infect 2005; 11 : 887-92. 14. Carmeli Y, Troillet N, Eliopoulos GM, Samore MH. Emergence of antibiotic-resistant Pseudomonas aeruginosa: comparison of risks associated with different antipseudomonal agents. Antimicrob Agents Chemother 1999; 43 : 1379-82. 15. European committee on antimicrobial susceptibility testing. URL: http://www.eucast.org/ mic_distributions/(consulté le : 9 juillet 2010). 16. Dubois V, Arpin C, Melon M, et al. Nosocomial outbreak due to a multiresistant strain of Pseudomonas aeruginosa P12: efficacy of cefepime-amikacin therapy and analysis of beta-lactam resistance. J Clin Microbiol 2001; 39 : 2072-8. 17. Deplano A, Denis O, Poirel L, et al. Molecular characterization of an epidemic clone of panantibiotic- resistant Pseudomonas aeruginosa. J Clin Microbiol 2005; 43 : 1198-204. 18. Lolans K, Queenan AM, Bush K, et al. First nosocomial outbreak of Pseudomonas aeruginosa producing an integron-borne metallo-beta-lactamase (VIM-2) in the United States. Antimicrob Agents Chemother 2005; 49 : 3538-40. 19. Jones ME, Draghi DC, Thornsberry C, et al. Emerging resistance among bacterial pathogens in the intensive care unit: a European and North American surveillance study (2000-2002). Ann Clin Microbiol Antimicrob 2004; 3 : 14. 20. Zhanel GG, DeCorby M, Laing N, et al. Antimicrobial-resistant pathogens in intensive care units in Canada: results of the Canadian national intensive care unit (CAN-ICU) study, 2005-2006. Antimicrob Agents Chemother 2008; 52 : 1430-7. 22. Lockhart SR, Abramson MA, Beekmann SE, et al. Antimicrobial resistance among Gram-negative bacilli causing infections in intensive care unit patients in the United States between 1993 and 2004. J Clin Microbiol 2007; 45 : 3352-9. 23. Sadikot RT, Blackwell TS, Christman JW, Prince AS. Pathogen-host interactions in Pseudomonas aeruginosa pneumonia. Am J Respir Crit Care Med 2005; 171 : 1209- 23. 24. Lambiase A, Raia V, Del Pezzo M, et al. Microbiology of airway disease in a cohort of patients with cystic fibrosis. BMC Infect Dis 2006; 6 : 4. 25. George AM, Jones PM, Middleton PG. Cystic fibrosis infections: treatment strategies and prospects. FEMS Microbiol Lett 2009; 300 : 153-64. 26. Agodi A, Barchitta M, Cipresso R, et al. Pseudomonas aeruginosa carriage, colonization, and infection in ICU patients. Intensive Care Med 2007; 33 : 1155-61. 27. Johnson JK, Smith G, Lee MS, et al. The role of patient-to-patient transmission in the acquisition of imipenem-resistant Pseudomonas aeruginosa colonization in the intensive care unit. J Infect Dis 2009; 200 : 900-5. 28. Jonas D, Meyer E, Schwab F, Grundmann H. Genodiversity of resistant Pseudomonas aeruginosa isolates in relation to antimicrobial usage density and resistance rates in intensive care units. Infect Control Hosp Epidemiol 2008; 29 : 350-7. 29. Ortega B, Groeneveld AB, Schultsz C. Endemic multidrug-resistant Pseudomonas aeruginosa in critically ill patients. Infect Control Hosp Epidemiol 2004; 25 : 825-31. 30. Paramythiotou E, Lucet JC, Timsit JF, et al. Acquisition of multidrug-resistant Pseudomonas aeruginosa in patients in intensive care units: role of antibiotics with antipseudomonal activity. Clin Infect Dis 2004; 38 : 670-7. 31. Furtado GH, Bergamasco MD, Menezes FG, et al. Imipenem-resistant Pseudomonas aeruginosa infection at a medical-surgical intensive care unit: risk factors and mortality. J Crit Care 2009; 24 : 625 e9-14. 32. Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care Med 2002; 165 : 867-903. 33. American thoracic society/Infectious diseases society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med 2005; 171 : 388-416. 34. Falagas ME, Rafailidis PI. When to include polymyxins in the empirical antibiotic regimen in critically ill patients with fever? A decision analysis approach. Shock 2007; 27 : 605-9. 35. Falagas ME, Kasiakou SK. Colistin: the revival of polymyxins for the management of multidrug-resistant Gram-negative bacterial infections. Clin Infect Dis 2005; 40 : 1333-41. 36. Sobieszczyk ME, Furuya EY, Hay CM, et al. Combination therapy with polymyxin B for the treatment of multidrug-resistant Gram-negative respiratory tract infections. J Antimicrob Chemother 2004; 54 : 566-9. 37. Falagas ME, Rafailidis PI, Ioannidou E, et al. Colistin therapy for microbiologically documented multidrug-resistant Gram-negative bacterial infections: a retrospective cohort study of 258 patients. Int J Antimicrob Agents 2010; 35 : 194-9. 38. Linden PK, Paterson DL. Parenteral and inhaled colistin for treatment of ventilator-associated pneumonia. Clin Infect Dis 2006; 43 (suppl 2) : S89-94. 39. Kofteridis D, Valachis A, Alexopoulou C, et al. Aerosolized in combination with intravenous colistin vs. intravenous colistin in the treatment of ventilator- associated pneumonia : a matched case-control study. Wien, Austria : 20th European Congress of clinical microbiology and infectious diseases, 2010 (Poster n° 1545). 40. Rahal JJ. Novel antibiotic combinations against infections with almost completely resistant Pseudomonas aeruginosa and Acinetobacter species. Clin Infect Dis 2006; 43 (suppl 2) : S95-9. 41. Falagas ME, Kastoris AC, Karageorgopoulos DE, Rafailidis PI. Fosfomycin for the treatment of infections caused by multidrug-resistant non-fermenting Gram- negative bacilli: a systematic review of microbiological, animal and clinical studies. Int J Antimicrob Agents 2009; 34 : 111-20. 42. Kohler T, Perron GG, Buckling A, van Delden C. Quorum sensing inhibition selects for virulence and cooperation in Pseudomonas aeruginosa. PLoS Pathog 2010; 6 : e1000883. 43. Giamarellos-Bourboulis EJ, Pechere JC, Routsi C, et al. Effect of clarithromycin in patients with sepsis and ventilator-associated pneumonia. Clin Infect Dis 2008; 46 : 1157-64. 44. Baer M, Sawa T, Flynn P, et al. An engineered human antibody fab fragment specific for Pseudomonas aeruginosa PcrV antigen has potent antibacterial activity. Infect Immun 2009; 77 : 1083-90. 45. Nordmann P. Resistance aux carbapénèmes chez les bacilles à Gram négatif. Med Sci (Paris) 2010; 26 : 950-9. |