| |
| Med Sci (Paris). 2010 December; 26(12): 1074–1078. Published online 2010 December 15. doi: 10.1051/medsci/201026121074.La pendrine Rôle dans la physiologie rénale et l’hypertension artérielle Alain Doucet1* and Dominique Eladari1,2* 1Universités Paris 5 et Paris 6, Inserm (UMRS 872) et CNRS (ERL 7226), Laboratoire de génomique, physiologie et physiopathologie rénales, Centre de recherche des Cordeliers, 15, rue de l’École de Médecine, 75006 Paris, France 2Assistance publique-Hôpitaux de Paris, Département de physiologie, Centre hospitalier HEGP-Necker-Enfants malades, Paris, France |
L’aventure brève mais mouvementée de la découverte des fonctions rénales de la pendrine La pendrine a été découverte en 1997 [
1] lors d’études génétiques visant à identifier le gène responsable d’un syndrome décrit par Vaughan Pendred un siècle auparavant [
2]. Le syndrome de Pendred est une maladie autosomique récessive caractérisée par une surdité neurosensorielle et un goitre non endémique lié à un défaut d’organification de l’iode dans la thyroïde. Curieusement, bien que les patients atteints de syndrome de Pendred ne présentent pas d’anomalie de leur fonction rénale, le travail princeps d’identification de la pendrine montrait que parmi de nombreux organes, c’est dans le rein qu’on trouve la plus forte expression de l’ARN messager de la pendrine [1]. L’analyse de la séquence de la pendrine (SLC26A4) prédisait des similitudes structurelles avec un transporteur membranaire de sulfate. Cette déduction n’expliquait pas les anomalies fonctionnelles de l’oreille interne et de la thyroïde dans le syndrome de Pendred. Il a d’ailleurs été rapidement démontré que si la pendrine est effectivement un transporteur ionique, elle ne transporte pas le sulfate mais elle échange le chlorure extracellulaire contre l’iodure, le formate ou le bicarbonate intracellulaires [
3–
5]. Les fonctions d’échangeur Cl−/t− et Cl−/HCO3
− rendent compte des rôles de la pendrine respectivement dans la thyroïde et dans l’oreille interne [
6,
7]. Sa fonction d’échangeur Cl-/formate a suscité l’intérêt immédiat de physiologistes rénaux qui ont initialement proposé que la pendrine était l’échangeur Cl-/formate du tubule proximal [
8], qui joue un rôle majeur dans la réabsorption rénale de NaCl et dont l’identité moléculaire était recherchée depuis plusieurs années [
9]. Cette hypothèse s’avéra fausse puisque la pendrine a été localisée dans le néphron distal, au niveau du canal collecteur [
10-
12], et que l’échangeur Cl-/formate du tubule proximal a été identifié comme étant un de ses homologues [
13]. |
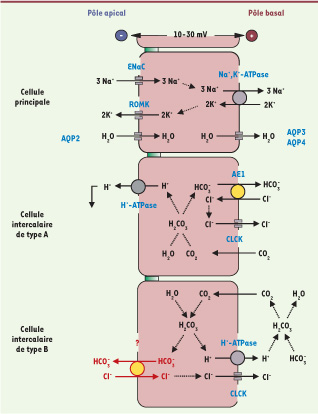
Les multiples fonctions du canal collecteur Le canal collecteur constitue la partie terminale du néphron où sont finement ajustées les quantités d’eau et d’ions (Na+, K+, H+ et HCO3
−) excrétées dans l’urine afin qu’elles balancent exactement celles qui sont ingérées et/ou produites par le métabolisme. Ce segment joue ainsi un rôle crucial dans le maintien de l’homéostasie hydrominérale. Le canal collecteur est constitué de cellules principales et de cellules intercalaires qui assurent des fonctions spécifiques (Figure 1). Les cellules principales réabsorbent du sodium par couplage de la pompe Na+/K+-ATPase à leur pôle basolatéral en série avec le canal sodium sensible à l’amiloride (ENaC, epithelial Na
+
channel) à leur pôle apical [
31]. Cette réabsorption électrogénique de sodium génère un voltage transépithélial (négatif dans la lumière tubulaire par rapport à l’interstitium) qui permet la sécrétion de potassium par couplage de la Na+/K+-ATPase avec un canal potassium apical (ROMK, rectifying outer medullary K
+
channel). Enfin, en présence de vasopressine, qui induit l’expression apicale d’aquaporine 2, les cellules principales réabsorbent de l’eau. Les cellules intercalaires sont classiquement impliquées dans la régulation de l’état acide-base. Deux sous-types de cellules intercalaires ont été identifiés sur la base de la présence d’un échangeur Cl-/HCO3
- (AE1 anion exchanger 1), différent de la pendrine, et de la localisation intracellulaire de la pompe H+-ATPase [
14]. Les cellules intercalaires de type A expriment AE1 et la H+-ATPase respectivement à leur pôle basolatéral et apical, et peuvent ainsi sécréter des protons et réabsorber du bicarbonate [14]. Au cours d’une acidose métabolique, la H+-ATPase est activée, ce qui augmente la sécrétion d’ions H+ dans le fluide urinaire et limite l’acidose. Les cellules intercalaires de type B présentent une polarité en grande partie opposée à celle des cellules A. Elles expriment un échangeur Cl-/HCO3
− électroneutre et indépendant du sodium à leur pôle apical et la H+-ATPase à leur pôle basolatéral. Ces cellules sont inactivées lors de l’acidose. En revanche, l’ensemble des transporteurs des cellules de type B est activé en réponse à une alcalose métabolique, ce qui aboutit à une sécrétion nette de bicarbonate dans l’urine permettant d’atténuer l’alcalose [
15]. Il existe aussi des cellules intercalaires non-A non-B qui expriment à la fois la pompe à proton et l’échangeur Cl-/HCO3
- à la membrane apicale [14], et dont la fonction reste inconnue à ce jour.  | Figure 1
Mécanisme de transport des ions et de l’eau dans les différents types cellulaires constitutifs du canal collecteur.
Les pompes sont représentées par des cercles gris, les transporteurs par des cercles jaunes et les canaux par des tirets gris. L’échangeur Cl−/HCO3
− apical des cellules intercalaires B (en rouge), dont l’identité moléculaire était inconnue, s’est avéré être la pendrine. ENaC : epithelial sodium channel ; ROMK : rectifying outer medullary K
+
channel ; CLCK canal chlorure ; AE : anion exchanger ; AQP : aquaporines. |
|
Rôle de la pendrine dans le contrôle de la balance acide-base Des études comparatives de localisation immuno-histologique de la pendrine, d’AE1 et de la H+-ATPase dans le rein de souris normales ou invalidées pour le gène de la pendrine ont montré que l’expression de cette dernière est restreinte à la membrane apicale des cellules intercalaires B [10]. Ces auteurs ont aussi montré que la sécrétion de bicarbonate, mesurée par microperfusion in vitro, est abolie dans les canaux collecteurs des souris invalidées pour la pendrine, ce qui prouve que la pendrine est l’échangeur Cl-/HCO 3
- apical des cellules intercalaires B [10]. À la suite de cette observation, plusieurs groupes ont étudié la régulation de la pendrine lors de traitements perturbant l’état acide-base. Il a ainsi été montré que l’expression de la pendrine est diminuée lors d’une charge en NH4Cl provoquant une acidose métabolique [
16] ou lors d’une acidose respiratoire [
17], alors qu’elle est augmentée en réponse à une charge alcaline [16]. Par ailleurs, les souris inactivées pour la pendrine développent une alcalose métabolique lorsqu’elles sont soumises à une charge alcaline. Ces observations confirment que la sécrétion de bicarbonate via la pendrine est impliquée dans la réponse rénale à des perturbations de l’état acide-base. |
Rôle de la pendrine dans l’excrétion de chlorure Le mécanisme permettant la réabsorption de chlorure dans le canal collecteur n’était pas clairement établi. D’une part, de nombreux auteurs suggéraient qu’elle s’effectuait entre les cellules (par la voie paracellulaire) grâce à l’existence du voltage transépithélial généré par la réabsorption de sodium par les cellules principales. Ce mécanisme permet d’expliquer le couplage qui existe entre la réabsorption de sodium et celle de chlore, mais se heurte au fait bien établi que la paroi des canaux collecteurs constitue un épithélium très serré, c’est-à-dire présentant une très faible perméabilité paracellulaire aux ions. D’autre part, la présence de la pendrine dans la membrane apicale des cellules intercalaires B en série avec un canal chlorure dans leur membrane basolatérale rend théoriquement possible une réabsorption de chlorure à travers les cellules intercalaires B. Par microperfusion tubulaire in vitro, le groupe de S. Wall aux États-Unis a montré que la réabsorption de chlorure dans des canaux collecteurs de souris est totalement abolie chez les souris invalidées pour la pendrine [
18]. Cette observation démontre que l’intégralité de la réabsorption de chlorure dans le canal collecteur s’effectue à travers les cellules intercalaires B. En marge de l’étude de la régulation de la pendrine par l’état acide-base, notre équipe a par ailleurs observé une diminution de l’expression de la pendrine en réponse à une charge en NaCl [
19]. Afin de tester le rôle respectif de la charge en sodium et en chlorure dans cet effet, nous avons comparé l’expression de la pendrine dans le rein de rats soumis pendant 6 jours à une charge en NaCl, NH4Cl, NaHCO3, KCl, ou KHCO3, ou à une restriction en NaCl. Indépendamment du cation administré avec le Cl- ou de l’équilibre acide-base, nous avons observé une corrélation inverse entre l’expression de la pendrine et l’excrétion urinaire de chlore [
20]. Ces résultats démontrent que la pendrine participe à la régulation de la balance du chlorure. |
Rôle de la pendrine dans la régulation de la pression artérielle Le groupe de S. Wall a aussi montré que les souris invalidées pour la pendrine sont protégées contre l’hypertension induite par une injection de minéralocorticoïdes associée à un régime enrichi en NaCl [
21]. À l’inverse, en réponse à une restriction alimentaire en NaCl, l’excrétion de Cl- est augmentée chez ces souris, entraînant une balance négative et une hypotension [18]. Le même groupe a enfin montré que l’expression de la pendrine et l’absorption de chlorure médiée par la pendrine sont augmentées sous l’effet de l’aldostérone [21] et de l’angiotensine II [
22], deux hormones prohypertensives qui stimulent l’absorption de sodium dans le néphron distal. Tous ces résultats suggèrent une implication de la pendrine et de la réabsorption de chlorure dans le contrôle de la pression artérielle, mais le mécanisme physiopathologique de cette association demeure inconnu. La pression artérielle dépend de l’activité cardiaque et de la résistance vasculaire. Ses variations à moyen et long terme résultent principalement de celles de la volémie, dont dépend le débit cardiaque. La volémie est quant à elle principalement déterminée par la balance du sodium : toute rétention de sodium augmente la volémie et, en dehors d’un contexte œdémateux, élève la pression artérielle. Il est notoire que toutes les formes mendéliennes d’hypertension résultent de mutations altérant le transport de sodium dans les segments distaux du néphron ou sa régulation [
23]. Peut-être convient-il de rappeler que si la volémie est déterminée par la balance du sodium et non par celle de l’eau, c’est parce que le maintien de la pression osmotique du plasma prime sur celle de son volume. Ainsi, une expansion volumique secondaire à une rétention d’eau induit une diminution de la pression osmotique plasmatique qui est immédiatement corrigée par un mouvement d’eau du plasma vers les compartiments cellulaires, et donc un retour à une volémie normale. Inversement, une rétention de sodium augmente la pression osmotique plasmatique qui est corrigée par un afflux d’eau depuis les cellules, induisant ainsi une expansion volumique. Des études chez l’homme et chez l’animal ont depuis longtemps montré que ce n’est pas l’apport alimentaire en sodium seul mais celui en NaCl qui influence la pression artérielle [
24-
26], ce qui est logique si l’on considère que le chlorure est l’anion majoritaire accompagnant le sodium dans les compartiments extracellulaires. Dans le tubule contourné distal, l’autre segment du néphron distal impliqué dans la régulation de la balance du sodium, la réabsorption de sodium est stœchiométriquement couplée à celle du chlorure au niveau d’un cotransporteur Na+-Cl-, sensible aux diurétiques thiazidiques, qui assure l’entrée apicale des deux ions. En revanche, dans le canal collecteur, la réabsorption de sodium et celle de chlorure s’effectuent respectivement dans la cellule principale et la cellule intercalaire B, deux cellules qui ne semblent pas fonctionnellement couplées. Ainsi, nous avons montré que l’administration d’un diurétique thiazidique à des souris augmente l’expression de la sous-unité α d’ENaC et active sa sous-unité γ alors que l’expression de la pendrine à la membrane apicale est fortement diminuée [19]. L’implication de la pendrine dans le contrôle de la pression artérielle suggère donc l’existence d’un couplage entre la réabsorption de chlorure par les cellules intercalaires B et une réabsorption de sodium indépendante de celle médiée par ENaC dans les cellules principales. Cette hypothèse est confortée par la description antérieure d’un transport de sodium dans le canal collecteur présentant des caractéristiques pharmacologiques (sensibilité aux thiazidiques et insensibilité à l’amiloride) incompatibles avec celle d’ENaC [
27-
29]. En mesurant simultanément les flux transépithéliaux de Na+, de K+ et de Cl− ainsi que le voltage transépithélial dans des canaux collecteurs de souris microperfusés in vitro [
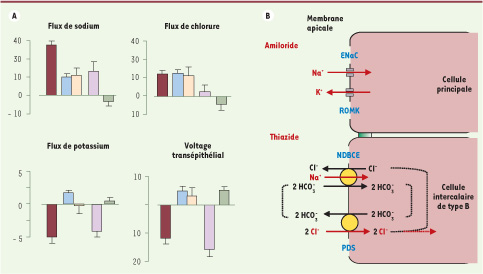
30], nous avons observé que l’inhibition d’ENaC, soit pharmacologiquement, soit par invalidation génique, abolit le voltage transépithélial et la sécrétion de potassium, mais n’inhibe que partiellement la réabsorption de sodium et n’affecte pas celle de chlorure (Figure 2). En revanche, l’addition d’un thiazidique abolit la réabsorption résiduelle de sodium et celle de chlorure, démontrant l’existence d’une voie de réabsorption électroneutre de sodium stœchiométriquement couplée à celle de chlorure. La pendrine responsable de la réabsorption de chlorure n’étant pas connue pour transporter le sodium, nous avons recherché le transporteur de sodium auquel elle est couplée pour expliquer ce processus. En combinant des approches génétiques et physiologiques, nous avons montré que la réabsorption de sodium est médiée par la protéine NDBCE (pour Na+ driven bicarbonate chloride exchanger, SLC4A8), un échangeur Cl−/HCO3
− dépendant du sodium [31] (Figure 2).  | Figure 2
Double mécanisme de réabsorption du sodium dans le canal collecteur. A. Preuves expérimentales. Flux de sodium, potassium et chlorure (pEq/mm/min ± SE) et voltage transépithélial (mV ± SE) mesurés par microperfusion in vitro dans des canaux collecteurs de souris adaptées à un régime carencé en sodium. Les valeurs positives de flux représentent des réabsorptions et les valeurs négatives des sécrétions. Les différents histogrammes représentent : rouge foncé, mesure de base ; bleu, présence d’amiloride ; jaune, souris invalidées pour ENaC ; violet, présence d’hydrochlorothiazide ; vert, présence d’hydrochlorothiazide et d’amiloride (redessiné à partir de [ 30]). B. Mécanisme d’entrée apicale de sodium dans les cellules principales et intercalaires de type B. L’amiloride inhibe directement ENaC alors que le thiazide inhibe la pendrine (PDS) et/ou NDBCE ( Na-driven bicarbonate Cl
−
exchanger). |
Deux systèmes de transport du sodium coexistent donc dans le canal collecteur : l’un, originaire des cellules principales, est un système électrogénique dépendant d’ENaC, sensible à l’amiloride et responsable d’un échange Na+/K+ ; l’autre, localisé dans les cellules intercalaires, dépend du couplage entre la pendrine et NDBCE, est sensible aux thiazidiques et est responsable d’une réabsorption électroneutre de NaCl inhibée par les thiazidiques. Tout au long du néphron distal, il existe donc des systèmes liant la réabsorption de sodium à celle de chlorure, ce qui apporte une base conceptuelle à l’effet permissif du chlorure sur le développement d’une hypertension dépendante du sodium. |
Conclusions et perspectives Les travaux réalisés au cours de la dernière décennie ont révélé des rôles majeurs de la pendrine dans le contrôle de l’équilibre acide-base, de l’homéostasie du chlorure, de la volémie et de la pression artérielle, et ont permis de découvrir une nouvelle voie de réabsorption de sodium dans le néphron distal. Au vu de ces résultats, il peut sembler étonnant que l’inactivation de la pendrine n’entraîne ni alcalose métabolique ni hypotension chez les patients atteints de syndrome de Pendred. Il faut cependant noter que la sécrétion de bicarbonate par le rein est une fonction en général quiescente chez les êtres humains soumis à une diète occidentale classique qui représente une charge acide chronique. Dans ces conditions, les cellules intercalaires B sont au repos et l’excrétion urinaire de bicarbonate est nulle. Il conviendrait donc d’évaluer la tolérance des patients atteints de syndrome de Pendred à des situations favorisant la survenue d’une alcalose métabolique, comme par exemple un apport d’alcalins, des vomissements, un régime végétarien, ou la prise chronique de diurétique. Face aux multiples rôles de la pendrine au niveau rénal, il est déconcertant de constater la rareté des informations concernant sa structure et ses propriétés intrinsèques, la régulation de son expression, de sa maturation et de son adressage membranaire, ainsi que son contrôle par les nombreuses hormones qui agissent au niveau du tubule collecteur. La recherche dans ces domaines devrait apporter de nouveaux éclairages sur l’implication de la voie électroneutre de réabsorption de NaCl en physiologie et en physiopathologie, et permettre d’aborder l’étude des interactions entre les deux voies de transport de sodium dans les canaux collecteurs. Plus généralement, la découverte d’une nouvelle cible des thiazidiques, autre que le cotransporteur NaCl du tubule contourné distal, permet probablement d’expliquer la grande efficacité de cette classe de diurétiques dans le traitement de l’hypertension artérielle. Elle ouvre aussi la possibilité d’effets extrarénaux de ces diurétiques puisque la pendrine et NDBCE sont exprimés dans nombre d’autres tissus. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
1. Everett LA, Glaser B, Beck JC, et al. Pendred syndrome is caused by mutations in a putative sulphate transporter gene (PDS). Nat Genet 1997 ; 17 : 411-22. 2. Pendred V. Deaf-mutism and goitre. Lancet 1896 ; 148 : 532. 3. Kraiem Z, Heinrich R, Sadeh O, et al. Sulfate transport is not impaired in pendred syndrome thyrocytes. J Clin Endocrinol Metab 1999 ; 84 : 2574-6. 4. Royaux IE, Suzuki K, Mori A, et al. Pendrin, the protein encoded by the Pendred syndrome gene (PDS), is an apical porter of iodide in the thyroid and is regulated by thyroglobulin in FRTL-5 cells. Endocrinology 2000 ; 141 : 839-45. 5. Scott DA, Karniski LP. Human pendrin expressed in Xenopus laevis oocytes mediates chloride/ formate exchange. Am J Physiol Cell Physiol 2000 ; 278 : C207-11. 6. Kopp P, Pesce L, Solis SJ. Pendred syndrome and iodide transport in the thyroid. Trends Endocrinol Metab 2008 ; 19 : 260-8. 7. Maciaszczyk K, Lewinski A. Phenotypes of SLC26A4 gene mutations: Pendred syndrome and hypoacusis with enlarged vestibular aqueduct. NeuroEndocrinol Lett 2008 ; 29 : 29-36. 8. Soleimani M, Greeley T, Petrovic S, et al. Pendrin: an apical Cl−/OH−/HCO3− exchanger in the kidney cortex. Am J Physiol Renal Physiol 2001 ; 280 : F356-64. 9. Aronson PS, Giebisch G. Mechanisms of chloride transport in the proximal tubule. Am J Physiol 1997 ; 273 : F179-92. 10. Royaux IE, Wall SM, Karniski LP, et al. Pendrin, encoded by the Pendred syndrome gene, resides in the apical region of renal intercalated cells and mediates bicarbonate secretion. Proc Natl Acad Sci USA 2001 ; 98 : 4221-6. 11. Kim YH, Kwon TH, Frische S, et al. Immunocytochemical localization of pendrin in intercalated cell subtypes in rat and mouse kidney. Am J Physiol Renal Physiol 2002 ; 283 : F744-54. 12. Wall SM, Hassell KA, Royaux IE, et al. Localization of pendrin in mouse kidney. Am J Physiol Renal Physiol 2003 ; 284 : F229-41. 13. Knauf F, Yang CL, Thomson RB, et al. Identification of a chloride-formate exchanger expressed on the brush border membrane of renal proximal tubule cells. Proc Natl Acad Sci USA 2001 ; 98 : 9425-30. 14. Teng-umnuay P, Verlander JW, Yuan W, et al. Identification of distinct subpopulations of intercalated cells in the mouse collecting duct. J Am Soc Nephrol 1996 ; 7 : 260-74. 15. Schuster VL. Function and regulation of collecting duct intercalated cells. Annu Rev Physiol 1993 ; 55 : 267-88. 16. Wagner CA, Finberg KE, Stehberger PA, et al. Regulation of the expression of the Cl-/anion exchanger pendrin in mouse kidney by acid-base status. Kidney Int 2002 ; 62 : 2109-17. 17. De Seigneux S, Malte H, Dimke H, et al. Renal compensation to chronic hypoxic hypercapnia: downregulation of pendrin and adaptation of the proximal tubule. Am J Physiol Renal Physiol 2007 ; 292 : F1256-66. 18. Wall SM, Kim YH, Stanley L, et al. NaCl restriction upregulates renal Slc26a4 through subcellular redistribution: role in Cl− conservation. Hypertension 2004 ; 44 : 982-7. 19. Vallet M, Picard N, Loffing-Cueni D, et al. Pendrin regulation in mouse kidney primarily is chloride-dependent. J Am Soc Nephrol 2006 ; 17 : 2153-63. 20. Quentin F, Chambrey R, Trinh-Trang-Tan MM, et al. The Cl-/HCO3− exchanger pendrin in the rat kidney is regulated in response to chronic alterations in chloride balance. Am J Physiol Renal Physiol 2004 ; 287 : F1179-88. 21. Verlander JW, Hassell KA, Royaux IE, et al. Deoxycorticosterone upregulates PDS (Slc26a4) in mouse kidney: role of pendrin in mineralocorticoid induced hypertension. Hypertension 2003 ; 42 : 356-62. 22. Pech V, Zheng W, Pham TD, et al. Angiotensin II activates H+-ATPase in type A intercalated cells. J Am Soc Nephrol 2008 ; 19 : 84-91. 23. Lifton RP, Gharavi AG, Geller DS. Molecular mechanisms of human hypertension. Cell 2001 ; 104 : 545-56. 24. Morgan T, Myers J. Dietary salt and hypertension. Aust Fam Physician 1982 ; 11 : 264-7. 25. Schmidlin O, Tanaka M, Bollen AW, et al. Chloride-dominant salt sensitivity in the stroke-prone spontaneously hypertensive rat. Hypertension 2005 ; 45 : 867-73. 26. Whitescarver SA, Ott CE, Jackson BA, et al. Salt-sensitive hypertension: contribution of chloride. Science 1984 ; 223 : 1430-2. 27. Terada Y, Knepper MA. Thiazide-sensitive NaCl absorption in rat cortical collecting duct. Am J Physiol 1990 ; 259 : F519-28. 28. Tomita K, Pisano JJ, Burg MB, Knepper MA. Effects of vasopressin and bradykinin on anion transport by the rat cortical collecting duct. Evidence for an electroneutral sodium chloride transport pathway. J Clin Invest 1986 ; 77 : 136-41. 29. Tomita K, Pisano JJ, Knepper MA. Control of sodium and potassium transport in the cortical collecting duct of the rat. Effects of bradykinin, vasopressin, and deoxycorticosterone. J Clin Invest 1985; 76 : 132-6. 30. Leviel F, Hubner CA, Houillier P, et al. The Na+-dependent chloride-bicarbonate exchanger SLC4A8 mediates an electroneutral Na+ reabsorption process in the renal cortical collecting ducts of mice. J Clin Invest 2010 ; 120 : 1627-35. 31. Eladari D, Chambrey R, Leviel F. Identification d’une nouvelle cible des diurétiques thiazidiques dans le rein. Med Sci (Paris) 2010 ; 26 : 549-52. |