| |
| Med Sci (Paris). 2011 January; 27(1): 107–109. Published online 2011 February 10. doi: 10.1051/medsci/2011271107.Le modèle du two-hit de Knudson s’applique aux maladies auto-immunes L’exemple du syndrome lymphoprolifératif avec auto-immunité (ALPS) Aude Magerus-Chatinet1 and Frédéric Rieux-Laucat2* 1Inserm U768, Université Paris Descartes, Hôpital Necker-Enfants malades, 75015 Paris, France 2Inserm U768, Université Paris Descartes, Hôpital Necker-Enfants malades, Unité d’immunologie et d’hématologie pédiatriques, Assistance Publique-Hôpitaux de Paris, 149, rue de Sèvres, 75015 Paris, France MeSH keywords: Antigènes CD95, déficit, génétique, physiologie, Apoptose, Maladies auto-immunes, étiologie, immunologie, Syndrome lymphoprolifératif avec auto-immunité, Cellules cultivées, anatomopathologie, Délétion de segment de chromosome, Chromosomes humains de la paire 10, ultrastructure, Épistasie, Ligand de Fas, Génotype, Mutation germinale, Humains, Modèles génétiques, Modèles immunologiques, Pénétrance, Sous-populations de lymphocytes T |
L’auto-immunité : généralités Les maladies auto-immunes affectent environ 5 % de la population humaine adulte; on pourrait s’attendre à une incidence plus élevée, car plus de la moitié des lymphocytes produits dans les organes lymphoïdes primaires peuvent reconnaître des déterminants du soi et donc potentiellement induire un processus auto-immun. Il existe donc des points de contrôle-clés de la tolérance au soi, qui font intervenir des mécanismes d’activation, de survie, ou de mort lymphocytaires. Des mutations des gènes codant pour les protéines impliquées dans ces mécanismes peuvent conduire à l’émergence de maladies auto-immunes. Ceci est illustré par de rares cas de maladies monogéniques comme le syndrome auto-immun poly-endocrine de type I (APS-I ou APECED) associé à des mutations récessives du gène AIRE (autoimmune regulator), ou le syndrome de dysrégulation immunitaire polyendocrine lié au chromosome X (IPEX), associé à des mutations de FOXP3 (forkhead box P3) [
1]. Plus généralement, les maladies auto-immunes apparaissent, comme les cancers, sous forme de cas sporadiques, et plus rarement sous une forme familiale, ce qui les classe dans les maladies à composante génétique. Christopher Goodnow a réactualisé [
2] la théorie formulée il y a plus de 30 ans par Burnet [
3], proposant que des mutations germinales et somatiques de gènes codant pour des protéines impliquées dans les points de contrôle de la tolérance au soi pourraient rendre compte de la survenue de certaines maladies auto-immunes. Nos résultats récents montrent en effet qu’une pathologie auto-immune peut résulter de l’accumulation de mutations germinales et somatiques sur un même gène [
4], et que le modèle du two-hit hypothesis de Knudson, largement admis dans les cancers, peut aussi s’appliquer à une pathologie auto-immune. |
L’exemple du syndrome lymphoprolifératif avec auto-immunité Le syndrome lymphoprolifératif avec auto-immunité ou ALPS (auto-immune lymphoproliferative syndrome) se caractérise par un syndrome tumoral bénin, d’apparition précoce, qui associe des adénopathies, une splénomégalie et parfois une hépatomégalie [
5-
7]. Cette lymphoprolifération chronique s’accompagne d’une hypergammaglobulinémie, essentiellement de type IgG et IgA, et se caractérise par l’accumulation dans le sang et les organes lymphoïdes secondaires d’une population polyclonale de lymphocytes Tαβ matures n’exprimant ni CD4 ni CD8, appelés lymphocytes T double négatifs (LTDN) [
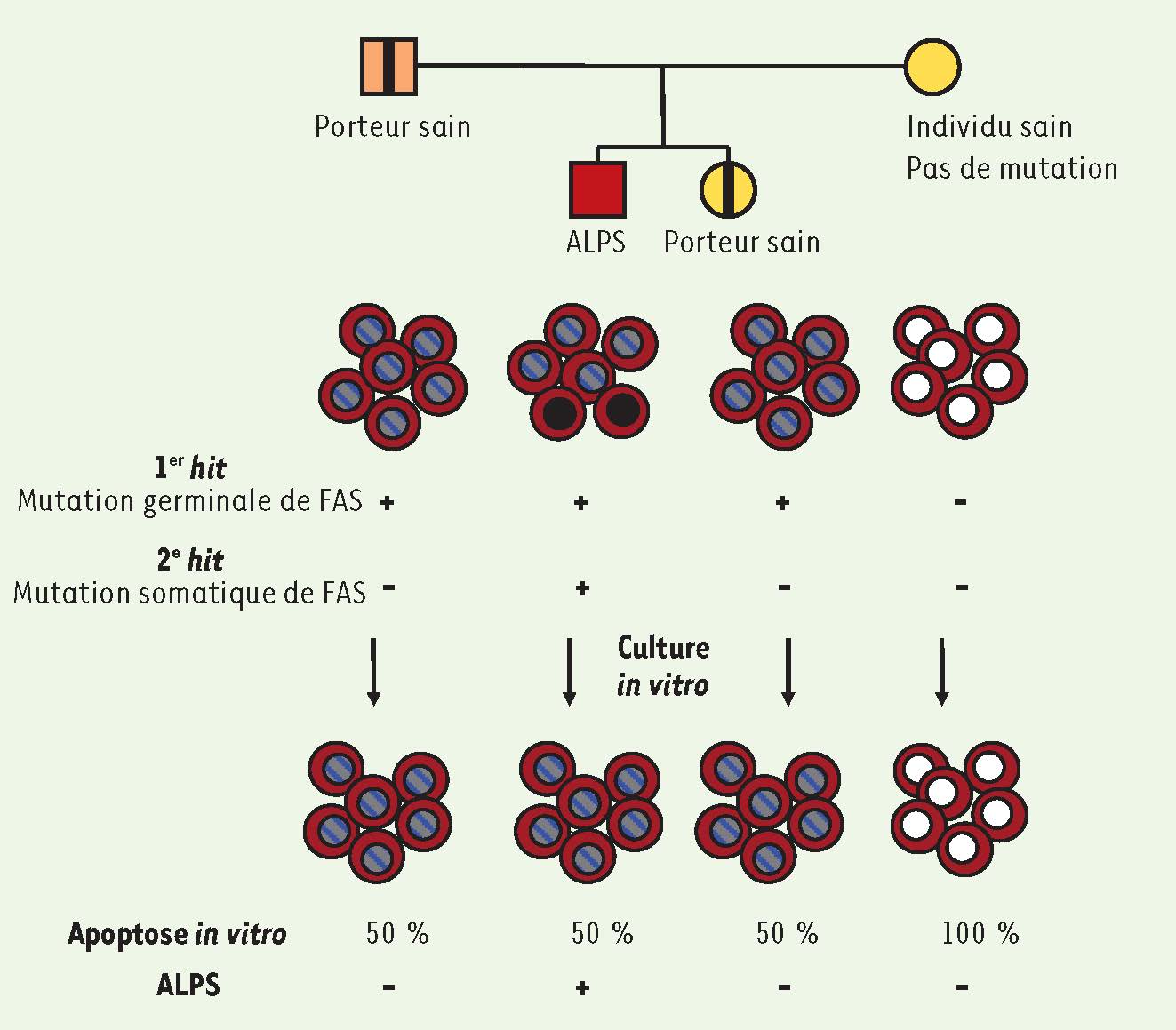
8]. Des manifestations auto-immunes sont retrouvées chez plus des deux tiers des patients ALPS, le plus souvent sous la forme de cytopénies auto-immunes (anémie hémolytique, thrombopénie, neutropénie). Le premier hit L’ALPS est associé à un défaut génétique de la voie de l’apoptose lymphocytaire induite par le récepteur de mort FAS [
6,
9]. Ainsi, un défaut complet ou partiel d’apoptose induite par FAS est mis en évidence dans les cellules des patients porteurs respectivement d’une mutation germinale homozygote ou hétérozygote du gène codant le récepteur de mort FAS 1. Plus récemment, des mutations somatiques de FAS ont été décrites dans des cas sporadiques d’ALPS [
10]. Chez ces patients, seulement 10 % à 20 % des lymphocytes T CD4 + ou CD8 + des patients portent la mutation du gène FAS, alors qu’elle est retrouvée dans plus de 80 % des LT DN (
Figure 1
). Le test fonctionnel d’apoptose in vitro est normal chez ces patients, car les cellules mutées disparaissent en culture au profit des cellules sauvages. Le diagnostic de ces patients est effectué sur la base de l’augmentation du ligand de FAS (FAS-L) plasmatique [
11], associée à l’augmentation de l’IL-10 plasmatique [
12] et des LT DN, observées chez tous les patients ALPS porteurs de mutations germinales comme de mutations somatiques de FAS.  | Figure 1
Modèle du two hit et conséquences sur le test d’apoptose in vitro et l’expression clinique.
|
Le deuxième hit Les mutations hétérozygotes germinales de FAS ne sont pas toujours associées à une expression clinique de la maladie (pénétrance clinique partielle). En effet, certains parents porteurs de mutations hétérozygotes de FAS restent asymptomatiques alors que leurs lymphocytes T activés présentent un défaut d’apoptose induite par FAS in vitro. Cette observation suggère qu’un deuxième événement est nécessaire à l’expression de la maladie chez les patients portants des mutations de FAS associées à une pénétrance incomplète. Nous avons réalisé une étude chez 7 patients ALPS porteurs de mutations hétérozygotes de FAS présentant une pénétrance incomplète, ainsi que chez 7 porteurs sains et 8 relatifs non mutés sains. Le séquençage du gène FAS des LT DN (isolés par tri cellulaire) de ces 7 patients a permis d’identifier une mutation somatique faux-sens sur le second allèle de FAS chez 3 patients [4]. La quantification de ces mutations somatiques montre qu’elles sont apparues au cours du développement embryonnaire ou plus tardivement, dans des précurseurs hématopoïétiques. Comme attendu, elles ne sont pas retrouvées dans les cellules des apparentés sains, qu’ils soient porteurs ou non de la mutation germinale. Chez 4 autres patients, le séquençage du gène FAS des LT DN ne détecte que l’allèle muté, alors que dans les lymphocytes CD4+, les deux allèles sont présents. En combinant des approches de génomique (comparative genomic hybridization, ou CGH array) et de cytogénétique (fluorescent in situ hybridization ou FISH) nous avons mis en évidence une unidisomie parentale partielle sur le chromosome 10. Des régions de 45 à 75 Mb, incluant la région 10q24 où est localisé le gène FAS, sont perdues sur le chromosome sain et sont remplacées par duplication de la région équivalente du chromosome muté. En conséquence, les LT DN et une fraction des lymphocytes CD4+ et CD8+ sont homozygotes pour la mutation germinale qui était initialement hétérozygote (
Figure 1
). L’acquisition de ces événements somatiques sur le second allèle de FAS conduit à une perte d’expression profonde du récepteur à la surface des lymphocytes, conférant ainsi aux cellules double mutantes un avantage sélectif in vivo. De façon intéressante, ces mutations somatiques secondaires sont observées principalement chez des patients porteurs de mutations germinales qui affectent le domaine extracellulaire de FAS. Ces mutations sont connues pour conduire à une diminution partielle de l’expression de FAS et à une faible pénétrance clinique par haplo-insuffisance. À l’inverse, des mutations faux-sens affectant le domaine intracellulaire de FAS conduisent à l’expression normale d’une protéine mutante qui peut alors exercer un effet dominant-négatif sur la protéine normale. Ces mutations sont associées à une pénétrance très élevée, et l’acquisition d’un second événement n’est pas nécessaire pour le déclenchement de la pathologie. Ainsi, comme pour certains cancers à prédisposition génétique comme le rétinoblastome, les conséquences fonctionnelles de la mutation germinale de FAS conditionneront la nécessité d’acquérir des mutations somatiques secondaires. |
La théorie de Goodnow s’applique aux maladies auto-immunes Ces résultats valident la théorie de Goodnow selon laquelle les maladies auto-immunes, à l’instar des cancers, peuvent être la conséquence de l’accumulation de mutations de gènes dont les produits sont des éléments centraux des différents points de contrôle de la tolérance au soi. Alors que les cancers peuvent résulter de mutations de gènes suppresseurs de tumeurs, les maladies auto-immunes pourraient être la conséquence de mutations de gène « suppresseurs d’auto-immunité », ici le gène FAS. Cette observation pourrait s’étendre à d’autres maladies auto-immunes. Pour cela, l’identification des populations lymphocytaires pathologiques, ou à défaut des populations pathognomoniques comme les LT DN dans l’ALPS, sera une étape-clé pour détecter et identifier les éventuels événements génétiques associés à ces maladies auto-immunes. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Michels
AW
,
Gottlieb
PA
. Autoimmune polyglandular syndromes . Nat Rev Endocrinol.
2010; ; 6 : :270.-277. 2.
Goodnow
CC
. Multistep pathogenesis of autoimmune disease . Cell.
2007; ; 130 : :25.-35. 3.
Burnet
FM
. A reassessment of the forbidden clone hypothesis of autoimmune disease . Aust J Exp Biol Med Sci.
1972; ; 50 : :1.-9. 4.
Magerus-Chatinet
A
,
Neven
B
,
Stolzenberg
MC
, et al. Onset of autoimmune lymphoproliferative syndrome ALPS in humans as a consequence of genetic defect accumulation . J Clin Invest.
2010 ; : décembre 22;
(online).. 5.
Rieux-Laucat
F
. Inherited and acquired death receptor defects in human Autoimmune Lymphoproliferative Syndrome . Curr Dir Autoimmun.
2006; ; 9 : :18.-36. 6.
Rieux-Laucat
F
. Autoimmune lymphoproliferative syndrome: an inherited or a somatic defect of apoptosis . Med Sci (Paris).
2006; ; 22 : :645.-650. 7.
Teachey
DT
,
Seif
AE
,
Grupp
SA
Advances in the management and understanding of autoimmune lymphoproliferative syndrome (ALPS) . Br J Haematol.
2010; ; 148 : :205.-216. 8.
Bleesing
JJ
,
Brown
MR
,
Straus
SE
, et al. Immunophenotypic profiles in families with autoimmune lymphoproliferative syndrome . Blood.
2001; ; 98 : :2466.-2473. 9.
Rieux-Laucat
F
,
Le Deist
F
,
Hivroz
C
, et al. Mutations in Fas associated with human lymphoproliferative syndrome and autoimmunity . Science.
1995; ; 268 : :1347.-1349. 10.
Holzelova
E, V.C.
,
Stolzenberg
MC
, et al. Autoimmune lymphoproliferative syndrome with somatic Fas mutations . N Engl J Med.
2004; ; 351 : p. :1409.-1418. 11.
Magerus-Chatinet
A
,
Stolzenberg
MC
,
Loffredo
MS
, et al. FAS-L, IL-10, and double-negative CD4- CD8- TCR alpha/beta+ T cells are reliable markers of autoimmune lymphoproliferative syndrome (ALPS) associated with FAS loss of function . Blood.
2009; ; 113 : :3027.-3030. 12.
Lopatin
U
,
Yao
X
,
Williams
RK
, et al. Increases in circulating and lymphoid tissue interleukin-10 in autoimmune lymphoproliferative syndrome are associated with disease expression . Blood.
2001; ; 97 : :3161.-3170. |