| |
| Med Sci (Paris). 2011 February; 27(2): 128–131. Published online 2011 March 8. doi: 10.1051/medsci/2011272128.Le microARN-16 Une clé de l’adaptation des neurones à la fluoxétine Anne Baudry,1 Sophie Mouillet-Richard,1 Benoît Schneider,1 Jean-Marie Launay,2 and Odile Kellermann1* 1Inserm UMR-S 747-Université Paris Descartes, 75006 Paris, France 2AP-HP Service de biochimie, Fondation FondaMental, Inserm U942, Hôpital Lariboisière, 2, rue Ambroise Paré, 75010 Paris, France MeSH keywords: Adaptation physiologique, effets des médicaments et des substances chimiques, Antidépresseurs de seconde génération, pharmacologie, Fluoxétine, Humains, microARN, physiologie, Neurones |
Le transporteur de la sérotonine : cible d’antidépresseurs comme le Prozac ®
Le système sérotoninergique, qui innerve de multiples régions du cerveau, contrôle les comportements alimentaires, sexuels, le cycle veille-sommeil, l’anxiété, l’humeur, etc. [
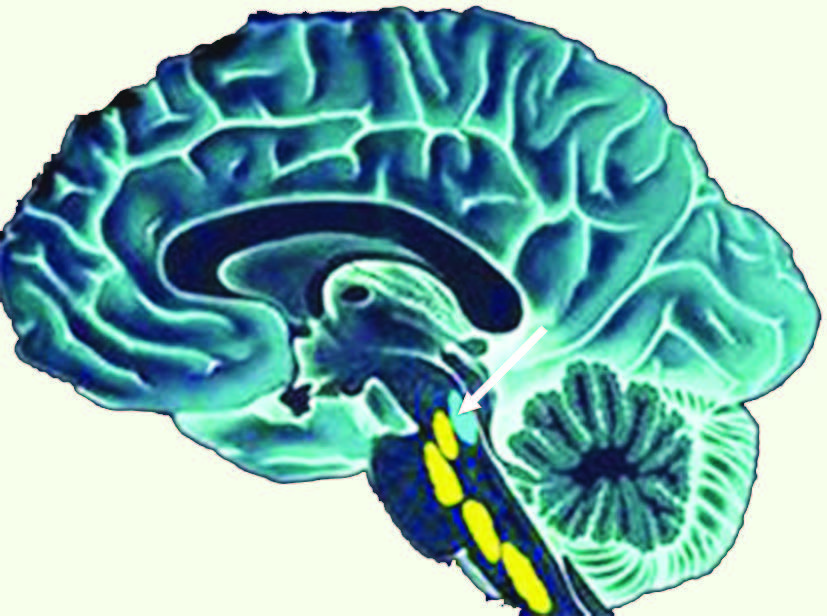
1]. La sérotonine (5-hydroxytryptamine, 5-HT) joue un rôle majeur dans la dépression, même si d’autres neurotransmetteurs comme la noradrénaline sont aussi impliqués. D’ailleurs, des connexions relient les neurones sérotoninergiques situés dans les noyaux du raphé aux neurones noradrénergiques concentrés dans le locus cœruleus (LC) (Figure 1). Les transporteurs de la sérotonine (SERT, serotonin transporter), de la noradrénaline ou de la dopamine assurent la recapture de ces neurotransmetteurs au niveau de la synapse. En régulant la concentration extracellulaire de ces monoamines, les transporteurs participent à la neurotransmission et sont la cible de nombreuses drogues et agents thérapeutiques (antidépresseurs, antipsychotiques, hallucinogènes, ecstasy, cocaïne, etc.) [
2].  | Figure 1
Schéma illustrant la localisation des neurones sérotoninergiques des noyaux du raphé (en jaune) et des neurones noradrénergiques du locus cœruleus (en bleu, flèche). Ils sont localisés au niveau du tronc cérébral, sous le cortex. |
Les états dépressifs sont associés à des déficits en 5-HT. Les antidépresseurs développés depuis les années 1960 visent donc principalement à augmenter la concentration en 5-HT au niveau de la synapse pour améliorer ou rétablir la neurotransmission sérotoninergique chez les patients déprimés [
3]. Le chef de file des antidépresseurs est la fluoxétine (Prozac®) qui est classée parmi les inhibiteurs sélectifs de la recapture de la sérotonine (SSRI, selective serotonin reuptake inhibitor) (fluoxétine/Prozac®, paroxétine, citalopram, sertraline, etc.). Le SERT est donc la cible des SSRI. Néanmoins, quel que soit l’antidépresseur considéré, l’observation clinique montre qu’il faut un délai d’environ trois semaines pour que l’éventuel effet bénéfique de l’antidépresseur soit objectivé. Ce délai indique qu’il existe des mécanismes d’adaptation des neurones aux antidépresseurs qui restaient jusqu’alors totalement énigmatiques. Les SSRI se fixent sur le SERT et bloquent sa fonction. Ils provoquent aussi une baisse de l’expression de cette protéine sans affecter le niveau des ARN messagers (ARNm) [
4]. Ceci indique que les SSRI mobilisent des mécanismes de régulation de l’expression du SERT à un niveau post-transcriptionnel. D’où l’idée d’explorer si des microARN (miR) pourraient moduler la traduction des ARNm du SERT et avoir in fine un impact sur la sensibilité des neurones aux SSRI en régulant le taux de synthèse du SERT. En effet, les miR sont des ARN non codants de 21 à 25 nucléotides qui, en s’appariant avec des ARNm cibles, répriment leur traduction ou provoquent leur dégradation [
5]. Bien que les miR émergent aujourd’hui comme des régulateurs de la différenciation et de l’homéostasie cellulaires [
12,
13], les signaux qui en régulent l’expression et celle de leurs protéines cibles restent peu connus. De nombreux miR sont exprimés dans le cerveau [
6]. Comment parvenir à identifier celui qui cible les ARNm du SERT et comment déterminer si les SSRI exercent leur action en interférant avec l’expression d’un miR ? |
La lignée 1C11 de cellules souches neuronales : un outil précieux pour identifier le rôle de miR-16 sur l’expression du SERT Une lignée de cellules souches neuroectodermiques a été établie par notre équipe à partir de cellules embryonnaires pluripotentes murines [
7]. Cette lignée, nommée 1C11, a la capacité, selon la nature des inducteurs, d’acquérir toutes les propriétés des neurones sérotoninergiques (1C115-HT) en quatre jours, ou des neurones noradrénergiques (1C11NE) en douze jours. Les ARNm codant pour le SERT sont présents dès le stade de cellule souche et leur niveau ne varie pas après l’induction des cellules dans chacune des voies de différenciation [
8]. Le SERT est fonctionnel au jour 4 de la différenciation sérotoninergique mais, comme in vivo, la protéine est absente dans les cellules 1C11NE. Chacun des programmes de différenciation recrute presque 100% des cellules, ce qui permet de quantifier par des approches pharmacologiques le nombre de molécules de SERT via la fixation des SSRI (paroxétine radioactive) et de rechercher si les neurones 1C115-HT
versus 1C11NE expriment de façon différentielle tel ou tel miR. Guidés par des prédictions in silico et des approches moléculaires, nous avons confirmé que miR-16 peut s’apparier à la région 3’UTR de l’ARNm du SERT et bloquer sa traduction [
9]. Ces premiers indices nous ont mis sur la piste de miR-16. Quel est le statut de miR-16 dans la lignée 1C11 ? Son niveau est faible dans les neurones 1C115-HT qui expriment le transporteur. En revanche il est élevé dans les neurones 1C11NE et pourrait donc empêcher la traduction illégitime des ARNm du SERT qui sont présents dans les neurones noradrénergiques. De fait, en neutralisant miR-16 par des anti-miR-16 (oligonucléotides anti-sens de miR-16) dans les cellules 1C11NE, on permet la synthèse du SERT et les cellules 1C11NE deviennent capables de fixer les SSRI. De plus, les cellules 1C11NE conservent leurs fonctions noradrénergiques mais se mettent à synthétiser la 5-HT et à exprimer l’ensemble des fonctions sérotoninergiques. Ces observations dévoilent une plasticité intrinsèque des neurones noradrénergiques qui possèdent des ARNm « dormants » codant pour les fonctions sérotoninergiques. Ces ARNm sont silencieux en raison d’un taux élevé de miR-16 et une chute du niveau de ce miR confère à ces neurones 1C11NE une sensibilité aux SSRI et la capacité de produire de la 5-HT. Le rôle de miR-16 sur cette plasticité neuronale a été mis en évidence dans le cerveau. Comme dans la lignée 1C11, le niveau de miR-16 est faible dans les noyaux sérotoninergiques du raphé, alors qu’il est fort dans les neurones noradrénergiques du LC. L’introduction d’un anti-miR16 dans le LC dévérouille la traduction des ARNm du SERT. Le LC synthétise alors le transporteur et peut donc fixer les SSRI. De plus, les neurones noradrénergiques acquièrent un phénotype mixte et sont capables de libérer de la 5-HT en plus de la noradrénaline. |
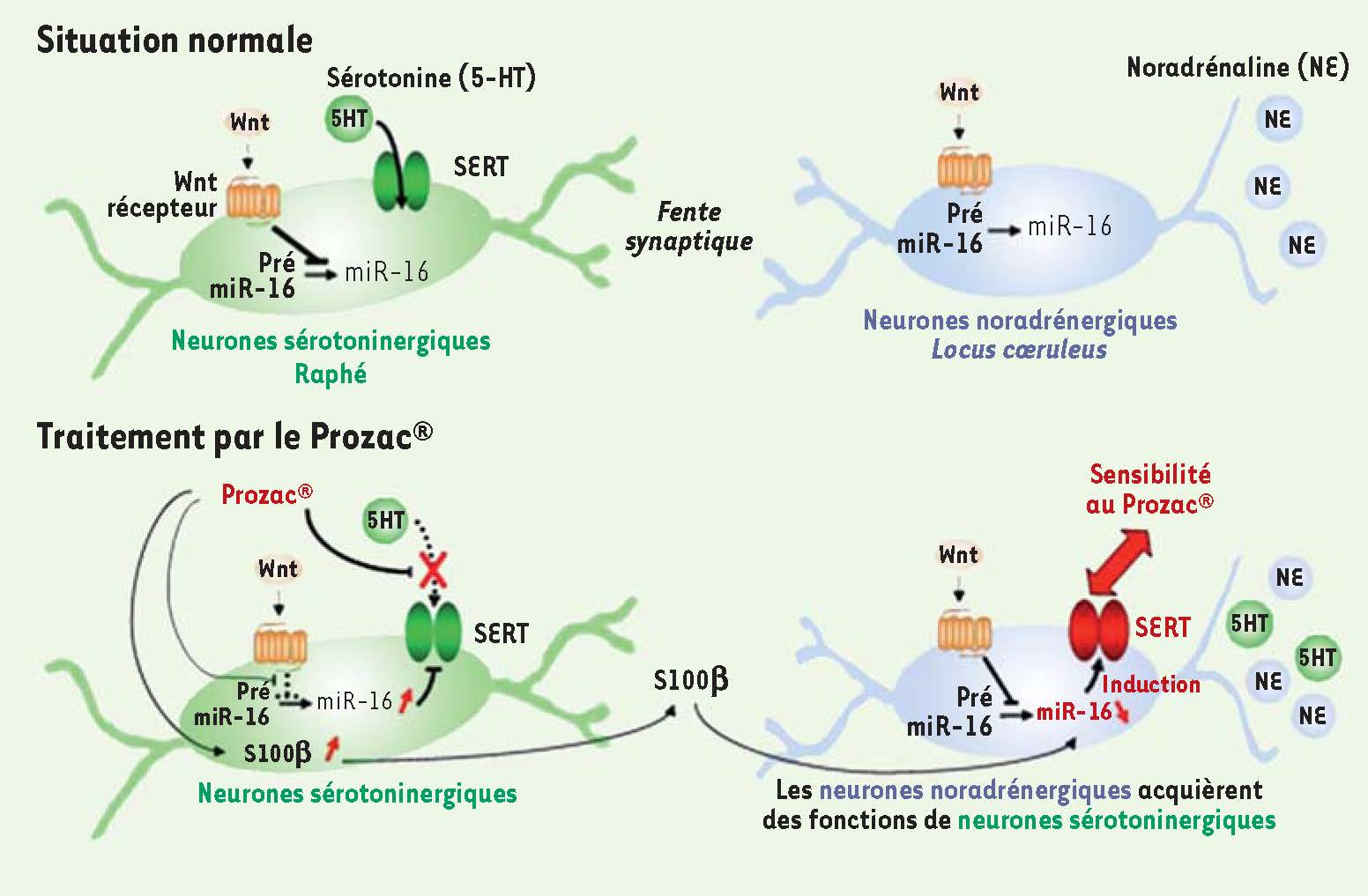
La fluoxétine modifie les propriétés des neurones noradrénergiques du locus cœruleus via la régulation de miR-16 L’enjeu a été ensuite d’évaluer si un traitement par les SSRI pouvait avoir un impact sur le niveau de miR-16 dans le raphé et dans le LC (Figure 2). Chez la souris, l’injection stéréotaxique de fluoxétine dans le raphé pendant trois jours provoque une augmentation de miR-16 et une diminution de moitié du nombre de molécules de SERT. miR-16 est bien responsable de cette baisse car une injection de miR-16 dans le raphé mime l’action de la fluoxétine sur le SERT. Dans le LC, l’injection de fluoxétine n’a pas d’effet comme nous pouvions le prévoir du fait de l’absence de SERT. En revanche, l’injection de fluoxétine dans le raphé provoque une baisse de miR-16 dans le LC qui libère, comme dans les cellules 1C11NE, l’expression du SERT et d’autres fonctions sérotoninergiques. Les neurones noradrénergiques synthétisent de novo de la 5-HT et le LC devient une nouvelle source de sérotonine dans le cerveau. Afin de se rapprocher des conditions d’administration des antidépresseurs aux patients, des souris ont reçu une dose quotidienne de fluoxétine (par voie intrapéritonéale pendant vingt jours). Ce traitement systémique induit également une baisse de miR-16 et l’apparition du SERT dans le LC.  | Figure 2
Mécanisme selon lequel les neurones noradrénergiques deviennent sensibles à la fluoxétine (mieux connue sous le nom de Prozac®). Dans les neurones sérotoninergiques du raphé, le Prozac® bloque la recapture de la sérotonine (5-HT) par le transporteur (SERT). De plus, en contrecarrant la voie de signalisation Wnt qui favorise la maturation des pré-miR-16 en miR-16, il augmente le niveau de miR-16, ce qui entraîne une diminution de la synthèse du SERT. Le Prozac® provoque également la libération du facteur neurotrophique S100β par les neurones sérotoninergiques. S100β sert de relais entre les neurones du raphé et ceux du locus cœruleus via leurs connexions. Au niveau des neurones noradrénergiques du locus cœruleus, S100β fait chuter le niveau de miR-16, ce qui dévérouille la traduction du SERT à partir des ARNm dormants et l’expression d’autres fonctions sérotoninergiques. Les neurones à noradrénaline synthétisent le SERT et deviennent sensibles au Prozac® ; ils représentent aussi une nouvelle source de sérotonine dans le cerveau. |
Cette étude apporte la première démonstration qu’un médicament peut exercer son action en interférant avec les mécanismes de régulation des miR. Les gènes codant les miR sont transcrits sous la forme de précurseurs (pré-miR) qui, après clivage, génèrent des miR matures [12]. Le taux d’un miR dépend de l’efficacité de transcription du gène et/ou de celle des étapes de maturation. Dans le raphé comparé au LC, le niveau de pré-miR-16 est inversement corrélé au niveau de miR-16. Il existe donc des mécanismes intrinsèques qui régissent une maturation différentielle des pré-miR-16 dans ces deux régions du cerveau. Dans le raphé, la fixation de fluoxétine au SERT augmente la conversion des pré-miR-16 en miR-16. Les voies de signalisation qui contrôlent la maturation des miR sont peu décrites [
10]. Nous avons mis en évidence que la voie Wnt, connue pour son rôle dans l’embryogenèse et l’homéostasie des cellules souches, est impliquée dans la réponse aux SSRI [9]. Une co-injection d’activateurs de la voie Wnt canonique et de fluoxétine abolit l’effet de ce SSRI. La fluoxétine augmente donc le niveau de miR-16 dans le raphé en contrecarrant la voie Wnt canonique. À l’inverse, la baisse de miR-16 observée dans le LC est associée à une activation de la voie Wnt. Le rôle majeur de miR-16 dans l’action de la fluoxétine a été confirmé par des tests comportementaux chez la souris [9] : une injection de miR-16 dans le raphé ou d’anti-miR16 dans le LC a un impact proche de celui d’un traitement par la fluoxétine dans des modèles de dépression (collaboration avec Hoffmann-LaRoche, Bâle). À ce stade, une question majeure restait non résolue : comment la fixation de fluoxétine sur le SERT des neurones sérotoninergiques du raphé peut-elle provoquer la chute du niveau de miR-16 dans le LC ? |
Transmission de la réponse à la fluoxétine des neurones sérotoninergiques aux neurones noradrénergiques par S100β Des connexions existent entre le raphé et le LC (Figure 1). Lors d’un traitement par le Prozac®, le raphé mobilise la plasticité des neurones noradrénergiques du LC afin qu’ils synthétisent de novo SERT et 5-HT. Comment identifier, parmi la constellation de signaux qui contrôlent les fonctions cérébrales, le signal émis par le raphé en réponse à la fluoxétine et responsable de la chute de miR-16 dans le LC ? Une seule solution : revenir à la lignée 1C11 et rechercher quelle molécule pouvait être produite par les cellules 1C115-HT exposées à la fluoxétine. Le relais est assuré par S100β, une protéine neurotrophique qui fixe le calcium [
11]. Les cellules 1C115-HT, comme celles du raphé, répondent aux SSRI en augmentant leur sécrétion de S100β, et le niveau de miR-16 diminue dans les cellules 1C11NE exposées à S100β. Dans le LC, une injection de S100β provoque une diminution de miR-16 et rend les neurones noradrénergiques compétents pour synthétiser SERT et 5-HT. La synergie des approches in vitro et in vivo a permis de révéler les liens fonctionnels entre la fluoxétine, miR-16, le transporteur de la sérotonine et la molécule-signal, S100β, qui relaie l’action des SSRI du raphé au LC (
Figure 2
). |
Ces travaux dévoilent comment les antidépresseurs alimentent un dialogue entre le raphé et le LC et mobilisent la plasticité des neurones noradrénergiques pour exercer leur action. Ils apportent un nouvel éclairage à la théorie des monoamines [3], développée dès la fin des années 1950, qui stipule que les états dépressifs sont associés à des déficits de neurotransmissions sérotoninergique et noradrénergique dans le cerveau. Cette théorie fut confortée par la mise sur le marché des antidépresseurs dont la consommation mondiale concerne presque 20 millions de personnes (1 personne sur 5 en France). Cette étude démontre surtout le rôle central de miR-16 dans la régulation de l’expression du SERT et dans la réponse adaptative des neurones sérotoninergiques et noradrénergiques à un traitement par les SSRI. Chaque maillon de la chaîne de réactions mobilisée par la fluoxétine constitue, dès lors, un crible voire une cible thérapeutique potentielle qui devrait permettre de mieux cerner la pharmacodynamie des antidépresseurs. |
Ces travaux sont issus d’une fructueuse collaboration avec P. Weil-Malherbe, V. Mutel, F. d’Agostini, G. Zürcher, E. Borroni, M. Bühler et N. Pieron (Hoffmann-LaRoche, Bâle).
|
1.
Azmitia
EC
. Serotonin and brain: evolution, neuroplasticity, and homeostasis . Int Rev Neurobiol.
2007; ; 77 : :31.-56. 2.
Torres
GE
,
Gainetdinov
RR
,
Caron
MG
. Plasma membrane monoamine transporters: structure, regulation and function . Nat Rev Neurosci.
2003; ; 4 : :13.-25. 3.
Krishnan
V
,
Nestler
EJ
. The molecular neurobiology of depression . Nature.
2008; ; 455 : :894.-902. 4.
Benmansour
S
,
Owens
WA
,
Cecchi
M
, et al.
Serotonin clearance in vivo is altered to a greater extent by antidepressant-induced downregulation of the serotonin transporter than by acute blockade of this transporter . J Neurosci.
2002; ; 22 : :6766.-6772. 5.
Bartel
DP
. MicroRNAs: target recognition and regulatory functions . Cell.
2009; ; 136 : :215.-233. 6.
Kosik
KS
. The neuronal microRNA system . Nat Rev Neurosci.
2006; ; 7 : :911.-920. 7.
Mouillet-Richard
S
,
Mutel
V
,
Loric
S
, et al.
Regulation by neurotransmitter receptors of serotonergic or catecholaminergic neuronal cell differentiation . J Biol Chem.
2000; ; 275 : :9186.-9192. 8.
Launay
JM
,
Schneider
B
,
Loric
S
, et al.
Serotonin transport and serotonin transporter-mediated antidepressant recognition are controlled by 5-HT2B receptor signaling in serotonergic neuronal cells . FASEB J.
2006; ; 20 : :1843.-1854. 9.
Baudry
A
,
Mouillet-Richard
S
,
Schneider
B
, et al.
miR-16 targets the serotonin transporter: a new facet for adaptive responses to antidepressants . Science.
2010; ; 329 : :1537.-1541. 10.
Inui
M
,
Martello
G
,
Piccolo
S
. MicroRNA control of signal transduction . Nat Rev Mol Cell Biol.
2010; ; 11 : :252.-263. 11.
Donato
R
,
Sorci
G
,
Riuzzi
F
, et al.
S100B’s double life: intracellular regulator and extracellular signal . Biochim Biophys Acta.
2009; ; 1793 : :1008.-1022. 12.
Dunoyer
P
. Arche de Noé immunologique : la bataille du silence - Mécanisme et inhibition du RNA silencing au cours des interactions plante/virus . Med Sci (Paris).
2009; ; 25 : :505.-511. 13.
Finoux
AL
,
Chartrand
P
. Micro-ARN : oncogènes et suppresseurs de tumeurs . Med Sci (Paris).
2008; ; 24 : :1049.-1054. |