| |
| Med Sci (Paris). 2011 February; 27(2): 163–169. Published online 2011 March 8. doi: 10.1051/medsci/2011272163.Les syncytines Des protéines d’enveloppe rétrovirales capturées au profit du développement placentaire Anne Dupressoir and Thierry Heidmann1* 1Unité des rétrovirus endogènes et éléments rétroïdes des eucaryotes supérieurs, UMR 8122 CNRS, Institut Gustave Roussy, 39, rue Camille Desmoulins, 94805 Villejuif, France |
Rétrovirus endogènes et évolution des génomes Au cours de l’évolution, les vertébrés ont été exposés à de multiples vagues d’infection par les rétrovirus. Par leur capacité remarquable à intégrer leur ADN dans le génome de la cellule cible, certains rétrovirus se sont insérés dans la lignée germinale de leur hôte. Ils ont ensuite été transmis verticalement de génération en génération, de façon mendélienne. Suite à de nombreux événements d’amplification, ces rétrovirus endogènes (ou ERV pour endogenous retroviruses) forment maintenant des familles multigéniques représentant une partie considérable du génome des vertébrés (8 à 10 % chez l’homme et la souris) [
1]. Dans leur très grande majorité, ces provirus, qui ne sont pas soumis à une pression de sélection, ont été progressivement rendus inactifs par simple accumulation de mutations ou de délétions. De ce fait, parmi l’ensemble des copies d’une famille d’ERV, seuls quelques éléments sont restés infectieux ; c’est le cas notamment pour les familles KoRV (koala retrovirus) du Koala [
2], MLV (murine leukemia virus) et MMTV (mouse mammary tumor virus) endogènes de la souris [
3] ou enJSRV (endogenous jaagsiekte sheep retrovirus) de la brebis [
4]. D’autres rares ERV n’ont conservé qu’une partie de leurs gènes viraux fonctionnels pendant plusieurs millions d’années après leur intégration. La préservation de ces gènes au cours de l’évolution suggère une pression de sélection opérée par l’hôte en raison d’un rôle bénéfique apporté par ces ERV. Un exemple particulièrement remarquable concerne la « capture » fonctionnelle du gène viral env. Ce gène, qui code la glycoprotéine d’enveloppe du rétrovirus, a été sélectionné pour son rôle physiologique majeur dans la placentation des mammifères euthériens. |
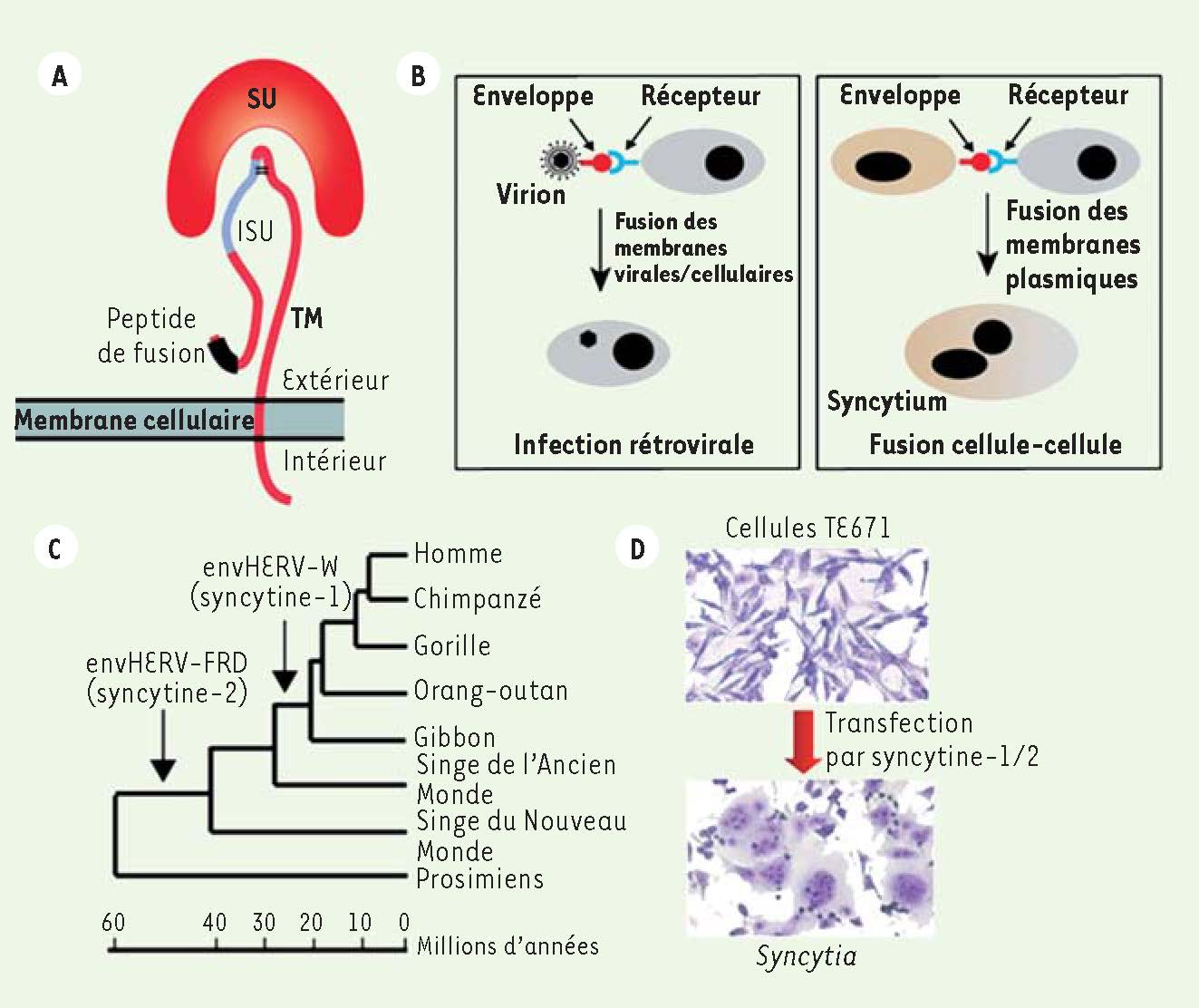
Rôles de la protéine d’enveloppe rétrovirale : du cycle viral jusqu’à une fonction biologique cellulaire La protéine d’enveloppe est essentielle à l’entrée du virus dans la cellule cible lors du cycle infectieux. Elle est composée de deux sous-unités associées à la surface de la cellule infectée puis embarquées dans le virion ayant bourgeonné à partir de la cellule infectée. Lors de l’infection, la sous-unité de surface (SU), située à l’extérieur du virion, se lie spécifiquement à un récepteur cellulaire à la surface de la cellule cible. Puis la sous-unité d’ancrage transmembranaire (TM) induit la fusion entre la membrane du virus et la membrane plasmique de la cellule cible grâce à un peptide de fusion (Figure 1A et 1B)
. La nucléocapside virale est alors libérée dans le cytoplasme de la cellule. Certaines glycoprotéines d’enveloppe « endogénéisées » ont conservé les propriétés des enveloppes infectieuses telles que la liaison à un récepteur, avec des conséquences physiologiques importantes pour les cellules ou les organismes les exprimant. Les gènes d’enveloppe Fv-4 (Fv pour Friend virus susceptibility) et Rmcf (resistance to MCF virus) chez la souris, et envJSRV chez le mouton, par exemple, confèrent une résistance à l’infection par des rétrovirus exogènes en interférant avec les récepteurs et en limitant la disponibilité de ceux-ci à la membrane [4,
5]. Par ailleurs, de même que certaines infections virales (VIH [virus d’immunodéficience humaine], rougeole) conduisent à la fusion des membranes des cellules infectées, des protéines d’enveloppe d’ERV, exprimées à la surface d’une cellule, sont capables d’induire la fusion avec une cellule partenaire qui exprime à sa surface le récepteur adéquat (Figure 1B). Ces fusions aboutissent à la formation d’une cellule géante multinucléée, appelée syncytium. Ces enveloppes fusiogènes ont été découvertes pour la première fois parmi des rétrovirus endogènes du génome humain. 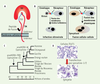 | Figure 1
Caractéristiques des syncytines-1 et -2, deux protéines d’enveloppe d’origine rétrovirale acquises par le génome primate. A. Représentation schématique de la protéine d’enveloppe rétrovirale, avec les deux sous-unités de surface (SU) et transmembranaire (TM), son peptide de fusion et son domaine immunosuppresseur (ISU). B. Conséquences de l’interaction entre un récepteur cellulaire et une protéine d’enveloppe présente à la surface d’un virion (cycle rétroviral infectieux) ou d’une cellule (expression par un rétrovirus intégré/introduction par transfection). C. Arbre phylogénétique de l’évolution des primates, les flèches indiquant la date d’acquisition des deux syncytines humaines. D. Fusion cellule-cellule médiée par le gène syncytine-1 ou -2 introduit par transfection dans des cellules humaines TE671 en culture. Les cellules ont été colorées par le May-Grünwald-Giemsa 48 heures après transfection. |
|
Présence de gènes d’enveloppe codants dans le génome humain Une recherche exhaustive de gènes d’enveloppe codants dans le génome humain n’a révélé que 18 protéines d’enveloppe putatives [
6,
7]. Parmi celles ayant potentiellement une fonction, citons la protéine ERV-3, d’expression placentaire et codée par un gène proviral présent chez les Hominoïdae et les singes de l’Ancien Monde [
8]. Cependant, la découverte d’un codon stop à l’état homozygote chez 1 % de la population humaine a exclu une fonction physiologique essentielle pour cette protéine [
9]. L’attention s’est alors portée sur deux glycoprotéines d’enveloppe, l’une codée par un élément de la famille HERV-W (human endogenous retrovirus-W) [
10,
11], l’autre par un élément de la famille HERV-FRD [
12]. Les deux gènes d’enveloppe sont exprimés spécifiquement dans le placenta et leur introduction dans des cellules en culture entraîne la formation de syncytia (Figure 1D), d’où leur appellation de syncytine-1 et syncytine-2. Les deux protéines interagissent avec des récepteurs distincts : le récepteur des rétrovirus de type D (RDR/ASCT-2, pour sodium-dependent neutral amino acid transporter type 2) pour la syncytine-1 [10] et une protéine transmembranaire MFSD2 (major facilitator superfamily domain containing 2A) pour la syncytine-2 [
13]. Des analyses génomiques comparatives ont révélé que la syncytine-1 est apparue dans le génome primate après la spéciation Hominoïdae/singes de l’Ancien Monde, il y a environ 25 millions d’années (Ma) [
14]. La syncytine-2, plus ancienne, est codée par une séquence conservée chez tous les singes, hormis les prosimiens, depuis plus de 40 Ma (Figure 1C) [12]. Enfin, leur très faible taux de polymorphisme dans la population humaine [
15] plaide en faveur d’une fonction physiologique essentielle. Les différentes caractéristiques de ces protéines d’enveloppe ont conduit à formuler l’hypothèse qu’elles serviraient à édifier un constituant essentiel du placenta, le syncytiotrophoblaste. |
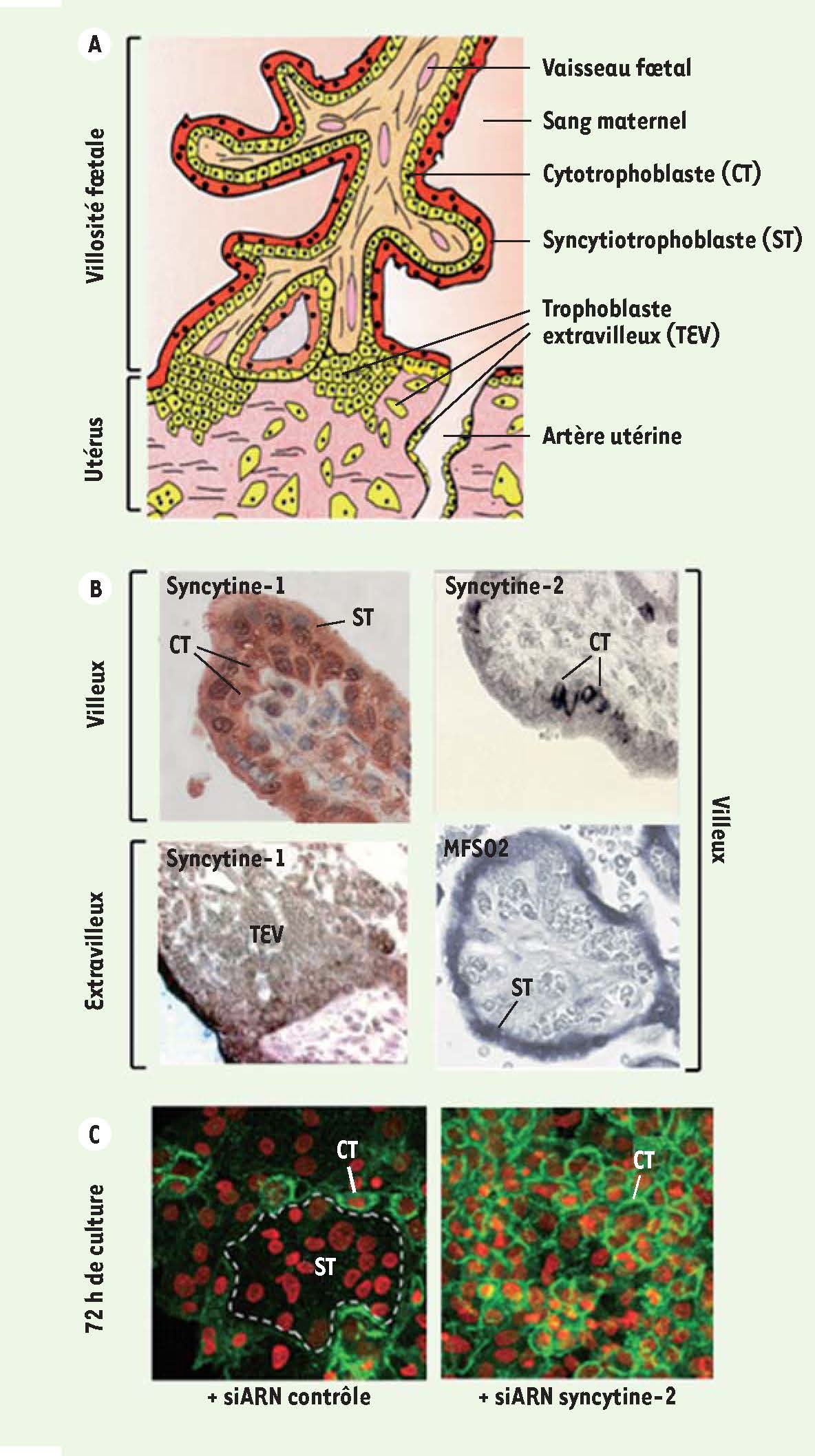
Développement placentaire humain Le placenta est un organe transitoire dont la fonction première est d’assurer les échanges entre le fœtus et sa mère. Il est également le lieu d’une tolérance immunologique permettant le maintien du fœtus, porteur d’antigènes paternels, au sein de l’organisme maternel. Ce tissu d’origine fœtale est issu des cellules périphériques du blastocyste1, les trophoblastes. Ceux-ci font partie des rares cellules de l’organisme humain - avec les myoblastes, les macrophages et les ovocytes et spermatozoïdes - capables de fusion cellulaire. À partir du 6e jour de gestation (J6), les trophoblastes fusionnent en un syncytiotrophoblaste plurinucléé extrêmement invasif permettant l’implantation de l’embryon dans la muqueuse utérine [
16]. À partir de J15, se développent les villosités choriales, véritables unités fonctionnelles du placenta. Elles sont parcourues par des vaisseaux fœtaux et flottent dans l’espace intervilleux sanguin maternel ou s’ancrent dans l’utérus maternel (Figure 2A). Le syncytiotrophoblaste recouvre maintenant la surface externe des villosités flottantes. Il est formé de manière continue par la fusion des cytotrophoblastes mononucléés sous-jacents et éliminé régulièrement par apoptose dans la circulation sanguine maternelle. Ce tissu essentiel, en contact direct avec le sang maternel, assure des fonctions d’échange (O2, CO2, nutriments, etc.) entre la mère et le fœtus, de sécrétion d’hormones stéroïdiennes et d’hCG (hormone chorionique gonadotropique), de régulation de la réponse immune [
17] ou encore de protection contre d’éventuels pathogènes [
18]. Enfin, issus d’une deuxième voie de différenciation, des trophoblastes dits extravilleux, situés à la base des villosités ancrées, acquièrent un phénotype invasif qui les fait migrer dans la décidua utérine - où ils se différencient en cellules géantes - ainsi que dans les artères utérines où ils vont progressivement remplacer les cellules endothéliales [16] (Figure 2A).
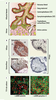 | Figure 2
Implication des syncytines-1 et -2 dans le développement placentaire humain. A. Schéma simplifié du développement placentaire humain au stade villeux (J18-terme) (modifié d’après [ 16]). B. Localisation de l’expression des syncytines-1 et -2 (expériences d’immunohistochimie réalisées sur coupes de placenta du 1 er trimestre [
21,
37]) et du récepteur de la syncytine-2, MFSD2 (expériences d’hybridation in situ sur coupes de placenta du 3 e trimestre [ 13]), dans le placenta humain. C. Fusion de cellules trophoblastiques humaines en culture primaire après 72 heures de culture, suite à l’extinction de l’expression de la syncytine-2 par siARN [
23]. Un marquage avec un anticorps anti-desmoplakine colore les membranes des cellules en vert, et une coloration à l’iodure de propidium marque les noyaux en rouge ; une zone de noyau dépourvue de membranes (pointillés) caractérise un syncytium. |
|
Implication des syncytines dans le développement placentaire humain L’implication des syncytines dans le développement placentaire a été suggérée par des études de localisation de leur expression in situ. La syncytine-1, exprimée de manière peu spécifique dans le placenta, est détectée dans tous les trophoblastes des lignages villeux (cytotrophoblastes et syncytiotrophoblaste) et extravilleux [
19,
20] (Figure 2B). En revanche, la syncytine-2 est détectée dans une fraction des cytotrophoblastes des villosités [21] et son récepteur, MFSD2, est exprimé dans le syncytiotrophoblaste [13] (Figure 2B). L’expression très régulée des deux partenaires syncytine-2/MFSD2 dans des types cellulaires distincts, permettrait l’incorporation, par fusion, des cytotrophoblastes mononucléés dans le syncytiotrophoblaste adjacent, tout en évitant que les cytotrophoblastes ne fusionnent entre eux. Ce processus permettrait la croissance et le renouvellement du tissu syncytial tout au long de la grossesse [13]. Dans des modèles de différenciation spontanée de cytotrophoblastes établis en culture primaire, l’extinction de la syncytine-2 et, dans une moindre mesure, celle de la syncytine-1, par ajout d’oligonucléotides antisens ou par ARN interférence (siARN), diminuent fortement l’efficacité de fusion et la production d’hCG associée [
22, 23] (Figure 2C). L’ensemble de ces données plaide en faveur d’un rôle majeur de la syncytine-2 (qui agit probablement en synergie avec la syncytine-1) dans la différenciation des cytotrophoblastes en syncytiotrophoblaste. Bien que d’autres facteurs aient été identifiés in vitro comme étant impliqués dans ce processus, tels que l’externalisation des phosphatidylsérines, la connexine 43, cadhérine 11, CD98, caspase 8 et ZO-1 (zona occludens) [
24,
25], les véritables effecteurs sont sans nul doute les syncytines, grâce à leurs propriétés fusiogènes. Notons qu’il n’existe pas de données sur l’implication éventuelle des syncytines dans la formation du syncytiotrophoblaste invasif des stades implantatoires précoces, l’accès à ces stades étant quasiment impossible chez l’homme. Par ailleurs, d’autres protéines d’enveloppe, appartenant à des provirus des familles HERV-V et HERV-Pb, sont également exprimées dans le placenta mais leur rôle éventuel dans la placentation reste à établir [
26]. L’hypothèse a été faite qu’une perturbation de l’expression des syncytines pourrait être à l’origine de pathologies de la gestation associées à des défauts de formation du syncytiotrophoblaste (pré-éclampsie, retard de croissance intra-utérin, certains cas de mort embryonnaire précoce, placenta de fœtus atteints de trisomie 21, ou encore choriocarcinome) ou d’invasion extravilleuse. Les études conduites sur des placentas pathologiques font état d’une expression modifiée de l’une ou l’autre des syncytines [
27,
28], mais l’implication causale des syncytines dans ces pathologies reste à déterminer. |
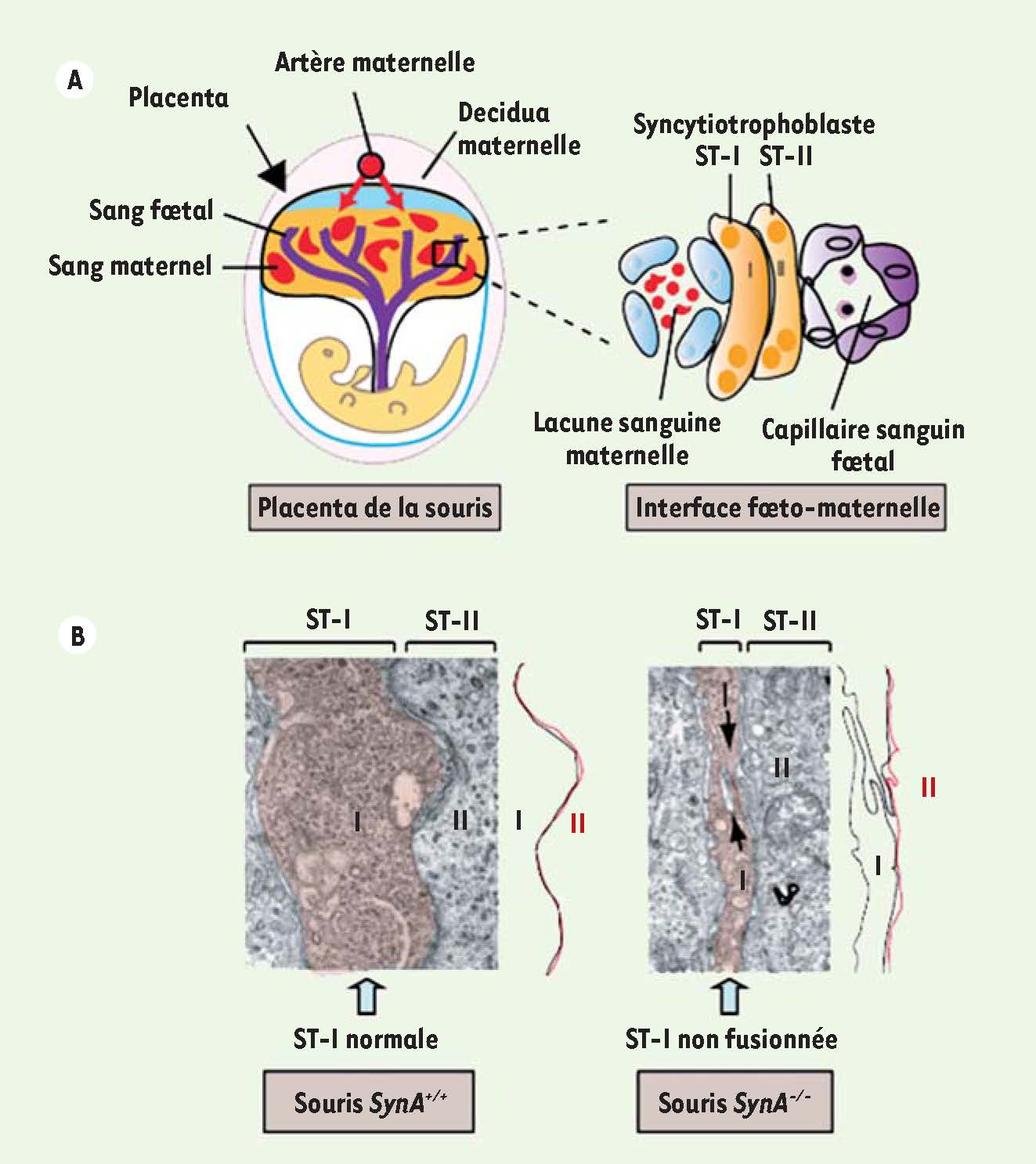
Découverte des syncytines chez la souris : un rôle non équivoque dans la placentation Les gènes codant les syncytines ont été recherchés chez la souris, première étape pour obtenir un modèle animal expérimental permettant d’étudier leur rôle. De manière remarquable, le séquençage complet du génome murin a révélé deux gènes d’enveloppes rétrovirales, nommés syncytine-A et -B, distincts des syncytines humaines mais partageant leurs caractéristiques [
29] : ils sont exprimés dans le placenta, ont des propriétés fusiogènes, et sont conservés depuis leur intégration chez l’ancêtre des Muridae (rat, souris, hamster, campagnol et gerbille) il y a plus de 25 Ma. L’invalidation du gène codant la syncytine-A chez la souris a des conséquences radicales puisque les embryons homozygotes pour la délétion meurent in utero à mi-gestation [
30]. L’architecture placentaire de ces embryons est perturbée, avec une accumulation de trophoblastes non fusionnés, et un défaut de fusion d’une des deux couches de syncytiotrophoblaste (Figure 3A, B), entraînant une diminution des échanges fœto-maternels, un retard de croissance puis la mort de l’embryon. Ces souris apportent la première démonstration d’un rôle essentiel des syncytines dans la placentation. Elles constituent également un modèle d’étude de l’implication de ces gènes dans les pathologies placentaires humaines associées à des défauts de fusion. L’obtention de souris invalidées pour le gène codant la syncytine-B devrait apporter des informations sur les rôles respectifs des deux gènes de syncytines qui diffèrent par leur spécificité de fusion [29] et qui pourraient agir indépendamment pour former les deux couches de syncytiotrophoblaste présentes chez les muridae (Figure 3A). 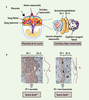 | Figure 3
Anomalies de placentation dans les souris invalidées pour le gène codant la syncytine-A. A. Représentation schématique du placenta de souris et agrandissement de l’interface fœto-maternelle montrant la présence, chez les muridae, de deux couches de syncytiotrophoblaste (ST-I, ST-II). B. Vue en microscopie électronique de l’interface fœto-maternelle montrant que la couche de ST-II n’est pas fusionnée chez les souris invalidées pour le gène codant la syncytine-A. |
|
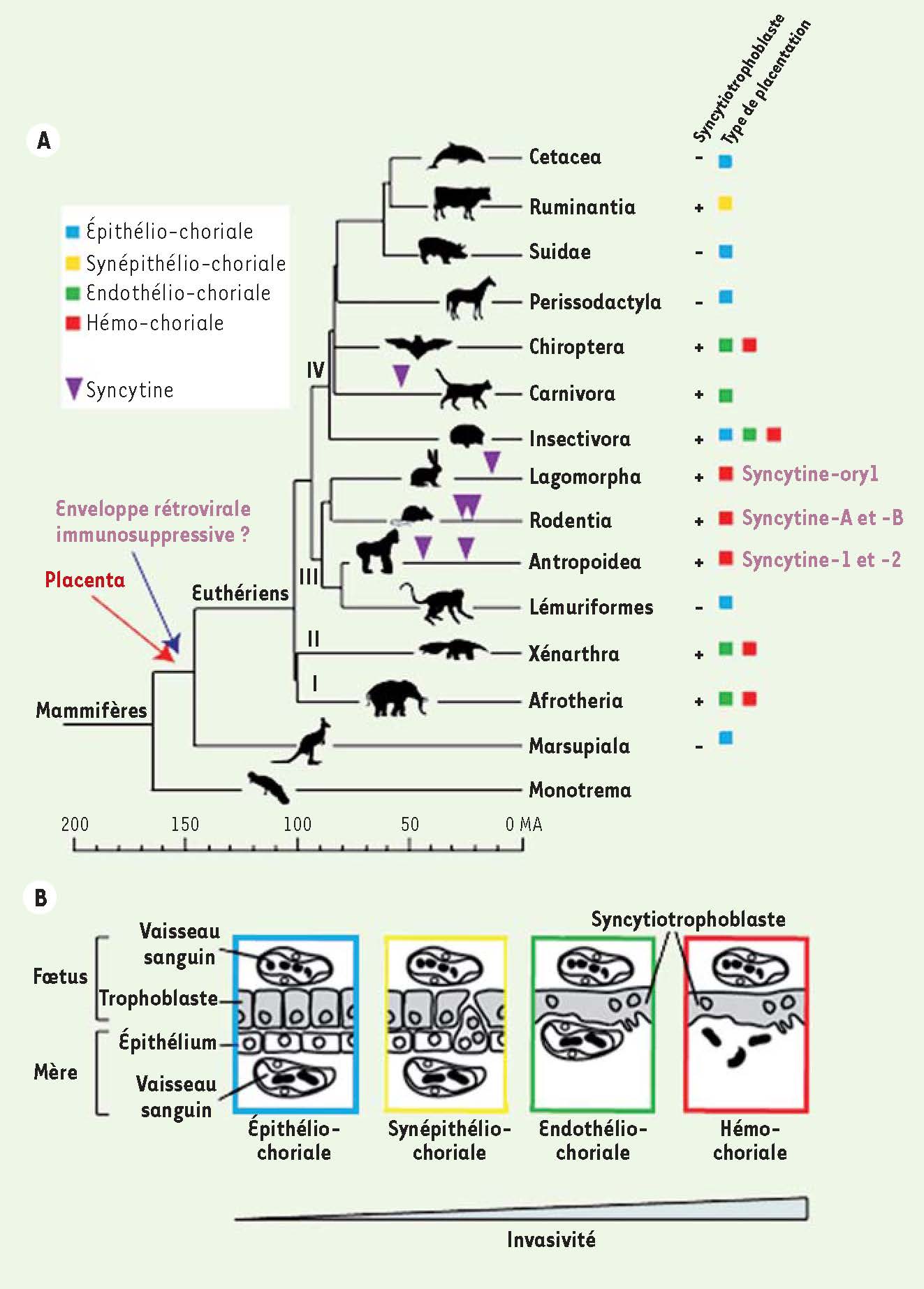
Des syncytines chez les autres mammifères Les gènes codant les syncytines des primates et des rongeurs, bien que possédant des propriétés analogues, ne sont clairement pas des gènes orthologues - insérés au même emplacement dans le génome -, indiquant des événements de capture indépendants. De même, une cinquième syncytine, syncytine-ory1, distincte des quatre autres, a été identifiée dans une troisième branche des mammifères, les léporidae (tels que le lapin, le lièvre) [
31] (Figure 4A). Cette enveloppe fusiogène, à expression placentaire, est conservée depuis plus de 12 Ma et partage son récepteur ASCT2 avec celui de la syncytine-1 humaine. Enfin, à ceci s’ajoute la mise en évidence très récente d’un gène de syncytine fonctionnel chez les carnivores (Cornelis et al., communication personnelle) qui ont divergé des euarchontoglires (primates, rongeurs, lagomorphes) il y a plus de 90 Ma (Figure 4A). Ceci prouve de manière non ambiguë que la cooptation de gènes d’enveloppe d’origine rétrovirale s’est produite indépendamment et de manière répétée durant l’évolution des mammifères. Elle aurait permis à plusieurs reprises l’émergence d’une barrière syncytiale placentaire, révélant un remarquable phénomène de convergence évolutive. De manière intéressante, l’anatomie comparée fait apparaître une grande diversité des structures placentaires d’une espèce à l’autre. Celles-ci diffèrent principalement par le degré d’invasion de l’utérus maternel par les trophoblastes recouvrant le blastocyste au moment de l’implantation et par la composition de l’interface fœto-maternelle qui en découle (Figure 4B). Dans le placenta de type épithélio-chorial (cheval, porc), le trophoblaste fœtal, non syncytial et non invasif, est simplement apposé à l’épithélium utérin intact. Dans les placentas de types synépithélio-chorial (ruminants), endothélio-chorial (carnivores) et hémo-chorial (humain, souris, lapin), le syncytiotrophoblaste fœtal invasif élimine une par une les différentes couches de tissu maternel, jusqu’à se trouver directement en contact avec le sang maternel (Figure 4B). Or la diversité des structures placentaires ne peut pas être prédite par la simple taxonomie des espèces et la manière dont elles ont évolué reste encore largement débattue [
32]. Il sera donc particulièrement intéressant de déterminer dans quelle mesure la nature - degré de fusiogénicité, profil d’expression, identité du récepteur etc. - des syncytines capturées dans chaque espèce pourrait rendre compte de manière simple de la diversité des morphologies syncytiales observée.  | Figure 4
Capture des syncytines et diversite des structures placentaires chez les mammiferes. A. Arbre phylogenetique de l’evolution des mammiferes, avec les differents types de placentation, la presence ou non de structures syncytiales et la date d’entree des syncytines identifiees. Les quatre groupes majeurs au sein des eutheriens sont : i, afrotheria ; ii, xenarthra ; iii, euarchontoglires et iv, laurasiatheria. B. Representation schematique de la barriere fœto-maternelle des differents types de placentation decrits chez les mammiferes. |
Enfin, soulignons que l’importance de la capture de gènes dans la morphogenèse placentaire ne se limite pas aux gènes de syncytines. En effet, chez la brebis, des expériences d’injection in utero d’oligonucléotides antisens ont montré que les gènes d’enveloppe d’une famille d’ERV (enJSRV) sont impliqués dans la différenciation et la régulation de la croissance placentaires lors de l’implantation [
33]. De même deux gènes, Peg10 (paternally expressed gene 10) et Rtl1, conservés chez tous les mammifères euthériens et dérivés de l’insertion de rétrotransposons sushi-ichi2 à LTR (long terminal repeat), contrôlent l’un le développement précoce et l’autre le développement tardif de la placentation (revue dans [
34,
38]). Même si la fonction précise de ces gènes reste à établir, c’est la preuve que la capture de gènes issus de rétroéléments a probablement été un événement d’innovation majeur dans l’évolution du placenta. |
Un rôle immunosuppresseur pour les syncytines ? Il a été montré que les enveloppes de rétrovirus infectieux possèdent une activité immunosuppressive essentielle pour la propagation virale [
35]. Or, les syncytines auraient conservé cette propriété de leur ancêtre infectieux, puisqu’au moins une d’entre elles, à la fois chez les primates (syncytine-2) et chez les rongeurs (syncytine-B), s’est avérée être immunosuppressive, dans des tests in vivo basés sur l’inhibition du rejet de tumeurs par le système immunitaire de la souris [
36]. Cette activité est portée par un domaine spécifique (ISU pour immunosuppressive domain) de la sous-unité transmembranaire de l’enveloppe (Figure 1A), et un acide aminé critique pour cette fonction immunosuppressive a été identifié. Cette propriété des syncytines pourrait jouer un rôle dans l’établissement de la tolérance immunologique de la mère vis-à-vis de l’unité fœto-placentaire qui exprime des antigènes paternels histo-incompatibles. Elle pourrait même constituer la fonction première des syncytines, avant leur fonction de fusion. La possibilité de générer des souris exprimant une syncytine-B mutée qui a perdu sélectivement ses propriétés immunosuppressives mais garde intactes ses propriétés de fusion [36] permettra de tester expérimentalement cette hypothèse. Enfin, un scénario plus audacieux peut être envisagé, selon lequel l’émergence, il y a plus de 100 Ma, d’un placenta prototype chez un vertébré ovipare a bénéficié de la capture d’une enveloppe rétrovirale fondatrice dotée des capacités immunosuppressives de son ancêtre viral et qui aurait permis la prise de greffe des tissus fœtaux dans l’organisme maternel. Cette enveloppe ancestrale aurait ensuite été remplacée dans les différentes branches des mammifères, à la suite de l’infection par de nouveaux rétrovirus et de la capture des enveloppes rétrovirales que ces virus ont apportées et que l’on découvre maintenant à la faveur du séquençage des génomes. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Nous remercions D. Evain-Brion et B. Barbeau pour la mise à disposition des photographies des Figures 2B et 2C, respectivement.
|
Footnotes |
1.
Ribet
D
,
Heidmann
T
. Formation et évolution des rétrovirus endogènes . Virologie.
2010; ; 14 : :141.-150. 2.
Tarlinton
RE
,
Meers
J
,
Young
PR
. Retroviral invasion of the koala genome . Nature.
2006; ; 442 : :79.-81. 3.
Boeke
JD
,
Stoye
JP
. Retrotransposons, endogenous retroviruses, and the evolution of retroelements . In :
Coffin
JM
,
Hughes
SH
,
Varmus
HE
, eds. Retroviruses . New York: : Cold Spring Harbor Laboratory Press; , 1997 : :343.-435. 4.
Varela
M
,
Spencer
T
,
Palmarini
M
,
Arnaud
F
. The special relationship between endogenous retroviruses and their host . Ann NY Acad Sci.
2009; ; 1178 : :157.-172. 5.
Best
S
,
Le Tissier
PR
,
Stoye
JP
. Endogenous retroviruses and the evolution of resistance to retroviral infection . Trends Microbiol.
1997; ; 313 : :313.-318. 6.
de Parseval
N
,
Lazar
V
,
Bénit
L
, et al.
Survey of human genes of retroviral origin: identification and transcriptome of the genes with coding capacity for complete envelope proteins . J Virol.
2003; ; 77 : :10414.-10422. 7.
Villesen
P
,
Aagaard
L
,
Wiuf
C
,
Pedersen
FS
. Identification of endogenous retroviral reading frames in the human genome . Retrovirology.
2004; ; 1 : :32.. 8.
Herve
CA
,
Forrest
G
,
Lower
R
, et al.
Conservation and loss of the ERV3 open reading frame in primates . Genomics.
2004; ; 83 : :940.-943. 9.
De Parseval
N
,
Heidmann
T
. Physiological knockout of the envelope gene of the single-copy ERV-3 human endogenous retrovirus in a fraction of the caucasian population . J Virol.
1998; ; 72 : :3442.-3445. 10.
Blond
JL
,
Lavillette
D
,
Cheynet
V
, et al.
An envelope glycoprotein of the human endogenous retrovirus HERV-W is expressed in the human placenta and fuses cells expressing the type D mammalian retrovirus receptor . J Virol.
2000; ; 74 : :3321.-3329. 11.
Mi
S
,
Lee
X
,
Li
X
, et al.
Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis . Nature.
2000; ; 17 : :785.-789. 12.
Blaise
S
,
de Parseval
N
,
Bénit
L
,
Heidmann
T
. Genomewide screening for fusogenic human endogenous retrovirus envelopes identifies syncytin 2, a gene conserved on primate evolution . Proc Natl Acad Sci USA.
2003; ; 100 : :13013.-13018. 13.
Esnault
C
,
Priet
S
,
Ribet
D
, et al.
A placenta-specific receptor for the fusogenic, endogenous retrovirus-derived, human syncytin-2 . Proc Natl Acad Sci USA.
2008; ; 105 : :17532.-17537. 14.
Mallet
F
,
Bouton
O
,
Prudhomme
S
, et al.
The endogenous retroviral locus ERVWE1 is a bona fide gene involved in hominoid placental physiology . Proc Natl Acad Sci USA.
2004; ; 101 : :1731.-1736. 15.
de Parseval
N
,
Diop
G
,
Blaise
S
. Comprehensive search for intra-and inter-specific sequence polymorphisms among coding envelope genes of retroviral origin found in the human genome: genes pseudogenes . BMC Genomics.
2005; ; 6 : :117.. 16.
Alsat
E
,
Malassine
A
,
Tarrade
A
, et al.
Le cytotrophoblaste humain, un casse-tête pour le biologiste . Med Sci (Paris).
1999; ; 15 : :1236.-1243. 17.
Le Bouteiller
P
,
Tabiasco
J
. Immunologie de la grossesse : faits nouveaux . Med Sci (Paris).
2006; ; 22 : :745.-750. 18.
Guibourdenche
J
,
Fournier
T
,
Malassine
A
,
Evain-Brion
D
. Development and hormonal functions of the human placenta . Folia Histochem Cytobiol.
2009; ; 47 : :S35.-S42. 19.
Muir
A
,
Lever
AML
,
Moffett
A
. Human endogenous retrovirus-W envelope (syncytin) is expressed in both villous and extravillous trophoblast populations . J Gen Virol.
2006; ; 87 : :2067.-2071. 20.
Malassiné
A
,
Handschuh
K
,
Tsatsaris
V
, et al.
Expression of HERV-W Env glycoprotein (syncytin) in the extravillous trophoblast of first trimester human placenta . Placenta.
2006; ; 26 : :556.-562. 21.
Malassine
A
,
Blaise
S
,
Handschuh
K
, et al.
Expression of the fusogenic HERV-FRD Env glycoprotein (syncytin 2) in human placenta is restricted to villous cytotrophoblastic cells . Placenta.
2006; ; 28 : :185.-191. 22.
Frendo
JL
,
Olivier
D
,
Cheynet
V
, et al.
Direct involvement of HERV-W Env glycoprotein in human trophoblast cell fusion and differentiation . Mol Cell Biol.
2003; ; 23 : :3566.-3574. 23.
Vargas
A
,
Moreau
J
,
Landry
S
, et al.
Syncytin-2 plays an important role in the fusion of human trophoblast cells . J Mol Biol.
2009; ; 18 : :301.-318. 24.
Pötgens
AJG
,
Drewlo
S
,
Kokozidou
M
,
Kaufmann
P
. Syncytin: the major regulator of trophoblast fusion? Recent developments and hypotheses on its action . Human Reprod Update.
2004; ; 10 : :487.-496. 25.
Malassiné
A
,
Frendo
JL
,
Evain-Brion
D
. Trisomy 21- affected placentas highlight prerequisite factors for human trophoblast fusion and differentiation . Int J Dev Biol.
2010; ; 54 : :475.-482. 26.
Blaise
S
,
de Parseval
N
,
Functional
Heidmann T
. characterization of two newly identified human endogenous retrovirus coding envelope genes . Retrovirology.
2005; ; 2 : :19.. 27.
Lee
X
,
Keith
JC
Jr
,
Stumm
N
, et al.
Downregulation of placental syncytin expression and abnormal protein localization in pre-eclampsia . Placenta.
2001; ; 22 : :808.-812. 28.
Kukada
W
,
Oda
T
,
Jinno
Y
, et al.
Cellular localization of placenta-specific human endogenous retrovirus (HERV) transcripts and their possible implication in pregnancy-induced hypertension . Placenta.
2008; ; 29 : :282.-289. 29.
Dupressoir
A
,
Marceau
G
,
Vernochet
C
, et al.
Syncytin-A and syncytin-B, two fusogenic placenta-specific murine envelope genes of retroviral origin conserved in Muridae . Proc Natl Acad Sci USA.
2005; ; 102 : :725.-730. 30.
Dupressoir
A
,
Vernochet
C
,
Bawa
O
, et al.
Syncytin-A knockout mice demonstrate the critical role in placentation of a fusogenic, endogenous retrovirus-derived, envelope gene . Proc Natl Acad Sci USA.
2009; ; 106 : :12127.-12132. 31.
Heidmann
O
,
Vernochet
C
,
Dupressoir
A
,
Heidmann
T
. Identification of an endogenous retroviral envelope gene with fusogenic activity, placenta-specific expression in the rabbit: a new “syncytin” in a third order of mammals . Retrovirology.
2009; ; 27 : :107.. 32.
Carter
AM
,
Mess
A
. Evolution of the placenta in eutherian mammals . Placenta.
2007; ; 28 : :259.-262. 33.
Dunlap
KA
,
Palmarini
M
,
Varela
M
, et al.. Endogenous retroviruses regulate periimplantation placental growth and differentiation . Proc Natl Acad Sci USA.
2006; ; 103 : :14390.-14395. 34.
Rawn
SM
,
Cross
JC
. The evolution, regulation, and function of placenta-specific genes . Annu Rev Cell Dev Biol.
2008; ; 24 : :159.-181. 35.
Schlecht-Louf
G
,
Renard
M
,
Mangeney
M
, et al.
Retroviral infection in vivo requires an immune escape virulence factor encrypted in the envelope protein of oncoretroviruses . Proc Natl Acad Sci USA.
2010; ; 23 : :3782.-3787. 36.
Mangeney
M
,
Renard
M
,
Schlecht-Louf
G
, et al.
Placental syncytins: genetic disjunction between the fusogenic and immunosuppressive activity of retroviral envelope proteins . Proc Natl Acad Sci USA.
2007; ; 104 : :20534.-20539. 37.
Malassiné
A
,
Lavialle
C
,
Frendo
JL
, et al.
Syncytins in normal and pathological placentas . In:
Lever
AM
,
Jeang
KT
,
Berkhout
B
, eds.
Recent advances in human retroviruses: principles of replication and pathogenesis . Singapour: : World Scientific Publishing Co; , 2010. 38.
Proudhon
C
,
Bourc’his
D
. Évolution de l’empreinte parentale chez les mammifères Quelle ménagerie . Med Sci (Paris).
2010; ; 26 : :497.-503. |