| |
| Med Sci (Paris). 2011 March; 27(3): 232–234. Published online 2011 March 30. doi: 10.1051/medsci/2011273232.TRPV4, nouvelle cible thérapeutique des problèmes urinaires Mathieu Boudes,1,2* Pieter Uvin,1,2 and Dirk De Ridder1 1KU Leuven, Department of surgery, Laboratory of experimental urology, Campus Gasthuisberg, Herestraat 49, Louvain, Belgique 2KU Leuven, Department of molecular cell biology, Laboratory on channel research, Louvain, Belgique MeSH keywords: Humains, Canaux cationiques TRPV, antagonistes et inhibiteurs , physiologie, Vessie hyperactive, traitement médicamenteux, étiologie, Troubles mictionnels |
Une vie sociale épanouie passe par des mictions contrôlées. C’est le rôle qui est dévolu à la vessie. En effet, cet organe doit stocker l’urine et la libérer lorsque l’individu le décide. Ces fonctions apparemment simples sont régulées par des interactions complexes entre les systèmes nerveux, sensitif et moteur [
1]. Au sein de ce triangle signalétique (système nerveux sensoriel et moteur et vessie), la paroi interne de la vessie (urothélium) présente elle-même une fonction sensorielle en répondant à divers stimulus, comme l’augmentation de la taille de la vessie par exemple. En effet, les cellules urothéliales peuvent sécréter des molécules signalétiques telles que l’ATP, l’oxyde nitrique et l’acétylcholine dont la cible est principalement le muscle (muscle détrusor). De plus, elles expriment une grande variété de canaux ioniques, purinergiques, muscariniques, nicotiniques et TRP (transient receptor potential) [
2]. Les TRP appartiennent à une superfamille dont la découverte remonte à environ deux décennies. Il existe 28 TRP mammaliens qui sont classés selon l’homologie de leur séquence génétique en six sous-familles : TRPC (canonique), TRPM (mélastatine), TRPV (vanilloïde), TRPA (ankyrine), TRPP (polycystine) et TRPML (mucolipine) [
17]. Ces canaux TRP sont des senseurs cellulaires caractérisés par des mécanismes d’activation très variés [
3]. La combinatoire de leurs caractéristiques fonctionnelles en fait un élément-clé de la modulation de la fonction urinaire [
4]. Dans certaines conditions pathologiques, l’urothélium peut contribuer au développement de maladies de la vessie comme la cystite interstitielle et la vessie hyperactive. Ces deux syndromes affectent en Europe de l’Ouest environ 20 % de la population, et ces chiffres sont en constante augmentation du fait du vieillissement de la population. Les traitements existants (agents antimuscariniques agissant sur les récepteurs muscariniques de l’acétylcholine) sont parfois inefficaces et à l’origine de sérieux effets secondaires (bouche sèche, problèmes gastro-intestinaux, etc.) [
5]. Si l’on conçoit que les pathologies de la vessie causent de réels problèmes de confort dans la vie de tous les jours, des effets secondaires aussi gênants ne représentent cependant pas une réelle amélioration de la qualité de vie. Il est donc primordial de proposer de nouvelles thérapeutiques, ce qui peut être envisagé soit en améliorant la pharmacologie vis-à-vis des cibles déjà décrites, soit en découvrant de nouvelles cibles moléculaires, deux approches actuellement menées de front. C’est ainsi que de nombreuses études étayent le rôle de TRPV4 dans le fonctionnement normal ou pathologique de la vessie.  | Figure 1
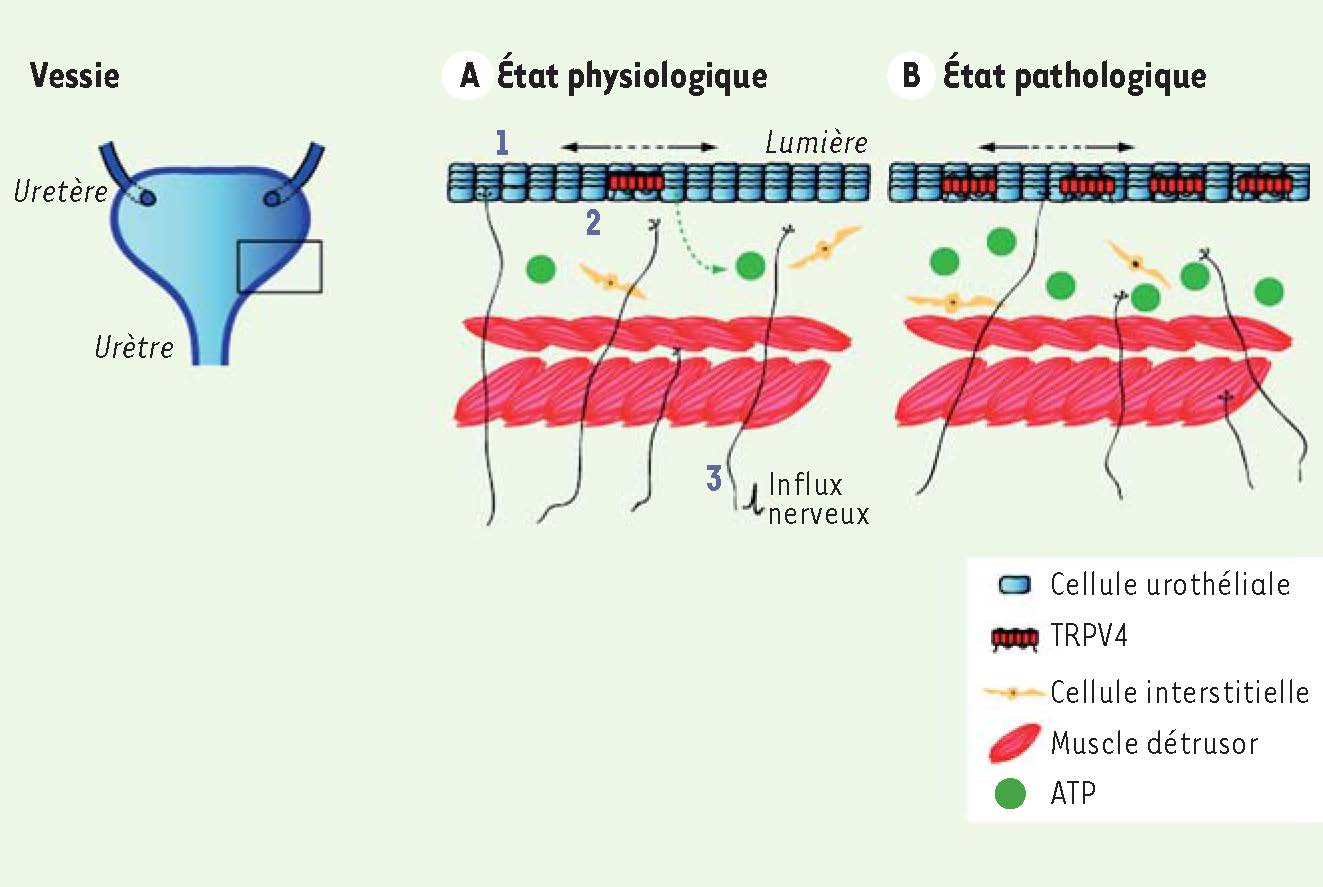
Explication schématique de l’implication de TRPV4 dans la pathophysiologie de la vessie. L’urine produite par les reins est stockée dans la vessie. Cela crée une distension de la paroi vésicale (1). A. En conditions physiologiques, la tension de l’urothélium est ressentie par TRPV4, qui permet la libération d’ATP par les cellules urothéliales (2). Ce médiateur se fixe alors à ses récepteurs au niveau des nerfs sensitifs qui innervent la vessie (3). Ceci entraîne l’activation des nerfs périphériques qui vont renseigner le système nerveux central du niveau de remplissage. B. Dans les conditions pathologiques, le mécanisme est identique. Cependant, la libération d’ATP est accrue et induit une activation plus importante du système nerveux périphérique. |
|
Expression fonctionnelle de TRPV4 par les cellules urothéliales La vessie est constituée de plusieurs couches : successivement à partir du lumen on trouve l’urothélium, la lamina propria (couche de cellules interstitielles et de tissu conjonctif) et deux couches de cellules musculaires lisses. TRPV4 est le canal TRP le plus exprimé tant au niveau de l’ARN messager [
6] que de la protéine [
7] au sein de l’urothélium. La protéine est localisée sur la surface abluminale des cellules urothéliales [7]. TRPV4 est un canal cationique non spécifique. Par conséquent, sa physiologie est souvent déterminée par imagerie calcique. En exposant des cultures de cellules urothéliales à un agoniste de TRPV4 (4α-PDD), il a été démontré que ce membre de la superfamille des TRP était fonctionnel chez le cochon d’Inde [
8], la souris [6,
9] et le rat [7], ce qui suggère une large distribution au sein du règne animal. Un des médiateurs de la communication entre l’urothélium et les afférences sensorielles est la sécrétion d’ATP par les cellules urothéliales. Cette sécrétion s’effectue au moment du remplissage de sa vessie [
10]. Ce dialogue est primordial dans l’établissement de la conscience de sa vessie par l’individu. Des cliniciens ont démontré que la communication purinergique était potentialisée chez les patients souffrant de cystite interstitielle [
11]. TRPV4 est un canal dont un des modes d’activation est l’étirement membranaire. En culture, les cellules urothéliales murines libèrent de l’ATP, et cette sécrétion est altérée chez la souris knock-out pour l’expression de TRPV4, ce qui suggère fortement une implication de la protéine dans la physiologie in vitro des cellules urothéliales. |
Implication de TRPV4 dans la (patho)physiologie de la vessie L’établissement du rôle et du mécanisme d’une protéine dans une fonction physiologique ne présage en rien de son intérêt en tant que cible thérapeutique. En effet, il est nécessaire pour cela de déterminer son implication précise dans la pathologie puis dans un modèle animal reflétant une pathologie humaine. Tout d’abord, il a été démontré par délétion génétique et traitement pharmacologique que le canal TRPV4 avait un rôle primordial dans le comportement de miction des souris knock-out [
12,
13]. En effet, ces souris présentent un phénotype d’incontinence qui se caractérise par une diminution de la fréquence des mictions à laquelle s’ajoute l’apparition de contractions vésicales aberrantes. Ces symptômes seraient dus à : une diminution de la sécrétion d’ATP par l’urothélium, une diminution des propriétés contractiles des cellules du muscle lisse de la vessie et une moindre réponse de la vessie à la stimulation par l’ATP. Ces données corrèlent par conséquent la voie purinergique (ATP et récepteurs) au canal TRPV4 dans les conditions normales. Néanmoins, la pharmacologie de TRPV4 était jusqu’à présent peu et mal connue [
14]. Il devenait alors nécessaire de développer un antagoniste spécifique avec des propriétés pharmacocinétiques propres à l’étude de TRPV4 in vivo. Dans cet objectif, un modèle murin de cystite aiguë a été établi [
15] par injection de cyclophosphamide (agent alkylant utilisé comme anticancéreux) dont le métabolite, l’acroléine, provoque des dommages tissulaires [
16]. Les résultats récemment publiés dans les Proceedings of the National Academy of Sciences of USA [15] démontrent qu’un agent pharmacologique antagoniste de TRPV4 (nommé HC-0670747) est à même de moduler et d’annuler les effets délétères sur les paramètres urinaires créés par ce modèle murin de cystite. En effet, les souris traitées ne montrent plus de signe d’hyperactivité du muscle détrusor que ce soit en cystométrie1 après injection de fluide dans la vessie via un cathéter ou par l’étude du comportement de miction d’animaux conscients et libres de tout mouvement. Il reste maintenant à comprendre par quels mécanismes TRPV4 participe au maintien des symptômes de cystite et sur quels leviers il pourrait être utile de jouer afin d’améliorer la vie des patients. |
Le handicap et le coût de la prise en charge des patients souffrant d’hyperactivité de la vessie soulignent la demande importante de thérapies alternatives. Beaucoup de preuves suggèrent aujourd’hui que la suppression génétique et pharmacologique de TRPV4 augmente la capacité de la vessie en diminuant la transduction de la pression intravésicale par l’urothélium. Ainsi, et contrairement aux anti-muscariniques et à la toxine botulique qui ciblent l’appareil contractile de la vessie, les antagonistes de TRPV4 devraient s’avérer des acteurs de choix dans le traitement des problèmes de vessie en intervenant au niveau de l’initiation du signal sensoriel. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Fowler
CJ
,
Griffiths
D
,
de Groat
WC.
. The neural control of micturition . Nat Rev Neurosci.
2008; ; 9 : :453.-466. 2.
Birder
LA
,
Wolf-Johnston
AS
,
Chib
MK
, et al.
Beyond neurons: Involvement of urothelial and glial cells in bladder function . Neurourol Urodyn.
2010; ; 29 : :88.-96. 3.
Damann
N
,
Voets
T
,
Nilius
B.
. TRPs in our senses . Curr Biol.
2008; ; 18 : :R880.-R889. 4.
Birder
LA.
. TRPs in bladder diseases . Biochim Biophys Acta.
2007; ; 1772 : :879.-884. 5.
Andersson
KE
,
Chapple
CR
,
Cardozo
L
, et al.
Pharmacological treatment of overactive bladder: report from the International Consultation on Incontinence . Curr Opin Urol.
2009; ; 19 : :380.-394. 6.
Everaerts
W
,
Vriens
J
,
Owsianik
G
, et al.
Functional characterization of transient receptor potential channels in mouse urothelial cells . Am J Physiol Renal Physiol.
2010; ; 298 : :F692.-F701. 7.
Yu
W
,
Hill
WG
,
Apodaca
G
,
Zeidel
ML
. Expression and distribution of transient receptor potential (TRP) channels in bladder epithelium . Am J Physiol Renal Physiol.
2011
(sous-presse).. 8.
Xu
X
,
Gordon
E
,
Lin
Z
, et al.
Functional TRPV4 channels and an absence of capsaicin-evoked currents in freshly-isolated, guinea-pig urothelial cells . Channels (Austin).
2009; ; 3 : :156.-160. 9.
Yamada
T
,
Ugawa
S
,
Ueda
T
, et al.
Differential localizations of the transient receptor potential channels TRPV4 and TRPV1 in the mouse urinary bladder . Histochem Cytochem.
2009; ; 57 : :277.-287. 10.
Birder
LA.
. Urothelial signaling . Auton Neurosci.
2010; ; 153 : :33.-40. 11.
Sun
Y
,
Keay
S
,
De Deyne
PG
,
Chai
TC.
. Augmented stretch activated adenosine triphosphate release from bladder uroepithelial cells in patients with interstitial cystitis . Urol.
2001; ; 166 : :1951.-1956. 12.
Thorneloe
KS
,
Sulpizio
AC
,
Lin
Z
, et al.
N-([1S]-1- [4-(2S)-2[(2, 4-dichlorophenyl)sulfonyl]amino-3-hydroxypropa noyl[-1-piperazinyl]carbonyl-3-methylbutyl)-1-benzothiophene-2-carboxamid e (GSK1016790A), a novel and potent transient receptor potential vanilloid 4 channel agonist induces urinary bladder contraction and hyperactivity: Part I . Pharmacol Exp Ther.
2008; ; 326 : :432.-442. 13.
Gevaert
T
,
Vriens
J
,
Segal
A
, et al.
Deletion of the transient receptor potential cation channel TRPV4 impairs murine bladder voiding . Clin Invest.
2007; ; 117 : :3453.-3462. 14.
Vriens
J
,
Appendino
G
,
Nilius
B.
. Pharmacology of vanilloid transient receptor potential cation channels . Mol Pharmacol.
2009; ; 75 : :1262.-1279. 15.
Everaerts
W
,
Zhen
X
,
Ghosh
D
, et al.
Inhibition of the cation channel TRPV4 improves bladder function in mice and rats with cyclophosphamide-induced cystitis . Proc Natl Acad Sci USA.
2010; ; 107 : :19084.-19089. 16.
Philips
FS
,
Sternberg
SS
,
Cronin
AP
,
Vidal
PM.
. Cyclophosphamide and urinary bladder toxicity . Cancer Res.
1961; ; 21 : :1577.-1589. 17.
Vassort
G
,
Fauconnier
J.
. Les canaux TRP (transient receptor potential) : une nouvelle famille de canaux à expression variée . Med Sci (Paris).
2008; ; 24 : :163.-168. |