| |
| Med Sci (Paris). 2011 March; 27(3): 241–243. Published online 2011 March 30. doi: 10.1051/medsci/2011273241.Survivine, interprète du code histone mitotique Hong-Lien Vu1 and Annie Molla1* 1Inserm U823, Université Joseph Fourier, Domaine de la Merci, 38706 La Tronche Cedex, France MeSH keywords: Aurora kinases, Code histone, Protéines IAP, physiologie, Mitose, Protein-Serine-Threonine Kinases |
Au cours de la mitose, la cellule parentale donne naissance à deux cellules filles rigoureusement identiques. Le partage équitable du matériel génétique requiert une localisation parfaite du complexe dit « passager », un régulateur mitotique, au centre des kinétochores appariés [
1]. INCENP (inner centromere protein antigens 135/155kDa), boréaline, survivine et kinase Aurora B sont les constituants de ce régulateur [1]. Ce complexe dont l’expression est restreinte à la mitose et qui voyage des chromosomes vers le cytosquelette, assure la connexion entre les centromères et les microtubules et participe à l’alignement des chromosomes sur la plaque métaphasique. Il contrôle la bi-orientation des chromatides soeurs aux deux pôles du fuseau par un mécanisme d’essai-échec. Par sa possible fonction de détecteur de la tension du fuseau, il maintient actif le point de contrôle mitotique et joue un rôle prépondérant dans le déclenchement de l’anaphase [1]. La nature des facteurs qui recrutent le complexe et restreignent sa localisation sur le centromère intérieur était jusqu’à présent une énigme. Trois publications conjointes dans la revue Science ont permis de lever le voile sur ce mystère et apportent de nouvelles pièces au puzzle. |
Aurora B : une kinase au centre de l’activité du complexe passager Le centromère est constitué d’un assemblage particulier de nucléosomes qui recrutent des facteurs protéiques. Outre les histones canoniques (H2A, H2B, H3 et H4), cette région intègre des variants d’histones comme CENP-A (centromere protein A) en remplacement des histones H3 et H2A-Z [
2]. Les marques épigénétiques majeures caractérisant la mitose sont les phosphorylations, par la kinase Aurora B, de l’histone H3 sur la sérine (Ser) 10 et du variant CENP-A sur la ser 7 [
3]. Des marques épigénétiques plus précoces joueraient un rôle-clé dans le recrutement et la stabilisation du complexe passager et donc de la kinase Aurora B. Pendant la mitose, l’histone H3 est le siège d’une phosphorylation sur la thréonine (Thr) 3 en réponse à l’activation de la kinase haspine. D’après les travaux des groupes de Higgins et Funabiki, la phosphorylation de la Thr 3 de l’histone H3 intervient en amont du recrutement du complexe passager [
4,
5]. En effet, la protéine survivine reconnaît cette thréonine phosphorylée via son domaine à doigt de zinc de type BIR (baculoviral IAP repeat) et elle servira, par la suite, de plateforme pour le recrutement des autres membres du complexe [
6,
7]. Or, la déplétion de la kinase haspine dans des cellules eucaryotes entraîne un faible recrutement de MCAK (protéine de la famille des kinésines) aux centromères et prévient le déclenchement de l’anaphase via l’activation du point de contrôle du fuseau. Des effets similaires peuvent être observés par microinjection d’un peptide H3-Thr3-P ou d’un mutant survivine D70A/71A. En fait, toutes ces manipulations compromettent la localisation de la kinase Aurora B sur le centromère. Des expériences in vitro démontrent que la survivine lie le peptide H3-Thr3P en absence des autres protéines du complexe passager et cette interaction entraîne un changement conformationnel du domaine BIR. Inversement, la déphosphorylation du résidu Thr 3 de l’histone H3 débute dès le déclenchement de l’anaphase et est nécessaire à la décondensation des chromosomes. Toutes ces données ne permettent pas de comprendre pourquoi des fuseaux mitotiques se forment en absence de la kinase haspine. Toutefois ces fuseaux sont anormalement courts. Ceci suggère que d’autres voies indépendantes participent au recrutement de la kinase Aurora B sur les centromères. |
Deux marques épigénétiques nécessaires au recrutement du complexe passager En fait, le groupe de Y. Watanabe a montré que la phosphorylation de l’histone H3-Thr3 agissait de concert avec une autre modification portée par l’histone H2A [
8,
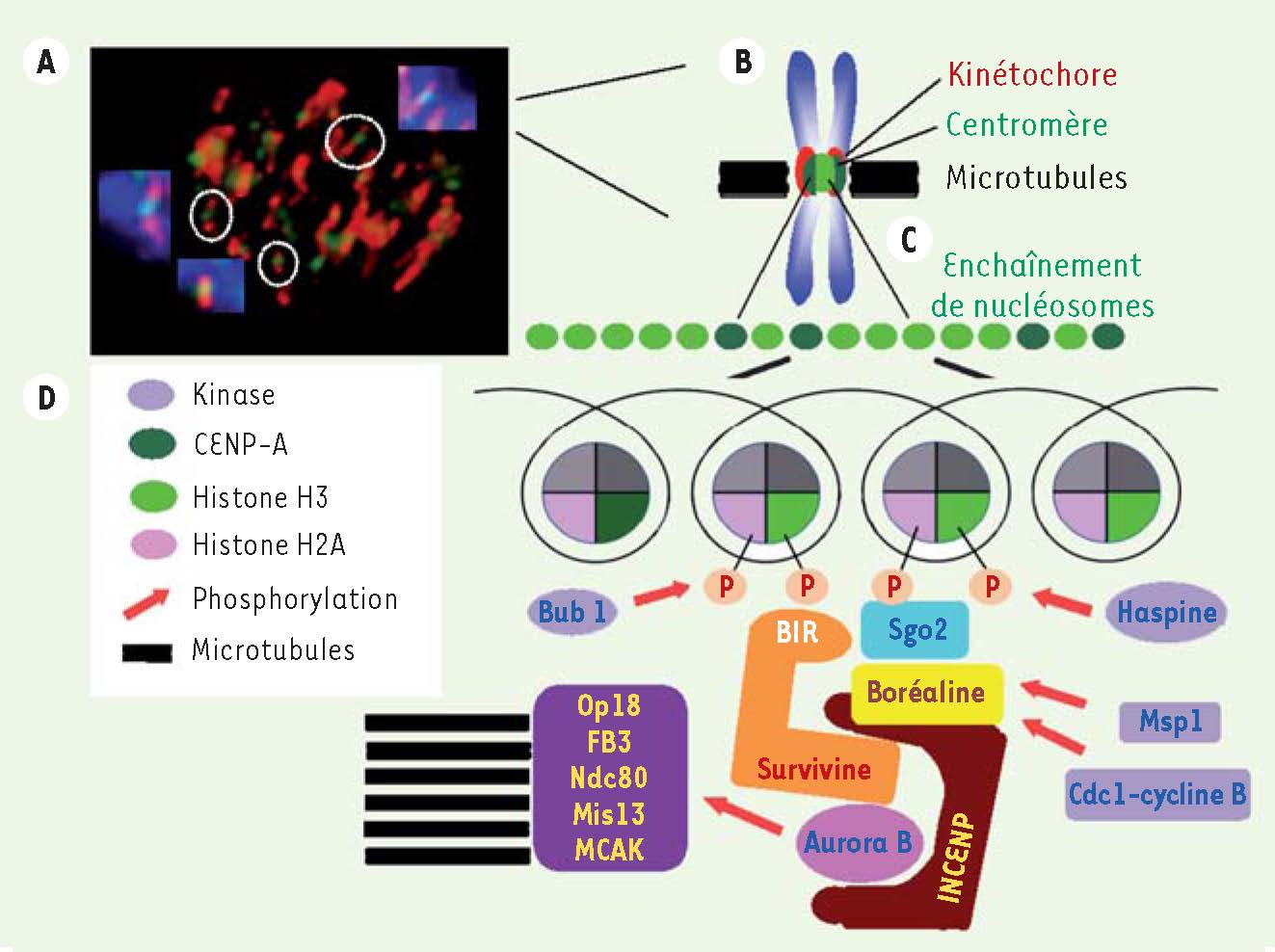
9]. En effet, au cours de la mitose, la kinase Bub1 est présente sur les centromères internes et phosphoryle la Ser 210 de l’histone H2A recrutant ainsi les protéines shugoshine [7]. Ces protéines nommées Sgo 1 et 2 sont les garantes de la cohésion des chromatides sœurs au niveau du centromère. Elles empêchent la ségrégation prématurée des chromosomes et ont la propriété de reconnaître les domaines coiled-coiled phosphorylés. Watanabe et al suggèrent que la phosphorylation de l’histone H2A permet le recrutement des protéines Sgo qui attirent à leur tour la protéine boréaline phosphorylée par cdk1(cdc2)-cycline B. In fine, cela permet le recrutement du complexe passager (Figure 1) [6–8].  | Figure 1
Schématisation des marques épigénétiques centromériques. A. Visualisation de la présence de la protéine survivine sur le centromère interne. B. Schématisation de l’interface centromère-kinétochore sur un chromosome mitotique et visualisation de la répartition des histones H3 (vert clair) et CENP-A (vert foncé). C. Agencement de l’enchaînement des nucléosomes centromériques en mitose [ 2]. D. Cascade d’événements sur la chromatine centromérique. La phosphorylation de l’histone H3 en Thr 3 par l’haspine induit le recrutement de la protéine survivine tandis que les phosphorylations concomitantes de boréaline par cdk1-cycline B et de shugoshine (Sgo) par Bub1 assurent l’ancrage du complexe passager sur le centromère interne. D’autres kinases facilitent l’interaction entre les différents partenaires au sein du complexe passager (Msp-1, Plk1, etc.) [ 3]. La kinase Aurora B activée par survivine et INCENP phosphoryle ses substrats : CENP-A, histone H3, MCAK, Op18, Mis13, etc. |
En résumé le complexe passager aura une grande affinité avec la région chromatinienne doublement phosphorylée au niveau des histones H3-Thr 3 et H2A-Ser 210. La seule région de concomitance de ces deux marques épigénétiques est la zone interne du centromère. Ces deux phosphorylations apportées respectivement par haspine et Bub1 sont donc responsables du recrutement spécifique du complexe passager sur le centromère interne. Il est intéressant de noter que ces signalisations sont extrêmement conservées de la levure à la grenouille et jusqu’à l’homme. La seule différence notable est l’existence d’une protéine boréaline (Nbl-1) plus courte chez Schizosaccharomyces pombe, toutefois compensée par la présence d’un deuxième domaine BIR dans l’homologue survivine (Bir1). Dans cet organisme, la protéine survivine joue un rôle encore plus capital que chez les eucaryotes supérieurs. |
Ces expériences ont permis de faire avancer notre compréhension du recrutement du complexe passager et tout particulièrement de sa sous-unité catalytique sur le centromère interne. Toutefois des questions restent ouvertes : les nucléosomes CENP-A qui s’organisent sur la face externe du centromère sont-ils phosphorylés par Bub1 ? Les marques histone H3-Thr3-P et H2A-Ser 210-P reconnues sont-elles portées par le même nucléosome ou par deux nucléosomes adjacents ? Dans cette dernière hypothèse CENP-A pourrait jouer le rôle de barrière de confinement. De même, on peut s’interroger sur le rôle de la phosphorylation de CENP-A par Aurora B. Nous avons montré que l’inhibition de la kinase Aurora B induisait la décondensation des chromosomes et la fuite du complexe passager de la chromatine [9]. On peut imaginer que cet effet soit indépendant de l’activité d’Aurora B et soit la conséquence de la déphosphorylation de l’histone H3-Thr3 après un délai d’attente en mitose. Il sera important d’étudier la durée de résidence de ces marques épigénétiques primaires. Récemment a été décrit un facteur de remodelage de la chromatine capable de reconnaître simultanément deux modifications sur une molécule histone [
10]. Il est probable que cette double activité augmente la fiabilité du signal et soit un langage assez universel. En l’occurrence au niveau des centromères, cette concomitance de marques épigénétiques permet de relier deux signalisations indépendantes mais synchrones : la cohésion des chromatides et la bipolarisation des chromosomes. Ces nouveaux résultats consolident la place prépondérante de la survivine au sein du complexe passager [1]. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Delacour-Larose
M
,
Hoang
TM
,
Molla
A
. Survivine, la petite reine du complexe passager : chek-up pour son dixième anniversaire . Med Sci (Paris).
2008; ; 10 : :828.-832. 2.
Allshire
RC
,
Karpen
GH.
. Epigenetic regulation of centromeric chromatin: old dogs, new tricks ?
Nat Rev Genet.
2008; ; 9 : :923.-937. 3.
Molla
A.
. Aurora kinases orchestrate mitosis; who are the players ?
BioMolecular Concepts.
2010; ; 1 : :147.-155. 4.
Wang
F
,
Dai
J
,
Daum
JR
, et al.
Histone H3 Thr-3 phosphorylation by Haspin positions Aurora B at centromeres in mitosis . Science.
2010; ; 330 : :231.-235. 5.
Kelly
AE
,
Ghenoiu
C
,
Xue
JZ
, et al.
Survivin reads phosphorylated histone H3 threonine 3 to activate the mitotic kinase Aurora B . Science.
2010; ; 330 : :235.-239. 6.
Kawashima
SA
,
Yamagishi
Y
,
Honda
T
, et al.
Phosphorylation of H2A by Bub1 prevents chromosomal instability through localizing shugoshin . Science.
2010; ; 327 : :172.-177. 7.
Yamagishi
Y
,
Honda
T
,
Tanno
Y
,
Watanabe
Y
. Two histone marks establish the inner centromere and chromosome bi-orientation . Science.
2010; ; 330 : :239.-243. 8.
Tsukahara
T
,
Tanno
Y
,
Watanabe
Y.
. Phosphorylation of the CPC by Cdk1 promotes chromosome bi-orientation . Nature.
2010; ; 467 : :719.-723. 9.
Hoang
TM
,
Favier
B
,
Valette
A
, et al.
Benzo[e] pyridoindoles, novel inhibitors of the aurora kinases . Cell Cycle.
2009; ; 8 : :765.-772. 10.
Morinière
J
,
Rousseaux
S
,
Steuerwald
U
, et al.
Cooperative binding of two acetylation marks on a histone tail by a single bromodomain . Nature.
2009; ; 461 : :664.-668. |