| |
| Med Sci (Paris). 2011 March; 27(3): 246–248. Published online 2011 March 30. doi: 10.1051/medsci/2011273246.Les cinq couleurs de la chromatine de drosophile Guillaume Filion1* 1The Netherlands cancer institute, Gene regulation (B4), Plesmanlaan 121, 1066CX Amsterdam, Pays Bas. MeSH keywords: Animaux, Chromatine, classification, Couleur, Drosophila, génétique, Terminologie comme sujet |
La chromatine et ses dérivés Depuis son apparition en 1882 [
1], le terme « chromatine » a changé de définition à de nombreuses reprises. Ces définitions ont toutes eu pour fonction de mettre un nom sur un objet dont la nature, la structure, les propriétés et les fonctions n’ont jamais été parfaitement comprises. Par exemple, la dichotomie entre euchromatine et hétérochromatine, initialement établie par microscopie électronique, désignait l’hétérochromatine comme la fraction compacte du matériel nucléaire d’une cellule en interphase. La définition actuelle obéit aux exigences de la génomique : l’hétérochromatine est volontiers définie par sa nature répétitive ou l’absence d’expression des gènes qui y sont codés. Ainsi, chacune des deux définitions élude les mécanismes fondamentaux de la propriété sur laquelle elle est basée. Malgré la nature éminemment floue du concept de chromatine, la communauté scientifique ne fait preuve ni de dogmatisme, ni de naïveté quant à son usage. Le terme garde son aspect indéfini avant tout pour des raisons expérimentales. Il est clair depuis plus d’une quinzaine d’années que la dichotomie naïve entre euchromatine et hétérochromatine est le fruit de l’inefficacité des méthodes utilisées pour interroger les propriétés du matériel nucléaire in vivo. Il n’est donc pas surprenant que les termes changent à nouveau de sens avec l’essor des analyses in vivo à l’échelle du génome. Grâce aux technologies récentes, nous avons cartographié les sites de liaison de 53 protéines de la chromatine sur le génome de la drosophile [
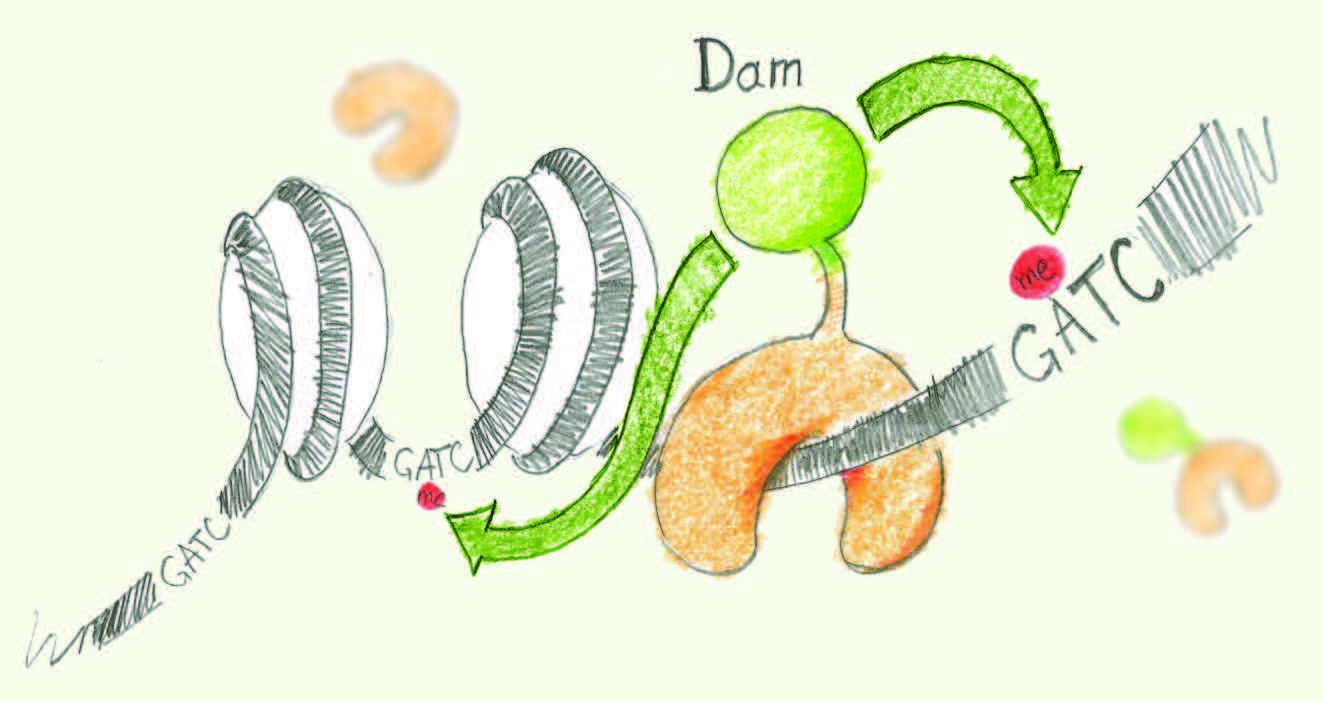
2]. Pour cela nous avons utilisé un modèle uniforme de cellules en culture et une méthode de cartographie in vivo appelée DamID. Le principe de la méthode repose sur l’activité de l’enzyme Dam (DNA adenine methyltransferase). Dam dépose une empreinte sur l’ADN, absente des génomes eucaryotes, qui peut être détectée par des enzymes de restriction. En fusionnant une protéine à Dam, il est possible de restreindre la méthylation de l’ADN aux sites de liaison de cette protéine in vivo, ce qui permet ensuite de les identifier (Figure 1). Donnant des résultats comparables à ceux de la précipitation de la chromatine (ChIP), la technologie DamID jouit d’un avantage : elle peut être appliquée de façon systématique sans recours au développement d’anticorps spécifiques, ce qui permet une augmentation conséquente du débit. Les cartes de liaison à haute résolution de ces 53 protéines nous ont permis de donner le premier aperçu de la chromatine à cette échelle dans une cellule eucaryote.  | Figure 1
Principe de la méthode DamID. Le dessin représente la molécule d’ADN enroulée autour des nucléosomes. L’enzyme Dam (en vert) est exprimée fusionnée à une protéine d’intérêt (en orange) via une séquence chimérique. La protéine d’intérêt attire Dam sur ses séquences cibles in vivo, ce qui confine la méthylation de l’ADN au voisinage de ces séquences. L’ADN lointain des séquences cibles n’est pas méthylé. Note : l’enzyme Dam ne peut méthyler que l’adénine de la séquence GATC. |
|
Hétérogénéité et simplicité de la chromatine de drosophile La première surprise de cette étude est l’hétérogénéité de la chromatine de drosophile. On pourrait s’attendre à une répartition plus ou moins uniforme des évènements de liaison sur la molécule d’ADN. Or, la majeure partie du génome est liée par un petit nombre de protéines très abondantes, telles que l’histone H1, alors qu’une petite fraction du génome est liée par un très grand nombre de protéines différentes. La seconde surprise est la faible complexité de la chromatine. En recensant les protéines présentes à un locus particulier, on peut théoriquement obtenir près de 1016 combinaisons à partir de 53 protéines. La cellule de drosophile est loin d’utiliser toutes les possibilités. Mais combien en utilise-t-elle ? Pour répondre à cette question, nous avons cherché à classifier les sites du génome en fonction des protéines qui y éaient présentes. Chaque site est donc caractérisé par une signature à 53 nombres codant l’identité de ces protéines. Répondre à la question revient à identifier les signatures les plus représentées, ce qui peut être obtenu par une méthode d’analyse appelée analyse en composantes principales (ACP). Les résultats de l’ACP sur ce jeu de données suggèrent que cinq signatures seulement suffisent à résumer les données, au sens où toute signature observée est relativement proche de l’une de ces cinq signatures. En d’autres termes, chaque site du génome appartient à l’un des cinq grands types de chromatine définis par la combinaison de protéines qui les composent. Ce nombre est ridiculement faible par rapport aux 1016 combinaisons théoriques, mais il est substantiellement plus élevé que deux, correspondant à la vision la plus largement répandue, soit à la distinction entre euchromatine et hétérochromatine. |
Les cinq couleurs de la chromatine Que sont ces cinq types de chromatine et à quoi correspondent-ils ? Pour éviter les confusions avec les anciennes définitions et en conformité avec le terme chromatine (dérivé de couleur), nous nous référons à ces types de chromatine par une couleur : vert, bleu, noir, jaune et rouge. Deux de ces types, vert et bleu, correspondent à des entités étudiées et définies précédemment : la chromatine HP1 et la chromatine Polycomb respectivement, toutes deux souvent qualifiées d’hétérochromatine. Ces deux types sont aussi définis par les modifications post-traductionnelles des histones H3K9me2/3 et H3K27me3 respectivement (méthylation des lysines 9 et 27 de l’histone H3). Les trois autres types, quant à eux, révèlent des aspects surprenants du génome. Le plus énigmatique est sans doute le type noir. La moitié du génome appartient au type noir, composé de seulement six protéines. Les gènes de ces régions sont inactifs, les événements de liaison entre protéines et ADN y sont rares et aucune modification post-traductionnelle des histones n’y semble présente. L’essentiel des gènes inactifs se trouvant dans la chromatine noire, il est encore plus étrange de constater que les répresseurs de transcription ne semblent pas s’y lier. La chromatine noire serait-elle localement si compacte que les protéines ne pourraient pas interagir avec l’ADN ? Bien que séduisante, cette hypothèse est peu vraisemblable. La protéine à doigt de zinc Su(Hw) (suppressor of hairy-wing) se lie spécifiquement à son site consensus dans les régions noires, ce qui montre que l’ADN est accessible, au moins à certaine protéines. Comment cette protéine peut-elle se lier à son site consensus alors que les autres n’en semblent pas capables ? C’est sans doute derrière cette énigme que se cache la compréhension des réels mécanismes de la répression transcriptionnelle. Les types jaune et rouge, quant à eux, recouvrent les gènes exprimés. Cette dichotomie des régions exprimées a elle aussi de quoi surprendre. Le type jaune est caractérisé par la présence de la protéine MRG15 et la modification des histones H3K36me3 (triméthylation de la lysine 36 de l’histone H3). Le type rouge est caractérisé par une dizaine de protéines, la plus spécifique étant Brahma. Dans ce type, les événements de liaison sont extrêmement fréquents et ne semblent dépendre que faiblement de la spécificité de liaison entre protéines et séquences consensus. Jusqu’à 70 % des protéines cartographiées peuvent se lier aux loci de la chromatine rouge, ce qui représenterait plusieurs milliers de protéines différentes si l’on extrapole à l’ensemble des protéines du noyau. En comparaison, ces sites occupés par un grand nombre de protéines différentes sont beaucoup plus rares au sein de la chromatine jaune. S’il existe deux signatures chromatiniennes associées à la transcription, ou autrement dit deux voies de transcription, quelle en est la conséquence ? Un examen attentif des données montre que quelques centaines de gènes centromériques, qui lient HP1, sont fortement exprimés. Or, tous lient MRG15, le marqueur de la chromatine jaune. Ceci suggère que la voie de transcription associée à la signature jaune peut avoir lieu dans l’hétérochromatine classique (définie par HP1), mais pas la voie de transcription associée à la signature rouge. Cette simple observation jette un regard nouveau sur la variégation1 par effet de position et permet d’expliquer pourquoi certains gènes sont sensibles aux effets de position alors que d’autres ne le sont pas [
3]. |
Cinq types de chromatine, est-ce là le nombre exact ? Tout dépend de la définition. En premier lieu, les cinq types de chromatine ont été identifiés par leur abondance et la redondance des protéines qui les composent, et non par leur pertinence fonctionnelle. Il est envisageable que certaines signatures chromatiniennes rares soient associées à des fonctions biologiques. Si, par exemple, l’épissage d’une poignée de gènes est régulé par un processus spécifique de ces gènes, la rareté de la signature chromatinienne associée la rendrait indétectable par les critères statistiques. Il serait pourtant pertinent de donner le statut de « type de chromatine » à cette signature en raison de son importance fonctionnelle. Par ailleurs, les cinq types de chromatine ont été identifiés au sein d’un type cellulaire bien défini. À l’heure actuelle, rien ne permet de savoir si d’autres types de chromatine existent dans d’autres tissus ou d’autres cellules, notamment à un stade de différenciation plus avancé. La majorité des gènes silencieux dans la lignée cellulaire embryonnaire utilisée sont actifs dans différents organes de la larve ou de l’adulte. Relèvent-ils alors de la chromatine jaune, rouge, ou définissent-ils une nouvelle signature chromatinienne ? Quant à l’influence du choix des 53 protéines utilisées pour la définition des cinq types de chromatine, elle est étonnamment faible. Un choix de 50 protéines différentes, pour la plupart de fonction inconnue, aboutit à une classification en quatre types de chromatine (données personnelles non publiées). L’absence remarquable du type Polycomb est due au fait qu’aucune protéine de cette famille n’est incluse dans le panel choisi pour cette nouvelle sélection. En revanche, les types définis précédemment y sont parfaitement identifiables, et aucun autre n’est mis en évidence par cette approche. |
Il n’y a aucune raison de penser que le nombre réel de types de chromatine est bel et bien cinq. Mais les modèles sont-ils faits pour être vrais ou pour être utiles ? La vision d’une chromatine à cinq couleurs dégage de nouvelles hypothèses, montre à quel point la chromatine est hétérogène et souligne notre incompréhension des mécanismes aussi fondamentaux que la transcription et l’interaction entre protéines et ADN. Gageons que cette définition de la chromatine ne sera pas la dernière. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Flemming
W.
. Zellsubstanz. , Kern und Zelltheilung. Leipzig: : F.C.W. Vogel; , 1882. 2.
Filion
GJ
,
van Bemmel
JG
,
Braunschweig
U
, et al.
Systematic protein location mapping reveals five principal chromatin types in Drosophila cells . Cell.
2010; ; 143 : :212.-224. 3.
Berghella
L
,
Dimitri
P
. The heterochromatic rolled gene of Drosophila melanogaster is extensively polytenized and transcriptionally active in the salivary gland chromocenter . Genetics.
1996; ; 144 : :117.-125. |