| |
| Med Sci (Paris). 2011 March; 27(3): 285–288. Published online 2011 March 30. doi: 10.1051/medsci/2011273285.Les cellules souches mésenchymateuses Armes ou dangers pour le traitement des cancers ? Gwendal Lazennec1,2* 1Inserm U844, site Saint Éloi, bâtiment INM, 80, rue Augustin Fliche, Montpellier, F-34091, France 2Université de Montpellier I, Montpellier, F-34090, France |
La définition des propriétés des CSM, de leurs capacités de différenciation et de leurs applications thérapeutiques sont traitées dans les autres revues de ce numéro. Nous nous focaliserons donc sur les observations majeures conférant un rôle aux CSM dans la cancérogenèse en traitant de leur tropisme pour les sites tumoraux, de leurs effets sur la croissance tumorale et des mécanismes sous-jacents, et de leur utilisation en thérapie cellulaire antitumorale. |
Tropisme des CSM pour les sites tumoraux Toute une série d’études a décrit la migration des CSM vers les sites tumoraux (pour revue, [
1]). Récemment, plusieurs techniques ont été utilisées pour suivre les CSM : détection de fluorescence, luminescence, ou IRM (imagerie par résonance magnétique). Le suivi par détection de cellules fluorescentes requiert que les CSM expriment des protéines aux propriétés fluorescentes telles que la GFP (green fluorescent protein). Pour la détection de luminescence, le principe consiste à utiliser des CSM transfectées avec le gène codant pour la luciférase. Une fois greffées chez l’animal, ces cellules sont détectées grâce à une caméra CCD (charge-coupled device, ou dispositif à transfert de charge) chez les animaux auxquels on administre le substrat de la luciférase. La réaction induite par la luciférase conduit à une émission de lumière qui peut être détectée par la caméra. Par ces approches de fluorescence et luminescence, plusieurs équipes ont montré que les CSM pouvaient migrer vers des sites contenant des cellules tumorales, que ce soit au niveau cutané, pulmonaire ou osseux [
2]. En ce qui concerne l’IRM, les cellules CSM sont marquées avec des nanoparticules d’oxyde de fer superparamagnétiques, ce qui pemet de les détecter, par exemple dans les métastases pulmonaires [
3]. Comment expliquer le tropisme des CSM vers les sites tumoraux ? En comparant le transcriptome de CSM migrant avec plus ou moins d’efficacité vers des tumeurs comme des gliomes, certaines études ont corrélé l’efficacité de migration des CSM avec le niveau d’expression de la métalloprotéase MMP-1 (matrix metalloproteinase 1) [
4]. Mais les cellules tumorales sont aussi capables de produire des facteurs qui attirent les CSM. C’est le cas notamment de uPA (urokinase plasminogen activator) et de son récepteur uPAR (urokinase plasminogen activator receptor), tous deux fortement exprimés par les cellules tumorales. uPA contribue à la migration des CSM vers ces cellules tumorales [
5]. D’autres travaux suggèrent aussi l’implication des chimiokines et notamment de CCL2 (ou monocyte chimoattractant protein 1 [MCP1]) dans la migration des CSM vers les cellules de cancer du sein [
6]. CXCL1 et CXCL8 (ou interleukine-8) participent au tropisme pour les gliomes des CSM isolées à partir de cordon ombilical, ces deux chimiokines étant produites abondamment par les cellules de gliomes [
7]. La neurotrophine-3 (NT-3) et le TGF-β1 (transforming growth factor 1) sécrétés par les gliomes favoriseraient aussi la migration des CSM vers ces cellules tumorales [
8]. D’autres facteurs de croissance avec des propriétés immunogéniques telles que l’EGF (epidermal growth factor), le HGF (hepatocyte growth factor), le bFGF (basic fibroblast growth factor) et le PDGF (platelet-derived growth factor) contribueraient aussi à la migration des CSM vers les sites tumoraux [
9,
10]. Il faut cependant nuancer ces observations par le fait que ce tropisme n’est pas forcément toujours spécifique de la tumeur elle-même. En effet, l’équipe du docteur F. Marini a notamment montré que les CSM sont en fait capables de migrer de manière plus générale vers les sites d’inflammation consécutifs soit à une blessure soit au développement d’une tumeur [
11]. D’autre part, ces auteurs ont aussi montré que les CSM injectées dans la circulation chez des souris intactes avaient un tropisme naturel pour le poumon, le foie et la rate [11]. Or, une telle comparaison de souris non manipulées à des souris porteuses de tumeurs a rarement été effectuée dans les études antérieures. Ceci pourrait donc remettre en cause une partie des conclusions des études qui utilisent des modèles de métastases pulmonaires. On ne peut pas exclure en effet qu’une fraction non négligeable de CSM pourrait migrer vers le poumon indépendamment de la présence de métastases. Une autre limite dans toutes les études actuelles est que le nombre de CSM marquées injectées chez les animaux est considérable. Or, à ce jour, aucune étude n’a permis de montrer de manière claire la migration de CSM endogènes vers les sites tumoraux. |
Effets négatifs ou positifs des CSM sur la croissance tumorale Si les CSM sont bien capables de migrer vers le site tumoral, on peut se poser la question de leurs effets positifs ou négatifs sur la croissance tumorale ou la formation de métastases (pour une revue plus complète sur ce sujet voir [1]). Nous nous focaliserons dans cette revue uniquement sur les données récentes traitant de cette question complexe. Plusieurs hypothèses pourraient expliquer un rôle inhibiteur, ou au contraire facilitateur, des CSM sur la prolifération des cellules tumorales. D’une part, la source de CSM pourrait être essentielle : certaines sont isolées à partir de la moelle osseuse et d’autres du tissu adipeux. D’autre part, la diversité des cellules cancéreuses, issues de différents organes, utilisées dans ces études est importante, et il n’est sans doute pas possible de généraliser les effets des CSM à tous les types de cellules cancéreuses. Troisième variable, les CSM sont souvent co-injectées avec les cellules tumorales et la quantité respective des deux types cellulaires varie d’une étude à l’autre. Enfin, les sites d’injection varient aussi : injections sous-cutanées, intraveineuses ou directement dans les organes d’intérêt. Les travaux les plus récents se sont focalisés sur les mécanismes qui contribuent aux effets négatifs ou positifs des CSM sur la croissance tumorale (Tableau I). Parmi les études les plus remarquables, on peut citer celle de l’équipe de H. Weinberg qui a montré que les CSM mises au contact de cellules de cancer du sein produisaient la chimiokine CCL5 (connue aussi sous le nom de RANTES, regulated upon activation, normal T-cell expressed, and secreted), qui était capable d’augmenter de manière spectaculaire la capacité métastatique des cellules tumorales [
12]. L’hypersécrétion de CCL5 par les CSM serait secondaire à la production par les cellules tumorales soit d’IGF-1 (insulin-like growth factor-1) [
13], soit d’un peptide pro-inflammatoire de 37 acides aminés (LL-37) qui induirait non seulement la production de CCL5, mais aussi celle de l’IL-6 (interleukine-6), l’IL-10 et du VEGF (vascular endothelial growth factor) et stimulerait l’angiogenèse et la croissance des tumeurs ovariennes [
14]. Une autre étude a aussi rapporté une augmentation des quantités d’IL-6, de VEGF et de TGF-β sécrétées par les CSM lorsqu’elles sont exposéees à du milieu conditionné par des cellules de cancer de l’ovaire [
15]. Le rôle protumoral de la sécrétion d’IL-6 par les CSM est à nouveau mis en lumière dans le cas du cancer du sein [
16]. CCL2, une autre chimiokine, est aussi produite par les CSM et peut favoriser l’invasion des cellules de cancer du sein [
17]. La prolifération tumorale peut aussi résulter des effets immunosuppresseurs des CSM comme l’a montré notre laboratoire en mettant en évidence que les CSM permettaient à des cellules de mélanome B16 de former des tumeurs dans un contexte allogénique [
18]. Le mécanisme fait intervenir une réduction de la prolifération des lymphocytes T CD8+ [18].
Tableau I
| Gènes cibles des CSM |
|
Facteurs sécrétés par les cellules tumorales* |
| CCL5 |
|
IGF-I |
| CCL5 |
|
LL-37 |
| CXCL12 |
|
? |
| Dkk-1 |
|
? |
| IL-6 |
|
LL-37 |
| IL-10 |
|
LL-37 |
| MMP-1 |
|
? |
| VEGF |
|
LL-37 |
| TGF-β |
|
? |
|
|
uPA/uPAR |
|
|
CXCL1, CXCL8, CCL2, NT-3 |
|
|
TGF-1, EGF, FGF, HGF, bFGF, PDGF |
Liste des protéines synthétisées par les CSM et impliquées dans les interactions entre les cellules cancéreuses et les CSM ainsi que dans le tropisme des CSM vers les cellules cancéreuses. *Lorsqu’ils sont connus, les facteurs produits par les cellules cancéreuses qui régulent l’expression des gènes cibles des CSM (colonne de gauche) sont indiqués dans la colonne de droite. |
Les mécanismes à l’origine de l’inhibition de croissance des cellules tumorales par les CSM qui est parfois observée ont été moins étudiés. Dans une étude, le médiateur était l’inhibiteur de la voie Wnt Dkk-1 (Dickkopf-1), sécrété par les CSM, et qui réduit la prolifération de la lignée cellulaire K562 d’origine hématopoïétique (Figure 1) [
19].  | Figure 1
Mécanisme à l’origine de l’inhibition de croissance des cellules tumorales par les CSM.
|
Enfin, les cellules tumorales elles-mêmes peuvent se modifier en réponse à leur contact avec les CSM. Ainsi, les cellules de cancer du sein cultivées sur une monocouche de CSM modifient leur phénotype via un processus de transition épithélio-mésenchymateuse (EMT) caractérisé par une augmentation de l’expression des gènes codant pour la N-cadhérine, la vimentine et Snail, et une diminution de l’expression du gène codant la E-cadhérine [
20]. |
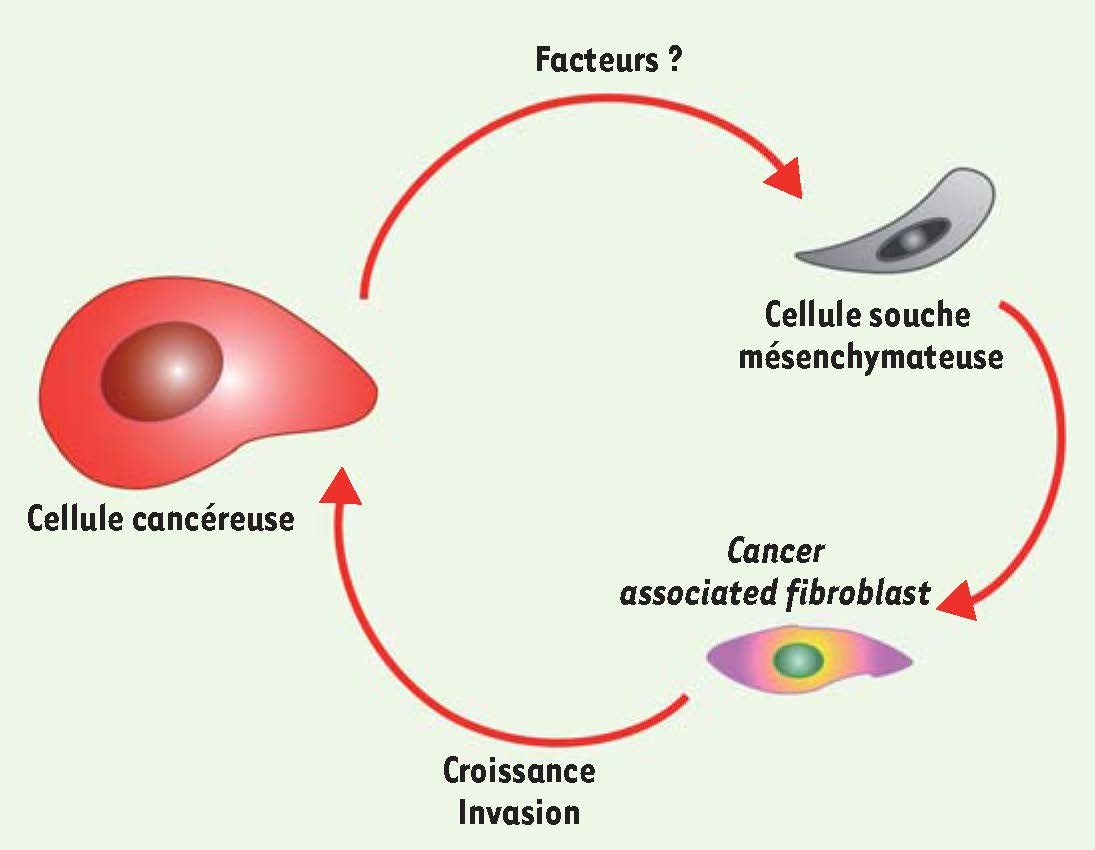
Un dialogue complexe entre CSM et cellules cancéreuses Une des avancées les plus récentes dans la compréhension des interactions entre CSM et cellules tumorales a été la mise en évidence de la capacité des CSM à acquérir un phénotype de CAF (cancer associated fibroblast) proche de celui des fibroblastes présents au sein des tumeurs. Les CAF ont pour propriétés la capacité à stimuler la prolifération des cellules tumorales et l’angiogenèse, ils produisent des quantités importantes de la chimiokine CXCL12 (aussi connue sous le nom de SDF-1, stromal-derived factor 1) et ont également des caractéristiques de myofibroblastes, avec notamment une expression forte de la α-smooth actine (α-SMA) et de la fibroblast surface protein (FSP) [
21]. Des travaux récents ont montré que l’exposition pendant 30 jours de CSM à du milieu conditionné de cellules tumorales augmente la capacité de migration des CSM et induit l’expression de ces deux protéines α-SMA et FSP [
22]. Ces CSM exposées aux cellules tumorales produisent des quantités plus importantes de la chimiokine CXCL12 et stimulent la croissance in vivo de cellules de cancer du sein [22]. Des résultats similaires ont été retrouvés par une autre équipe qui a, de plus, montré que l’IL-6 sécrétée par les CSM exposées aux cellules tumorales était responsable de leur stimulation de la croissance tumorale [15]. |
Les CSM : véhicules pour une thérapie cellulaire antitumorale Le tropisme des CSM pour les sites tumoraux a suscité beaucoup d’intérêt, car ces cellules pouvaient intervenir comme véhicules cellulaires de gènes suicides, de molécules stimulant la réponse immunitaire ou de virus oncolytiques. Parmi les gènes suicides les plus utilisés, on trouve notamment le gène de la thymidine kinase (TK) du virus de l’herpes simplex. Ce gène code pour une enzyme qui permet la conversion du ganciclovir (GCV), qui est normalement non toxique pour les cellules, en un métabolite phosphorylé ayant des propriétés antitumorales. L’administration de CSM que l’on force à exprimer la thymidine kinase permet de réduire fortement la croissance de tumeurs de la prostate [
23]. Un autre système de prodrogue, cette fois fondé sur l’utilisation de la cytosine désaminase (CD), a été utilisé pour traiter des souris qui présentaient une tumeur du côlon [
24]. Dans ces études, les auteurs ont fait exprimer à des CSM la CD, ont injecté ces cellules aux animaux qu’ils ont ensuite traités avec du 5’fluoro-uracile (5-FU). La CD permet la conversion du 5FU en 5-fluorocytosine (5-FC), métabolite doué de propriétés antitumorales. Dans le même ordre d’idée, une autre stratégie a consisté à faire appel non pas à des prodrogues, mais directement à des gènes codant des protéines aux propriétés antitumorales. C’est le cas du tumor necrosis factor-related apoptosis-inducing ligand (TRAIL), connu pour sa capacité à déclencher l’apoptose. Les CSM exprimant TRAIL induisent l’apoptose des cellules tumorales et inhibent la croissance de cellules de cancer du sein ou du col de l’utérus injectées à des souris [
25]. Si le contrôle de l’apoptose constitue un déterminant important dans la croissance tumorale, l’angiogenèse en constitue une autre étape-clé. En se fondant sur cette observation, nous avons construit un modèle expérimental dans lequel des CSM expriment un inhibiteur de l’angiogenèse (le fragment amino-terminal antagoniste de l’urokinase-type plasminogen [uPA]), ce qui a eu pour effet d’inhiber la croissance de métastases osseuses de cellules de cancer de prostate [
26]. Les CSM ont également été utilisées pour apporter au site de la tumeur des molécules stimulant la réponse immunitaire telles que l’interleukine-12 (IL-12) [
27] ou l’interféron gamma (IFN-γ) [
28]. Enfin, les CSM ont aussi été utilisées comme vecteurs de virus oncolytiques au site tumoral, une stratégie particulièrement efficace dans le cas du cancer de l’ovaire [
29] (voir aussi [
33]) |
Si l’utilisation de CSM pour des applications de thérapie cellulaire anticancéreuse semble prometteuse, il n’en reste pas moins que la majorité des études montrent que les CSM non modifiées sont capables de favoriser la croissance tumorale et le développement de métastases. De plus, on ne peut exclure que des altérations géniques de CSM puissent favoriser le développement de certains cancers comme cela a été suggéré pour les cellules stromales composant la niche hématopoïétique dans le cas de certaines leucémies [
30–
32]. Ce champ d’investigation très actif aujourd’hui permettra d’envisager les potentialités et les écueils de l’utilisation des CSM dans le traitement des cancers, mais aussi le rôle des CSM endogènes dans le développement tumoral. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Lazennec
G
,
Jorgensen
C
. Concise review: adult multipotent stromal cells and cancer: risk or benefit? . Stem Cells.
2008; ; 26 : :1387.-1394. 2.
Wang
H
,
Cao
F
,
De
A
, et al.
Trafficking mesenchymal stem cell engraftment and differentiation in tumor-bearing mice by bioluminescence imaging . Stem Cells.
2009; ; 27 : :1548.-1558. 3.
Loebinger
MR
,
Kyrtatos
PG
,
Turmaine
M
, et al.
Magnetic resonance imaging of mesenchymal stem cells homing to pulmonary metastases using biocompatible magnetic nanoparticles . Cancer Res.
2009; ; 69 : :8862.-8867. 4.
Ho
IA
,
Chan
KY
,
Ng
WH
, et al.
Matrix metalloproteinase 1 is necessary for the migration of human bone marrow-derived mesenchymal stem cells toward human glioma . Stem Cells.
2009; ; 27 : :1366.-1375. 5.
Gutova
M
,
Najbauer
J
,
Frank
RT
, et al.
Urokinase plasminogen activator and urokinase plasminogen activator receptor mediate human stem cell tropism to malignant solid tumors . Stem Cells.
2008; ; 26 : :1406.-1413. 6.
Dwyer
RM
,
Potter-Beirne
SM
,
Harrington
KA
, et al.
Monocyte chemotactic protein-1 secreted by primary breast tumors stimulates migration of mesenchymal stem cells . Clin Cancer Res.
2007; ; 13 : :5020.-5027. 7.
Kim
DS
,
Kim
JH
,
Lee
JK
, et al.
Overexpression of CXC chemokine receptors is required for the superior glioma-tracking property of umbilical cord blood-derived mesenchymal stem cells . Stem Cells Dev.
2009; ; 18 : :511.-519. 8.
Birnbaum
T
,
Roider
J
,
Schankin
CJ
, et al.
Malignant gliomas actively recruit bone marrow stromal cells by secreting angiogenic cytokines . Neurooncol.
2007; ; 83 : :241.-247. 9.
Feng
B
,
Chen
L.
. Review of mesenchymal stem cells and tumors: executioner or coconspirator? . Cancer Biother Radiopharm.
2009; ; 24 : :717.-721. 10.
Spaeth
E
,
Klopp
A
,
Dembinski
J
, et al.
Inflammation and tumor microenvironments: defining the migratory itinerary of mesenchymal stem cells . Gene Ther.
2008; ; 15 : :730.-738. 11.
Kidd
S
,
Spaeth
E
,
Dembinski
JL
, et al.
Direct evidence of mesenchymal stem cell tropism for tumor and wounding microenvironments using in vivo bioluminescent imaging . Stem Cells.
2009; ; 27 : :2614.-2623. 12.
Karnoub
AE
,
Dash
AB
,
Vo
AP
, et al.
Mesenchymal stem cells within tumour stroma promote breast cancer metastasis . Nature.
2007; ; 449 : :557.-563. 13.
Makinoshima
H
,
Dezawa
M.
. Pancreatic cancer cells activate CCL5 expression in mesenchymal stromal cells through the insulin-like growth factor-I pathway . FEBS Lett.
2009; ; 583 : :3697.-3703. 14.
Coffelt
SB
,
Marini
FC
,
Watson
K
, et al.
The pro-inflammatory peptide LL-37 promotes ovarian tumor progression through recruitment of multipotent mesenchymal stromal cells . Proc Natl Acad Sci USA.
2009; ; 106 : :3806.-3811. 15.
Spaeth
EL
,
Dembinski
JL
,
Sasser
AK
, et al.
Mesenchymal stem cell transition to tumor-associated fibroblasts contributes to fibrovascular network expansion and tumor progression . PLoS One.
2009; ; 4 : :e4992.. 16.
Sasser
AK
,
Sullivan
NJ
,
Studebaker
AW
, et al.
Interleukin-6 is a potent growth factor for ER-alpha-positive human breast cancer . Faseb J.
2007; ; 21 : :3763.-3770. 17.
Molloy
AP
,
Martin
FT
,
Dwyer
RM
, et al.
Mesenchymal stem cell secretion of chemokines during differentiation into osteoblasts, and their potential role in mediating interactions with breast cancer cells . Int J Cancer.
2009; ; 124 : :326.-332. 18.
Djouad
F
,
Plence
P
,
Bony
C
, et al.
Immunosuppressive effect of mesenchymal stem cells favors tumor growth in allogeneic animals . Blood.
2003; ; 102 : :3837.-3844. 19.
Zhu
Y
,
Sun
Z
,
Han
Q
, et al.
Human mesenchymal stem cells inhibit cancer cell proliferation by secreting DKK-1 . Leukemia.
2009; ; 23 : :925.-933. 20.
Martin
FT
,
Dwyer
RM
,
Kelly
J
, et al.
Potential role of mesenchymal stem cells (CSMs) in the breast tumour microenvironment: stimulation of epithelial to mesenchymal transition (EMT) . Breast Cancer Res Treat.
2010; ; 124 : :317.-326. 21.
Orimo
A
,
Gupta
PB
,
Sgroi
DC
, et al.
Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion . Cell.
2005; ; 121 : :335.-348. 22.
Mishra
PJ
,
Mishra
PJ
,
Humeniuk
R
, et al.
Carcinoma-associated fibroblast-like differentiation of human mesenchymal stem cells . Cancer Res.
2008; ; 68 : :4331.-4339. 23.
Vilalta
M
,
Degano
IR
,
Bago
J
, et al.
Human adipose tissue-derived mesenchymal stromal cells as vehicles for tumor bystander effect: a model based on bioluminescence imaging . Gene Ther.
2009; ; 16 : :547.-557. 24.
Kucerova
L
,
Altanerova
V
,
Matuskova
M
, et al.
Adipose tissue-derived human mesenchymal stem cells mediated prodrug cancer gene therapy . Cancer Res.
2007; ; 67 : :6304.-6313. 25.
Loebinger
MR
,
Eddaoudi
A
,
Davies
D
,
Janes
SM
. Mesenchymal stem cell delivery of TRAIL can eliminate metastatic cancer . Cancer Res.
2009; ; 69 : :4134.-4142. 26.
Fritz
V
,
Noel
D
,
Bouquet
C
, et al.
Antitumoral activity and osteogenic potential of hATF-expressing mesenchymal stem cells in a murine model of osteolytic tumor . Stem Cells.
2008; ; 26 : :2981.-2990. 27.
Chen
XC
,
Wang
R
,
Zhao
X
, et al.
Prophylaxis against carcinogenesis in three kinds of unestablished tumor models via IL12-gene-engineered CSMs . Carcinogenesis.
2006; ; 27 : :2434.-2441. 28.
Li
X
,
Lu
Y
,
Huang
W
, et al.
In vitro effect of adenovirus-mediated human Gamma Interferon gene transfer into human mesenchymal stem cells for chronic myelogenous leukemia . Hematol Oncol.
2006; ; 24 : :151.-158. 29.
Komarova
S
,
Kawakami
Y
,
Stoff-Khalili
MA
, et al.
Mesenchymal progenitor cells as cellular vehicles for delivery of oncolytic adenoviruses . Mol Cancer Ther.
2006; ; 5 : :755.-766. 30.
Walkley
CR
,
Olsen
GH
,
Dworkin
S
, et al.
A microenvironment-induced myeloproliferative syndrome caused by retinoic acid receptor gamma deficiency . Cell.
2007; ; 129 : :1097.-1110. 31.
Raaijmakers
MH
,
Mukherjee
S
,
Guo
S
, et al.
Bone progenitor dysfunction induces myelodysplasia and secondary leukaemia . Nature.
2010; ; 464 : :852.-857. 32.
Menendez
P
,
Catalina
P
,
Rodriguez
R
, et al.
Bone marrow mesenchymal stem cells from infants with MLL-AF4+ acute leukemia harbor and express the MLL-AF4 fusion gene . Exp Med.
2009; ; 206 : :3131.-3141. 33.
Roger
M
,
Clavreul
A
,
Menei
P
. Cellules stromales mésenchymateuses : vecteurs cellulaires de nanoparticules au sein de tumeurs cérébrales . Med Sci (Paris).
2011; ; 27 : :234.-236. |