| |
| Med Sci (Paris). 2011 March; 27(3): 328–330. Published online 2011 March 30. doi: 10.1051/medsci/2011273328.Un modèle murin de sclérose tubéreuse de Bourneville pour comprendre le processus d’épilepsie associé aux tubers corticaux David Feliciano1 and Angélique Bordey1* 1Departments of Neurosurgery and cellular and molecular physiology, Yale University School of Medicine, New Haven, CT 06520-8082, États-Unis MeSH keywords: Animaux, Modèles animaux de maladie humaine, Souris, Sclérose tubéreuse du cerveau, génétique, Protéines suppresseurs de tumeurs |
La sclérose tubéreuse de Bourneville (TS) est une maladie génétique autosomique dominante touchant les gènes dits suppresseurs de tumeurs Tsc1 (codant pour l’hamartine) et Tsc2 (codant pour la tubérine). Ces mutations entraînent des lésions dans de nombreux organes dont le cerveau, la peau et les reins. Les symptômes neurologiques (crises d’épilepsie, retard mental et troubles du spectre autistique) sont des causes importantes de morbidité. En particulier, plus de 80 % des patients atteints de TS souffrent de crises d’épilepsie qui débutent peu après la naissance et sont difficiles à contrôler [
1]. Chez ces patients, l’épilepsie résulte de la présence de lésions corticales appelées tubers corticaux, souvent associées à des nodules (ou hétérotopies car de localisation aberrante) sous-corticaux [1]. Ces lésions, qui se forment au cours de la vie intra-utérine, ont des ressemblances avec d’autres malformations du développement cortical (dysplasie corticale focale par exemple), ce qui suggère un mécanisme commun d’épileptogenèse [
2]. Ainsi, malgré son incidence faible (environ 1/6 000 naissances), la sclérose tubéreuse de Bourneville doit être considérée comme une maladie modèle pour comprendre la genèse des mécanismes conduisant à l’épilepsie dans les malformations du développement cortical. Toutefois, en l’absence d’un modèle animal adéquat, la formation des tubers corticaux et leur influence sur le processus épileptique restent inexplorées. Pour combler cette lacune, nous avons développé une nouvelle stratégie pour générer des tubers corticaux dans un modèle murin et reproduire le mosaïcisme génétique et les caractéristiques de la maladie observées chez l’homme. Nos résultats soulèvent également la question du rôle de la gliose astrocytaire dans la survenue de l’épilepsie chez ces patients. |
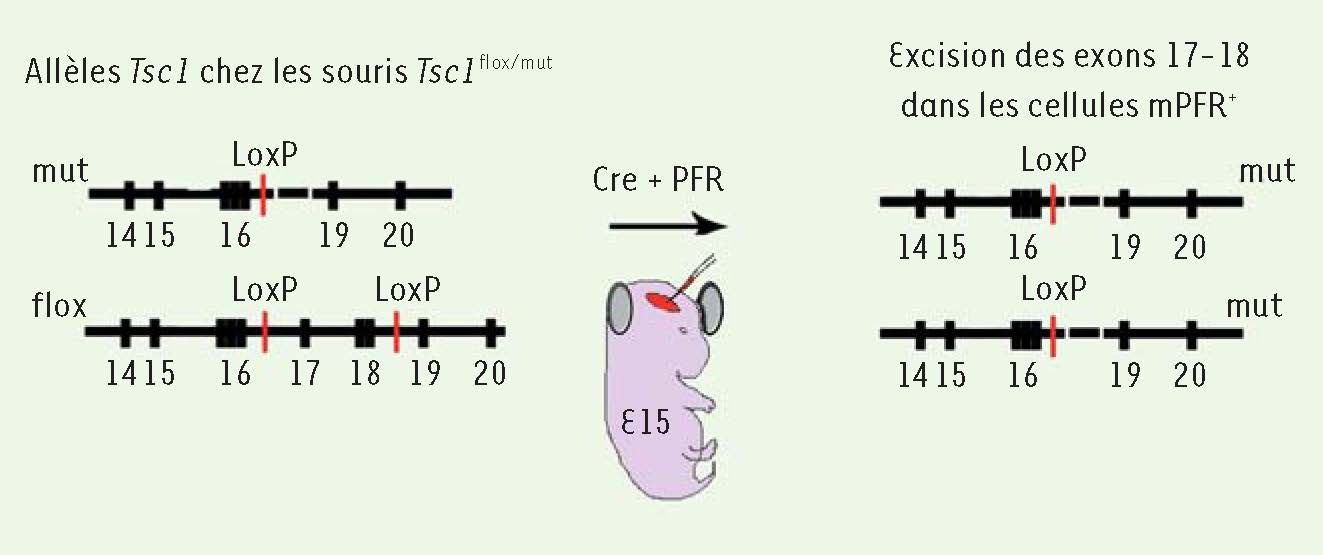
Induction focale de tubers intracérébraux dans un modèle murin Stratégie expérimentale mimant un processus en deux étapes (two-hit) Les patients atteints de TS sont tous porteurs de mutations germinales dans l’un des allèles des gènes Tsc1 ou Tsc2 [
3]. Rappelons que l’hamartine, produit du gène Tsc1, régule négativement mTOR ( mammalian target of rapamycin) qui, à son tour, contrôle la phosphorylation de S6, un élement-clé de la synthèse protéique. L’absence de Tsc1 est donc associée à une hyperactivité de mTOR. Des données récentes suggèrent que la formation des tubers résulte d’une inactivation biallélique de Tsc1 ou Tsc2 qui serait la conséquence de mutations somatiques survenant au cours de la corticogenèse [
4,
5], réalisant un modèle à deux coups ( two-hit model). Des souris transgéniques existent chez lesquelles l’un des allèles Tsc1 ou Tsc2 est muté (mut) et le second allèle flanqué par des séquences loxP (noté flox) [
6–
9]. Lorsque ces souris sont croisées avec des souris exprimant la recombinase Cre (Cre) sous le contrôle de différents promoteurs, l’expression de Cre entraîne l’excision du gène entre les deux sites loxP et donc son élimination (Figure 1). Chez ces souris Tsc1
flox/mut x Cre, certaines des caractéristiques des lésions (cellules larges, gliose) typiques de TS sont effectivement présentes, mais manquent l’aspect focal des lésions et leur association à des nodules hétérotopiques. Or, cette localisation sous forme de foci de cellules anormales ayant une hyperactivité de mTOR dans un cerveau par ailleurs d’apparence normale est en effet caractéristique des tubers observés chez les patients TS.  | Figure 1
Représentation des exons/introns des allèles mutant et floxé (flox) avant et après électroporation du plasmide qui code pour la Cre et la PFR. L’expression de la Cre entraîne l’excision des exons 17-18 dans l’allèle floxé, créant une délétion homozygote de Tsc1 dans les cellules PFR+. |
Pour recréer cette distribution restreinte des tubers chez la souris, nous avons cherché à éliminer le gène Tsc1 spécifiquement dans un groupe de cellules à un moment précis du développement cortical. Pour ce faire, nous avons utilisé la technique d’électroporation in utero (EIU) d’un vecteur codant pour la Cre dans des embryons de souris Tsc1
flox/mut (l’action de la Cre aboutit à une délétion homozygote de Tsc1, Tsc1
null
) et dans des embryons de souris contrôles Tsc1
fl/wt
(l’action de la Cre crée une haplo-insuffisance de Tsc1). L’électroporation permet d’exprimer la Cre spécifiquement dans certaines cellules progénitrices corticales qui se différencient ensuite d’une part en neurones pyramidaux - dans les couches corticales spécifiques -, d’autre part en astrocytes. La co-électroporation d’un vecteur codant pour une protéine fluorescente rouge (PFR) permet la visualisation directe du site d’électroporation et des neurones génétiquement modifiés (Figure 2). Nous avons aussi croisé ces souris Tsc1
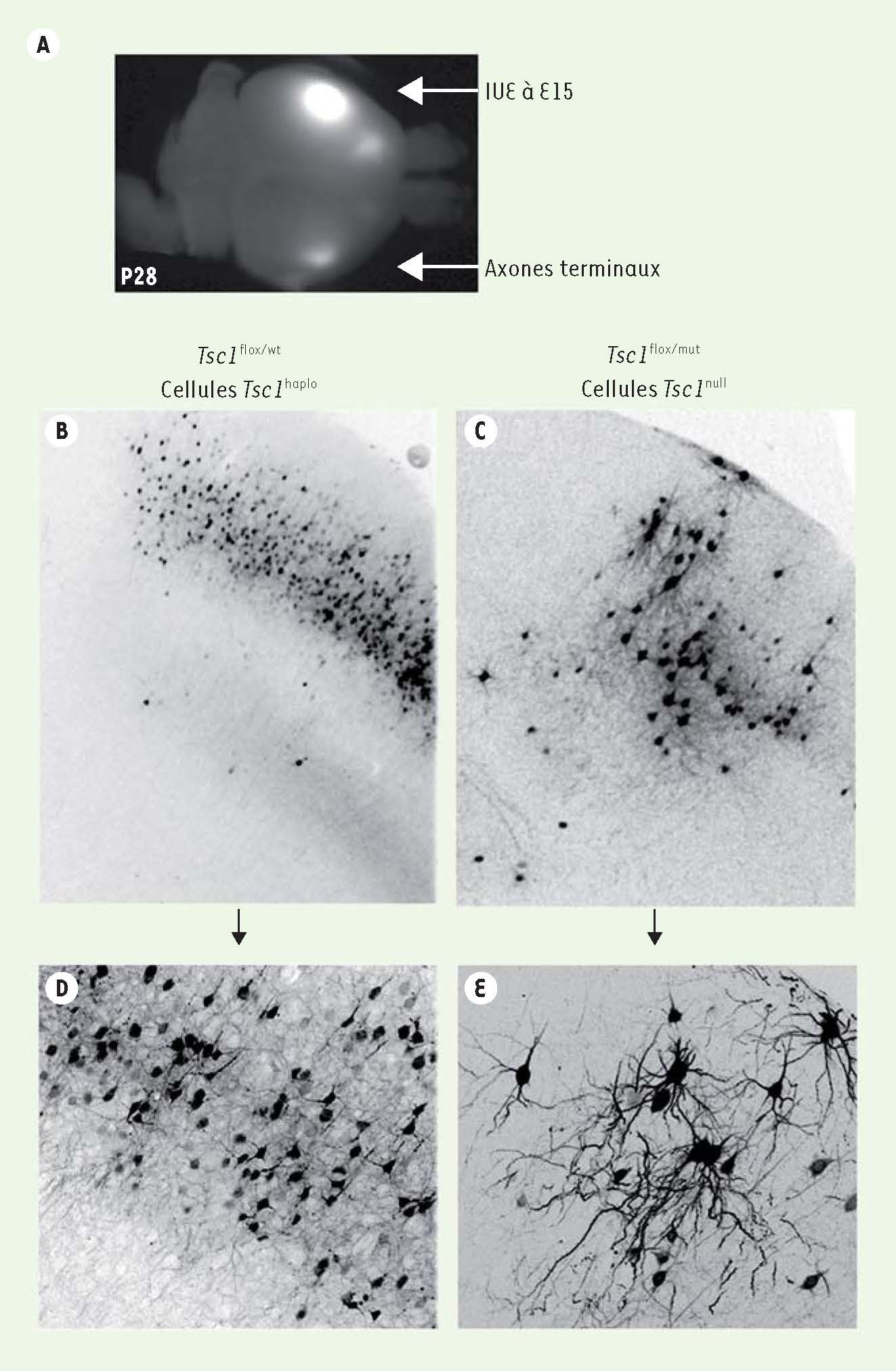
flox/mut avec des souris porteuses d’une séquence Stop floxée bloquant l’expression d’un gène codant pour une protéine fluorescente verte (PFV) chez lesquelles la Cre induit l’excision de cette séquence stop et l’expression de PFV. Chez ces souris, l’expression de la PFV est permanente dans les neurones et les astrocytes, alors que la PFR (exprimée à partir du plasmide électroporé) est diluée au fur et à mesure des divisions cellulaires successives des cellules progénitrices, et ne s’exprime donc plus dans les cellules gliales (astrocytes) produites tardivement par ces progéniteurs. Nous avons donc obtenu une inactivation biallélique de Tsc1 dans les neurones PFR+ et les astrocytes PFV+ dans des régions corticales ciblées (cortex somatosensoriel ou entorhinal et piriforme).  | Figure 2
Co-électroporation d’un vecteur codant pour une protéine fluorescente rouge et visualisation directe du site d’électroporation et des neurones génétiquement modifiés. A. Photographie d’un cerveau d’une souris de 28 jours. Une électroporation a été faite dans l’aire corticale à E15 avec des vecteurs codant pour la PFR et la Cre. B, C. Photographies de neurones PFR+ (de pseudo-couleur noire) dans des coupes coronales de souris Tsc1
flox/wt (souris contrôles, B) et Tsc1
flox/mut
(C) électroporée à E15. D, E. Photographies à une plus forte résolution des neurones montrés en B et C respectivement. IUE : intrauterine electroporation. |
|
Conséquences de la délétion de Tsc1 sur le développement cortical Cette stratégie d’électroporation appliquée à des embryons de 15 jours entraîne une perte d’hétérozygotie dans les cellules électroporées et le développement de malformations corticales focales qui ressemblent à des tubers (Figure 2BC), avec en particulier des défauts de lamination corticale. Ces malformations contiennent des neurones cytomégaliques (ou géants) et multinucléés avec un arbre dendritique anormal (Figure 2 DE). En outre, dans les neurones Tsc1
null, mais pas dans les cellules haplo-insuffisantes, la protéine mTOR est hyperactive comme le montre l’augmentation de la phosphorylation de sa protéine cible S6 (pS6) et la taille plus importante des cellules. Ces malformations sont mosaïques en ce qui concerne la taille des cellules et l’expression de pS6. Des nodules se forment aussi dans la substance blanche (hétérotopiques) et ils contiennent des neurones cytomégaliques témoignant d’une localisation aberrante de certains neurones Tsc
null
lors de leur migration. |
Une observation inattendue : l’absence d’astrocytes réactifs Notre modèle ne reproduit pas toutes les caractéristiques des tubers humains qui comprennent les cellules géantes et une gliose et entraînent une épilepsie. Si les souris ont un seuil de déclenchement des crises d’épilepsie inférieur à celui des animaux normaux ou haplo-insuffisants, nous n’avons pas observé de crises d’épilepsie spontanées. Nous ne pouvons toutefois pas exclure la présence de crises infracliniques. Les tubers ne sont d’ailleurs pas tous épileptogènes chez les patients TS [
10]. L’absence de cellules géantes ayant un phénotype mixte neuronal et glial - normalement présentes dans les tubers humains - s’explique peut-être par les différences innées entre les corticogenèses humaine et murine. Plus surprenant, alors qu’un processus d’astrogliose, même s’il est d’intensité variable, est communément observé dans les tubers des patients TS [
11] et qu’on le tient pour responsable du processus épileptogène [10], les astrocytes en périphérie des tubers générés dans notre modèle n’ont pas les caractéristiques d’astrocytes réactifs et ne surexpriment pas pS6. Il faut rappeler que les astrocytes sont PFV+ dans les souris reporter et n’expriment pas PFR en raison de la dilution du plasmide PFR. Mais des astrocytes Tsc1
null doivent être logiquement produits par la différenciation des progéniteurs électroporés à E15. Nous avons effectivement confirmé par microdissection la présence d’astrocytes PFV+ ayant une délétion homozygote de Tsc1, mais ils n’ont aucune des caractéristiques TS : pas de cytomégalie, ni de surexpression de pS6, et absence de phénotype réactif. Il n’est donc pas exclu que ce soient les crises d’épilepsie associées aux tubers qui sont à l’origine de la gliose et non l’inverse. |
Quelles applications de ce modèle Tsc1
null
? Ce modèle de formation de tubers a plusieurs applications. Il va nous permettre de découvrir les mécanismes de formation des tubers et d’identifier de nouvelles cibles pour limiter leur formation. La possibilité de développer des lésions circonscrites à un endroit précis du cortex est importante pour explorer les mécanismes d’hyperexcitabilité corticale et la fonction des astrocytes. Les souris exprimant des étiquettes fluorescentes permettent la visualisation directe des neurones et des astrocytes, l’analyse de leur morphologie, l’imagerie en temps réel de la migration des cellules et les études électrophysiologiques. L’examen des propriétés biophysiques et des connexions synaptiques des neurones Tsc1
null est maintenant possible. Enfin, notre approche et ce modèle permettront d’étudier les interactions des neurones Tsc1
null avec l’environnement péritubéral qui est hyperactif chez les patients TS [
12]. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Crino
PB
,
Nathanson
KL
,
Henske
EP
. The tuberous sclerosis complex . Engl J Med.
2006; ; 355 : :1345.-1356. 2.
Wong
M
. Mechanisms of epileptogenesis in tuberous sclerosis complex and related malformations of cortical development with abnormal glioneuronal proliferation . Epilepsia.
2008; ; 49 : :8.-21. 3.
van Slegtenhorst
M
,
de Hoogt
R
,
Hermans
C
, et al.
Identification of the tuberous sclerosis gene TSC1 on chromosome 9q34 . Science.
1997; ; 277 : :805.-808. 4.
Crino
PB
,
Aronica
E
,
Baltuch
G
,
Nathanson
KL
. Biallelic TSC gene inactivation in tuberous sclerosis complex . Neurology.
2010; ; 74 : :1716.-1723. 5.
Qin
W
,
Chan
JA
,
Vinters
HV
, et al.
Analysis of TSC cortical tubers by deep sequencing of TSC1, TSC2 and KRAS demonstrates that small second-hit mutations in these genes are rare events . Brain Pathol.
2010; ; 20 : :1096.-1105. 6.
Kwiatkowski
DJ
,
Zhang
H
,
Bandura
JL
, et al.
A mouse model of TSC1 reveals sex-dependent lethality from liver hemangiomas, and up-regulation of p70S6 kinase activity in Tsc1 null cells . Hum Mol Genet.
2002; ; 11 : :525.-534. 7.
Meikle
L
,
Talos
DM
,
Onda
H
, et al.
A mouse model of tuberous sclerosis: neuronal loss of Tsc1 causes dysplastic and ectopic neurons, reduced myelination, seizure activity, and limited survival . Neurosci.
2007; ; 27 : :5546.-5558. 8.
Hernandez
O
,
Way
S
,
McKenna
J
III
,
Gambello
MJ
. Generation of a conditional disruption of the Tsc2 gene . Genesis.
2007; ; 45 : :101.-106. 9.
Zeng
LH
,
Rensing
NR
,
Zhang
B
, et al.
Tsc2 gene inactivation causes a more severe epilepsy phenotype than Tsc1 inactivation in a mouse model of tuberous sclerosis complex . Hum Mol Genet.
2010; ; 20 : :445.-454. 10.
Boer
K
,
Troost
D
,
Timmermans
W
, et al.
Cellular localization of metabotropic glutamate receptors in cortical tubers and subependymal giant cell tumors of tuberous sclerosis complex . Neuroscience.
2008; ; 156 : :203.-215. 11.
Sosunov
AA
,
Wu
X
,
Weiner
HL
, et al.
Tuberous sclerosis: a primary pathology of astrocytes?
Epilepsia.
2008; ; 49
(suppl 2) : :53.-62. 12.
Major
P
,
Rakowski
S
,
Simon
MV
, et al.
Are cortical tubers epileptogenic? Evidence from electrocorticography . Epilepsia.
2009; ; 50 : :147.-154. |