| |
| Med Sci (Paris). 2011 May; 27(5): 471–472. Published online 2011 May 25. doi: 10.1051/medsci/2011275008.Pourrait-on traiter le diabète de type 1 en stimulant les lymphocytes T régulateurs ? Yenkel Grinberg-Bleyer,1 Audrey Baeyens,1 Eliane Piaggio,1*† and Benoit L. Salomon1**† 1I3, immunology, immunopathology, immunotherapy, CNRS/UPMC UMR7211, Inserm U959, Hôpital Pitié-Salpêtrière, Paris, 75013France MeSH keywords: Animaux, Auto-immunité, effets des médicaments et des substances chimiques, Diabète de type 1, immunologie, thérapie, Humains, Tolérance immunitaire, Immunothérapie, méthodes, Interleukine-2, pharmacologie, physiologie, usage thérapeutique, Souris, Souris de lignée NOD, Lymphocytes T régulateurs, Facteur de nécrose tumorale alpha |
Les lymphocytes T régulateurs, cellules essentielles à la régulation de l’auto-immunité Les maladies auto-immunes résultent d’une attaque du système immunitaire contre son propre hôte, conséquence d’une rupture de la tolérance au soi. Elles sont souvent associées à des signes cliniques graves altérant la qualité de vie des patients. La prévalence de ces pathologies atteint 5 à 10% de la population dans les pays occidentaux. Les maladies auto-immunes constituent donc un problème de santé publique majeur. Malheureusement, la plupart de ces pathologies ne peuvent être guéries; les traitements disponibles ne sont souvent que palliatifs et doivent être administrés à vie. L’étude de la physiopathologie des maladies auto-immunes et la découverte de nouveaux traitements présentent donc un intérêt indéniable. Les lymphocytes T régulateurs CD4+CD25+ FoxP3+ (Treg), qui représentent 5 à 15% des lymphocytes T CD4+ dans les organes lymphoïdes, sont des acteurs majeurs de la régulation des réponses immunes [
1,
2]. Ils participent au maintien de la tolérance au soi, prévenant ainsi les maladies auto-immunes. En effet, un déficit sévère en Treg dû à la présence de mutations dans Foxp3, gène codant pour un facteur de transcription essentiel au développement et à la fonction des Treg, conduit à un syndrome auto-immun létal chez l’homme et la souris [
3]. De plus, les souris non-obese diabetic (NOD) - modèles de diabète de type 1 - développent, lorsqu’elles sont déficientes en Treg, un diabète accéléré et aggravé [
4]. À l’inverse, l’injection de Treg spécifiques d’antigènes pancréatiques permet de prévenir le diabète et même d’induire une rémission des signes cliniques [
5]. Le rôle protecteur des Treg a été observé dans la plupart des pathologies auto-immunes étudiées. C’est pourquoi, depuis plusieurs années, de nombreuses équipes s’intéressent à l’utilisation des Treg en biothérapies. À ce jour, nous ne savons pas produire de Treg spécifiques d’auto-antigènes d’un tissu cible en conditions de grade clinique, ce qui limite l’intérêt d’une thérapie cellulaire. Une alternative thérapeutique consisterait à administrer des molécules capables de stimuler préférentiellement le compartiment des Treg du patient pour augmenter leur capacité à contrôler une autoréactivité pathogène. Récemment, nous avons montré que l’interleukine-2 (IL-2) et le tumor necrosis factor (TNF) sont capables de stimuler les Treg spécifiquement dans le pancréas enflammé des souris NOD, jouant ainsi un rôle régulateur dans le diabète.
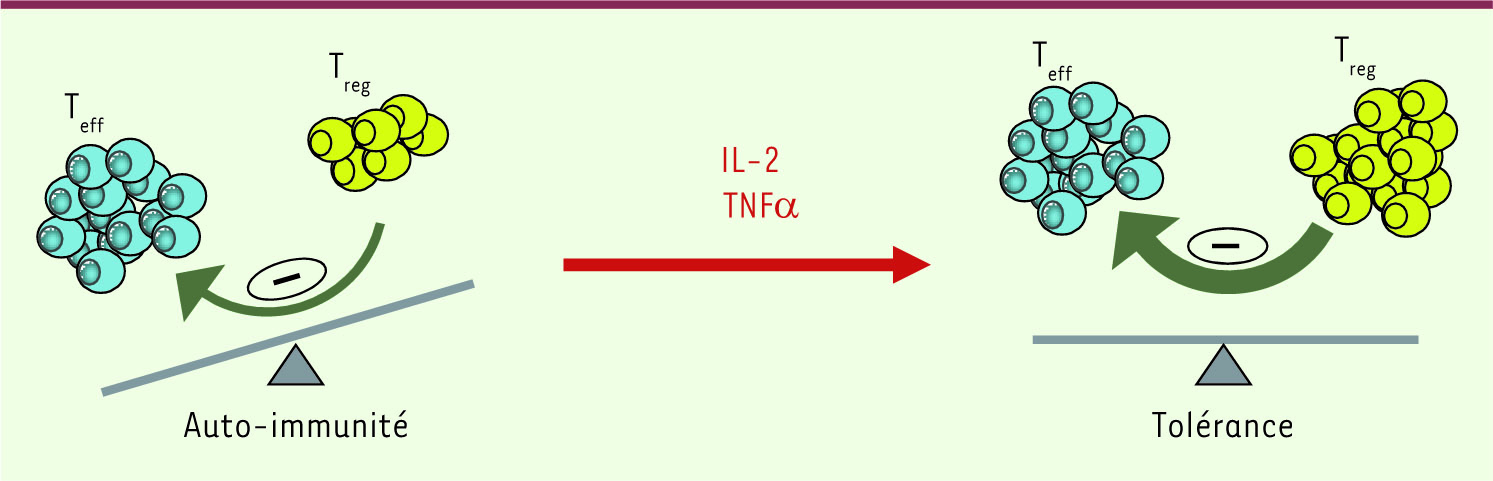
 | Figure 1.
La stimulation des T
reg
par l’IL-2 ou le TNFa rétablit l’équilibre inflammation/tolérance dans le diabète. Lors du développement du diabète de type 1, certains lymphocytes T effecteurs (Teff) autoréactifs s’activent fortement, entraînant une inflammation destructrice dans le pancréas. L’IL-2 et le TNFα pourraient favoriser un rétablissement de l’équilibre entre Teff et Treg et un retour à la tolérance en stimulant préférentiellement les Treg infiltrant le pancréas. |
|
Propriétés régulatrices de l’IL-2 dans le diabète par ses effets sur les Treg L’IL-2 est l’un des facteurs essentiels à la survie et la fonction des Treg. Ainsi, les souris déficientes en IL-2 présentent un fort déficit en Treg et meurent d’un syndrome auto-immun généralisé [
6]. En 2008, nous avons mis en évidence un déficit local en IL-2 dans le pancréas des souris NOD, entraînant une survie diminuée des Treg dans ce tissu, ce qui pourrait précipiter la destruction des cellules β productrices d’insuline [
7]. De façon intéressante, l’injection prolongée de faibles doses d’IL-2 à des souris NOD jeunes entraîne une réduction importante de l’incidence du diabète, associée à une augmentation du nombre et de la survie des Treg infiltrant le pancréas. Nous avons ensuite testé un éventuel effet curatif de l’IL-2 chez des souris NOD nouvellement diabétiques. De façon remarquable, un traitement de seulement 5 jours avec des faibles doses d’IL-2 induit une rémission de l’hyperglycémie chez près de 60% des souris [
8]. Chez la majorité de ces animaux, la glycémie est normalisée à long terme (plus de 10 semaines après le traitement). Toutefois, il est notable que ce traitement ne fonctionne pas si la glycémie des souris est supérieure à 350 mg/dL, mettant en évidence la nécessité, pour espérer avoir une efficacité thérapeutique, d’agir à des temps précoces après le diagnostic, quand la quantité résiduelle de cellules β productrices d’insuline est suffisante pour réguler la glycémie. Nous avons ensuite étudié l’implication des Treg dans ce traitement. D’une part, nous avons observé que l’administration de ces faibles doses d’IL-2 induit une augmentation significative de la proportion de Treg dans le pancréas. Celle-ci est associée à une réduction de l’agressivité des lymphocytes T effecteurs (Teff) diabétogènes qui sécrètent moins d’interféron-γ (IFN-γ), cytokine toxique pour les cellules β productrices d’insuline. D’autre part, cette thérapie par l’IL-2 s’avère inefficace chez des souris NOD génétiquement déficientes en Treg. Ceci montre que l’IL-2 permet une rémission du diabète clinique par un effet local sur les lymphocytes infiltrant le pancréas. Il est important de remarquer que ces faibles doses thérapeutiques d’IL-2 ne semblent pas avoir d’effet systémique. En effet, dans les tissus lymphoïdes, le traitement ne modifie pas la proportion de Treg et n’a que peu d’effet sur la signature ARN des Treg et Teff déterminée par analyse des transcriptomes. Ces résultats et les données chez l’homme suggèrent une relative innocuité de l’administration de faibles doses d’IL-2. Jusqu’à ce jour, l’IL-2 a surtout été utilisée à fortes doses dans certains cancers et maladies infectieuses pour stimuler le système immunitaire, avec des effets thérapeutiques modérés voire discutables. Dans le futur, cette même cytokine pourrait être utilisée à faible dose pour traiter certaines maladies auto-immunes. |
Un mécanisme de rétrocontrôle de l’auto-immunité impliquant le TNFα Les Teff étant les principales cellules productrices d’IL-2, ils pourraient être capables de stimuler les Treg. Nous avons étudié cette question dans un modèle murin de diabète de type 1 par des expériences de transfert adoptif de Treg et Teff spécifiques d’antigènes pancréatiques. De façon remarquable, le cotransfert de Teff diabétogènes entraîne une très forte augmentation de l’expansion des Treg dans les ganglions pancréatiques et le pancréas, d’un facteur 10 à 15 par rapport aux souris qui n’ont reçu que des Treg [
9]. Nous avons ensuite étudié les implications physiopathologiques de ce phénomène dans le diabète. Lorsque les Treg sont transférés seuls, ils ne permettent pas de prévenir l’apparition du diabète induit par l’injection de Teff diabétogènes 3 semaines plus tard. En revanche, si les Treg sont initialement cotransférés avec les Teff, les souris sont protégées à long terme contre l’induction de la maladie. Ainsi, des Teff diabétogènes limitent leur propre effet pathogène en activant les Treg spécifiques d’antigènes d’îlots pancréatiques. De façon inattendue, cet effet stimulant des Teff sur les Treg est indépendant de l’IL-2, et partiellement dépendant du TNFα. En effet, l’augmentation de l’expansion des Treg par les Teff est significativement réduite par des traitements qui neutralisent cette cytokine. Ces résultats pourraient permettre de révéler le mécanisme responsable de la composante immuno-régulatrice du TNFα. En effet, cette cytokine est surtout connue pour ses propriétés pro-inflammatoires et les effets bénéfiques des anti-TNF dans le traitement de certaines maladies auto-immunes comme la polyarthrite rhumatoïde. Cependant, des données chez l’homme et la souris montrent au contraire un rôle protecteur du TNFα dans d’autres maladies auto-immunes, comme la sclérose en plaques [
10,
11]. Nos données suggèrent que cette facette immuno-régulatrice du TNFα pourrait s’expliquer par la capacité de cette cytokine à stimuler les Treg. L’identification de facteurs capables de stimuler de façon préférentielle le compartiment des Treg dans les tissus cibles des maladies auto-immunes peut présenter un intérêt thérapeutique majeur. Nos données suggèrent que l’IL-2 et le TNFα ont un rôle protecteur dans le diabète de type 1 par leur capacité à favoriser l’expansion des Treg dans le pancréas. La rémission du diabète obtenue après administration d’IL-2 chez la souris NOD nous conduit à proposer un essai clinique à visée thérapeutique chez des patients atteints de diabète de type 1 récemment diagnostiqués. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Tang
Q
,
Bluestone
JA
. The Foxp3+ regulatory T cell: a jack of all trades, master of regulation . Nat Immunol.
2008; ; 9 : :239.-244. 2.
Salomon
BL
. Les lymphocytes T régulateurs CD4+CD25+: vers une immuno-modulation thérapeutique ? . Med Sci (Paris).
2002; ; 18 : :1066.-1068. 3.
Wildin
RS
,
Ramsdell
F
,
Peake
J
, et al.
X-linked neonatal diabetes mellitus, enteropathy and endocrinopathy syndrome is the human equivalent of mouse scurfy . Nat Genet.
2001; ; 27 : :18.-20. 4.
Salomon
B
,
Lenschow
DJ
,
Rhree
L
, et al.
B7/CD28 costimulation is essential for the homeostasis of the CD4+CD25+ immunoregulatory T cells that control autoimmune diabetes . Immunity.
2000; ; 12 : :431.-440. 5.
Tang
Q
,
Henriksen
KJ
,
Bi
M
, et al.
In vitro-expanded antigen-specific regulatory T cells suppress autoimmune diabetes . J Exp Med.
2004; ; 199 : :1455.-1465. 6.
Sadlack
B
,
Merz
H
,
Schorle
H
, et al.
Ulcerative colitis-like disease in mice with a disrupted interleukin-2 gene . Cell.
1993; ; 75 : :253.-261. 7.
Tang
Q
,
Adams
JY
,
Penaranda
C
, et al.
Central role of defective interleukin-2 production in the triggering of islet autoimmune destruction . Immunity.
2008; ; 28 : :687.-697. 8.
Grinberg-Bleyer
Y
,
Baeyens
A
,
You
S
, et al.
IL-2 reverses established type 1 diabetes in NOD mice by a local effect on pancreatic regulatory T cells . J Exp Med.
2010; ; 207 : :1871.-1878. 9.
Grinberg-Bleyer
Y
,
Saadoun
D
,
Baeyens
A
, et al.
Pathogenic T cells have a paradoxical protective effect in murine autoimmune diabetes by boosting Tregs
. J Clin Invest.
2010; ; 120 : :4558.-4568. 10.
TNF neutralization in MS : results of a randomized, placebo-controlled multicenter study . The Lenercept multiple sclerosis study group and the University of British Columbia MS/MRI analysis group . Neurology.
1999; ; 53 : :457.-465. 11.
Liu
J
,
Marino
MW
,
Wong
G
, et al.
TNF is a potent anti-inflammatory cytokine in autoimmune-mediated demyelination . Nat Med.
1998; ; 4 : :78.-83. |