| |
| Med Sci (Paris). 2011 May; 27(5): 479–481. Published online 2011 May 25. doi: 10.1051/medsci/2011275011.Voie Hippo-YAP et foie Bien plus qu’un simple contrôle de la taille Hélène Gilgenkrantz1* 1Inserm U1016, CNRS UMR 8104, Université Paris Descartes, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014Paris, France MeSH keywords: Animaux, Animal génétiquement modifié, Protéines de Drosophila, physiologie, Drosophila melanogaster, génétique, croissance et développement, Facteur de croissance des hépatocytes, Homéostasie, Protéines et peptides de signalisation intercellulaire, Protéines et peptides de signalisation intracellulaire, Foie, Tumeurs expérimentales du foie, métabolisme, anatomopathologie, Mammifères, Souris, Modèles biologiques, Protéines nucléaires, Taille d'organe, Phosphorylation, Maturation post-traductionnelle des protéines, Protein-Serine-Threonine Kinases, Protéines proto-oncogènes, Transduction du signal, Spécificité d'espèce, Transactivateurs, Facteurs de transcription |
Les mécanismes cellulaires et moléculaires qui président au contrôle de la taille des organes sont longtemps restés un casse-tête pour les développementalistes. Il y a quelques années, on découvrait chez la drosophile une voie de signalisation, appelée « la cascade Hippo », dont l’invalidation des différents membres entraînait un gigantisme de la mouche, modulant à la fois la prolifération cellulaire et l’apoptose [
1,
12]. Or, les différentes protéines qui composent cette cascade sont hautement conservées chez les mammifères (Figure 1) et certains auteurs ont alors voulu voir dans cette homologie une preuve de l’universalité du contrôle de la taille des organes. Comme toujours, l’histoire est plus complexe et l’année 2010 a catalysé une somme d’informations nouvelles dont l’hépatologie aura souvent été la bénéficiaire indirecte.
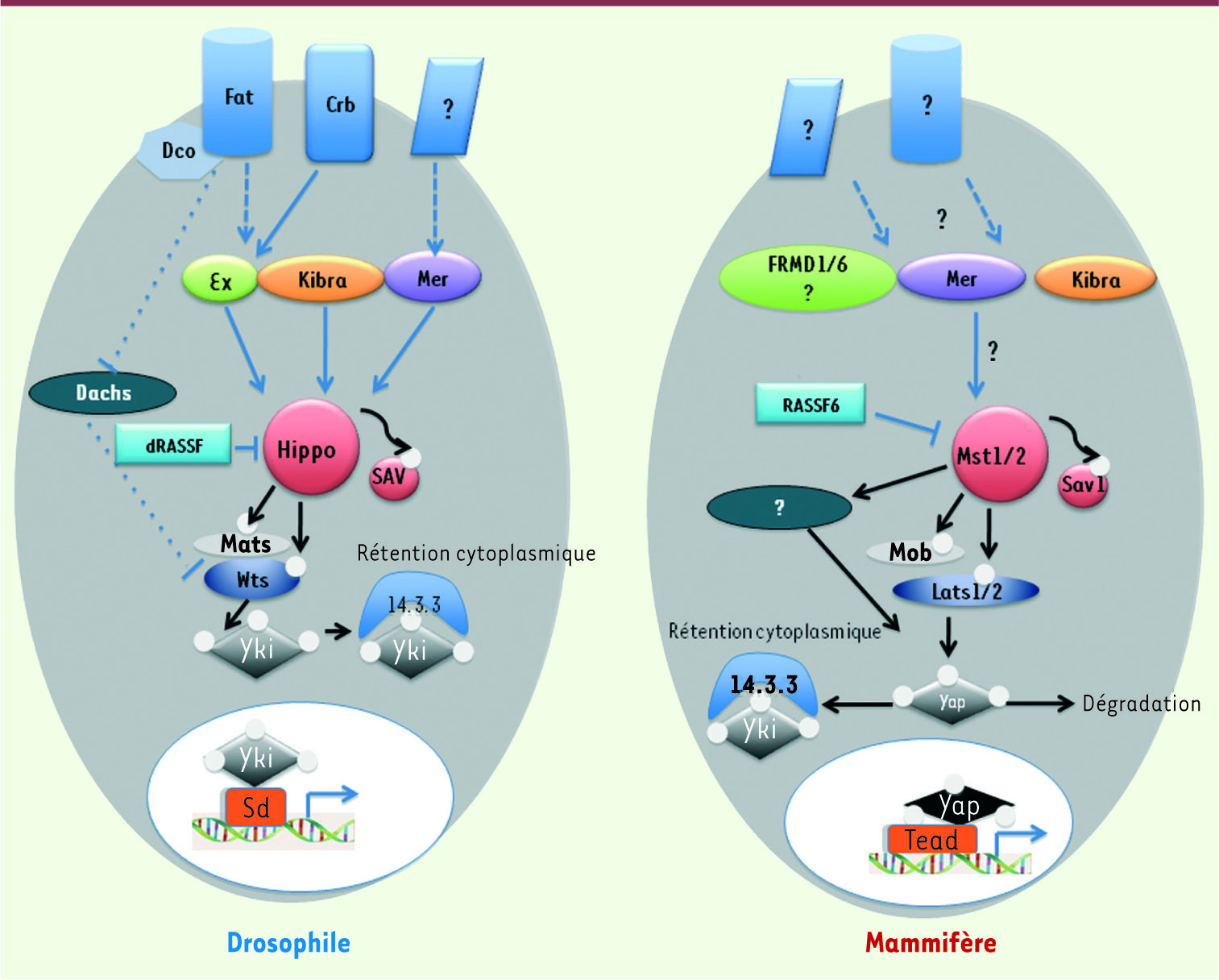
 | Figure 1.
Modèle d’activation de la voie Hippo chez la drosophile et chez les mammifères. Chez la drosophile, Fat, dont l’activité est modulée par sa phosphorylation via Dco, peut activer la voie Hippo par différents chemins : en inhibant la myosine non conventionnelle Dachs qui réprime elle-même Wts ; en activant Ex par un mécanisme encore inconnu. Mer et Ex, potentiellement en interaction avec Kibra, activent Hippo (voir texte). Chez les mammifères, l’homologie avec Fat et Ex n’est pas évidente ; de même, il n’a pas été formellement démontré que Merlin agissait en amont de Mst1/2. La protéine RASSF6 ou dRASSF, membre des protéines effectrices de Ras, bloquerait la voie Hippo. Les relations entre les protéines Hippo, Sav, Wts et Mats sont conservées chez les mammifères (homologues de Mst1/2, Sav1, Lats1/2 et Mob). La phosphorylation de Yki induit sa liaison à la protéine 14-3-3 et sa rétention cytoplasmique. La protéine Yki peut aussi être retenue dans le cytoplasme par une interaction physique avec Ex, Wts et Hippo. Lorsque Yki n’est pas retenue dans le cytoplasme ou dégradée, elle pénètre dans le noyau où elle active la transcription de Scallopped (Sd) pour induire l’expression de nombreux gènes comme la cycline E ou d’autres gènes impliqués dans la prolifération ou l’apoptose. Les protéines TEAD sont des homologues de Sd chez les mammifères (d’après [ 1]). |
|
La cascade Hippo : des mouches et des hommes Chez la drosophile, la kinase Hippo (Mst1/2 chez les mammifères) interagit avec la protéine adaptatrice Salvador ou Sav (WW45 chez les mammifères). Ensemble, elles phosphorylent et activent la kinase Warts (Wts ou Lats1/2 chez les mammifères) et les protéines qui lui sont associées comme Mats. Wts à son tour phosphoryle le co-activateur Yorkie (Yki ou Yap pour yes-associated protein chez les mammifères) qui, une fois phosphorylé, est retenu dans le cytoplasme et/ou dégradé. Lorsque la voie Hippo n’est pas activée, en revanche, Yki migre dans le noyau, lie le facteur de transcription Scalloped (Sd ou ses homologues TEAD chez les mammifères) qui activera alors les gènes de survie et de prolifération cellulaires comme la cycline E, diap1 ou E2F1 [
2]. Ainsi, l’activation de la voie Hippo a-t-elle un effet inhibiteur sur la croissance cellulaire. Quels sont les gènes agissant en amont de cette cascade ? Il existe encore des zones d’ombre dans ce réseau protéique pourtant déjà complexe, notamment chez les mammifères. Chez la drosophile, les protéines Expanded (Ex) et Merlin (Mer) qui appartiennent à la famille des protéines FERM (pour protéine 4.1, Ezrin, Radixin, Moesin) se lient entre elles au niveau du domaine apical des cellules épithéliales. Comme tous les membres de cette famille, avec la protéine Kibra, elles jouent un rôle de pont entre le signal extracellulaire et la cascade de signalisation intracellulaire. Si la mutation de chacune de ces trois protéines donne des phénotypes mineurs, la mutation combinée de Kibra et de l’une des deux autres, ou des deux protéines Mer et Ex, entraîne une hyperplasie globale majeure. Cependant, aucune évidence d’un complexe impliquant Mer, Ex et Kibra en amont de la cascade Hippo n’a réellement été démontrée chez les mammifères. Par ailleurs, quels sont les récepteurs membranaires liant le signal extracellulaire à ces protéines FERM ? La cadhérine Fat, connue pour jouer un rôle dans la polarité cellulaire planaire, a été la première protéine transmembranaire identifiée. Cependant, le phénotype des différents mutants laisse penser que d’autres récepteurs membranaires seraient impliqués et Crumb (Crb) pourrait être un des candidats [
3]. |
Hippo et le contrôle de l’homéostasie hépatique Qu’en est-il chez les mammifères ? Même si les protéines humaines Yap, Lats1/2, Mst1/2 et Mob1 peuvent compenser la mutation de leurs homologues de drosophile, le phénotype des souris knock-out a révélé quelques surprises. Ainsi, l’invalidation concomitante des deux gènes Mst1 et Mst2, correspondant au gène Hippo de drosophile, entraîne un phénotype d’hyperplasie, mais celui-ci est très variable d’un organe à un autre. À ce titre, le foie est particulièrement touché [
4,
5] avec 500 % d’augmentation du poids du foie/poids du corps chez les mutants. A contrario, l’inactivation de Yap induit une perte massive d’hépatocytes et de cholangiocytes [
6]. Ainsi, la cascade Hippo est-elle considérée comme un gardien du contrôle de la taille du foie adulte. On sait encore peu de choses sur les mécanismes impliqués mais une hypothèse intéressante pourrait être qu’Hippo, via l’inactivation de Yap, joue un rôle dans l’inhibition de contact et l’adhésion cellulaires. La cinétique de régénération après hépatectomie des animaux invalidés pour Mst1/2 ou transgéniques pour Yap permettra d’apporter la preuve déterminante que la voie Hippo contrôle bien l’arrêt de la régénération du foie. |
Hippo et carcinome hépatocellulaire Cependant, le rôle de la voie Hippo dans cet organe dépasse probablement cette « simple » fonction. En effet, lorsque l’invalidation a lieu au cours du développement, on observe, chez les animaux, des carcinomes hépatocellulaires (CHC) et des cholangiocarcinomes précédés d’une expansion massive de cellules progénitrices dites cellules ovales. Si l’invalidation a lieu plus tard dans le foie adulte, seuls des CHC se développeront [5,
7]. La voie de signalisation Hippo pourrait donc également contrôler, directement ou non, l’expansion des cellules progénitrices hépatiques. De façon intéressante, l’invalidation du gène Nf2, qui code la protéine Merlin, aboutit également à un élargissement du foie par expansion spécifique de cellules progénitrices, suivi du développement de cholangiocarcinomes, d’hépatocarcinomes ou de tumeurs mixtes [
8]. Cependant, à la différence des gènes Mst1/2 ou Yap dont la fonction touche à la fois les hépatocytes et les cellules ovales, la fonction de Merlin semble restreinte aux cellules progénitrices et ne pas toucher les hépatocytes. Voici donc relancé le débat sur le rôle des cellules progénitrices dans la carcinogenèse hépatique [2]. Comment relier voie Hippo et cancer du foie ? On peut déjà rappeler que plus de la moitié des CHC sont dépourvus des formes constitutivement actives de Mst1/2 et qu’une localisation nucléaire de Yap est retrouvée dans environ la moitié des CHC chez l’homme [5]. Cette surexpression est associée à une moins bonne différenciation tumorale, une plus grande fréquence des récurrences tumorales après résection et est donc considérée comme un marqueur indépendant de mauvais pronostic [
9]. Mst fonctionnerait-il donc comme un gène suppresseur de tumeur dans le foie, maintenant en respect la prolifération des cellules ovales [
10,
11] ? Pourtant, les résultats obtenus avec le mutant Nf2 indiquent plutôt que la protéine Merlin n’est pas un régulateur majeur de Yap dans les cellules progénitrices. Dans ce cas, la surexpression aberrante du récepteur de l’EGF (epidermal growth factor) serait à l’origine de la prolifération anormale de ces cellules. En effet, l’inhibition de l’activation du récepteur de l’EGF (EGFR) par un inhibiteur pharmacologique spécifique bloque la prolifération des cellules progénitrices tant in vitro qu’in vivo [8]. Nf2 pourrait ainsi contrôler l’inhibition de la prolifération en induisant l’internalisation de l’EGFR en réponse aux contacts cellule-cellule. Il existe de nombreuses interconnexions moléculaires connues entre les voies Hippo et EGFR [11]. Chez la drosophile, la perte de Mer et d’Ex entraîne non seulement l’inhibition de la voie Hippo mais aussi l’accumulation d’EGFR. L’amphiréguline, un des ligands du récepteur EGFR, est une cible directe connue de Yap. Enfin, la croissance anormale induite chez la drosophile par l’activation forcée de yki est restreinte par des mutants perte de fonctions d’EGFR. Inversement, des études montrent que l’EGFR pourrait réguler indirectement l’activité de Mst1/2 via l’activation des voies MAPK et PI3K [11]. Cependant, certaines zones d’ombre subsistent. Jusqu’à présent, aucune mutation Nf2 n’a été corrélée au CHC chez l’homme. De même, nous n’avons aucune preuve directe chez la souris que la surexpression d’EGFR dans le foie conduise à une prolifération de cellules progénitrices. Il sera donc essentiel à l’avenir de pouvoir établir une analyse comparative des activités EGFR et YAP au sein des mêmes tumeurs hépatiques. On peut néanmoins déjà conclure que cette voie de signalisation semble essentielle au contrôle de la balance entre processus de régénération et processus tumoral hépatique. Gageons qu’elle sera également la prochaine cible d’inhibiteurs pharmacologiques ! Conflits d’interets
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Zhao
B
,
Li
L
,
Lei
Q
,
Guan
KL
. The hippo-YAP pathway in organ size control and tumorigenesis: an updated version . Genes Dev.
2010; ; 24 : :862.-874. 2.
Pan
D
. The hippo signaling pathway in development and cancer . Dev Cell.
2010; ; 19 : :491.-505. 3.
Grusche
FA
,
Richardson
HE
,
Harvey
KF
. Upstream régulation of the hippo size control pathway . Curr Biol.
2010; ; 20 : :R574.-582. 4.
Song
H
,
Mak
KK
,
Topol
L
, et al.
Mammalian Mst1 and Mst2 kinases play essential rôles in organ size control and tumor suppression . Proc Natl Acad Sci USA.
2010; ; 107 : :1431.-1436. 5.
Zhou
D
,
Conrad
C
,
Xia
F
, et al.
Mst1 and Mst2 maintain hepatocyte quiescence and suppress hepatocellular carcinoma development through inactivation of the Yap1 oncogene . Cancer Cell.
2009; ; 16 : :425.-438. 6.
Zhang
N
,
Bai
H
,
David
KK
, et al.
The Merlin/Nf2 tumor suppressor functions through the YAP oncoprotein to regulate tissue homeostasis in mammals . Dev Cell.
2010; ; 19 : :27.-38. 7.
Lu
L
,
Li
Y
,
Kim
SM
, et al.
Hippo signaling is a potent in vivo growth and tumor suppressor pathway in the mammalian liver . Proc Natl Acad Sci USA.
2010; ; 107 : :1437.-1442. 8.
Benhamouche
S
,
Curto
M
,
Saotome
I
, et al.
Nf2/Merlin controls progenitor homeostasis and tumorigenesis in the liver . Genes Dev.
2010; ; 24 : :1718.-1730. 9.
Xu
MZ
,
Yao
TJ
,
Lee
NP
, et al.
Yes-associated protein is an independent prognostic marker in hepatocellular carcinoma . Cancer.
2009; ; 115 : :4576.-4585. 10.
Lee
KP
,
Lee
JH
,
Kim
TS
, et al.
The Hippo-Salvador pathway restrains hepatic oval cell prolifération, liver size, and liver tumorigenesis . Proc Natl Acad Sci USA.
2010; ; 107 : :8248.-8253. 11.
Yi
C
,
Kissil
JL
. Merlin in organ size control and tumorigenesis: Hippo versus EGFR . Genes Dev.
2010; ; 24 : :1673.-1679. 12.
Bardet
PL
. La voie Hippo contrôle la croissance des organes au cours du développement . Med Sci (Paris).
2009; ; 25 : :253.-257. |