| |
| Med Sci (Paris). 2011 May; 27(5): 481–483. Published online 2011 May 25. doi: 10.1051/medsci/2011275012.Un nouveau type d’horloge circadienne eucaryote François-Yves Bouget1* 1UPMC Université Paris 6, CNRS, UMR7621 LOMIC, Observatoire océanologique, F-66651, Banyuls-sur-mer, France MeSH keywords: Animaux, Protéines bactériennes, physiologie, Horloges circadiennes, Rythme circadien, génétique, Protéines et peptides de signalisation du rythme circadien, Érythrocytes, Cellules eucaryotes, effets des radiations, Humains, Lumière, Microalgues, Modèles biologiques, Oxydoréduction, Synechococcus |
L’horloge circadienne : un processus ubiquiste de mesure du temps Depuis l’aube des temps, les êtres vivants sont exposés aux cycles jour/nuit quotidiens, liés à la rotation de la terre sur elle-même. La plupart des organismes utilisent ces cycles environnementaux pour synchroniser leurs horloges internes qui leur permettent d’ordonner les processus biologiques au cours du cycle jour/nuit comme d’anticiper les changements environnementaux (lumière, température) liés à ce cycle. Ces horloges dites « circadiennes » (de : environ [circa] un jour [dies] en latin) sont des mécanismes précis de mesure du temps qui orchestrent la vie des organismes, des plus petits (cyanobactéries) aux plus grands (champignons, animaux et plantes). C’est, par exemple, le temps de remise à l’heure de cette horloge qui provoque le décalage horaire observé lors de longs voyages en avion. C’est encore la coïncidence entre le temps interne donné par l’horloge à l’organisme et la photopériode (durées relatives du jour et de la nuit qui varient au cours de l’année) qui régule des processus dits annuels, comme la floraison chez les plantes. Chez l’homme, le dérèglement de l’horloge circadienne prédispose à l’apparition de nombreuses maladies comme la dépression saisonnière [
12], les cancers et le diabète [
1,
2]. Au cours des dernières années, notre compréhension des mécanismes de l’horloge s’est considérablement accrue grâce à l’étude d’organismes modèles : mouche et souris chez les animaux, arabette chez les plantes, Neurospora chez les champignons ou encore la cyanobactérie Synechococcus pour les procaryotes. |
Bases génétiques de l’horloge circadienne : l’oscillateur transcriptionnel/traductionnel On a longtemps pensé que l’architecture moléculaire des horloges circadiennes reposait exclusivement sur des circuits de gènes composés d’oscillateurs couplés, dont la nature a été révélée par des approches génétiques. Deux gènes A et B permettent à eux seuls de former un oscillateur circadien transcriptionnel/traductionnel (OTT) simple, où le produit de A (protéine) active la transcription du gène B, la protéine B réprimant en retour la transcription de A (
Figure 1
, gauche). Ainsi des approches couplées de génomique fonctionnelle et de modélisation mathématique chez la microalgue eucaryote Ostreococcus ont montré qu’une boucle de rétrocontrôle négatif composée des deux gènes TOC1 (timing of cab expression 1) et CCA1 (circadian clock associated 1) permet de rendre compte de la plupart des propriétés de l’horloge circadienne et notamment de sa robustesse aux fluctuations lumineuses de l’environnement [
3–
6]. Chez les organismes multicellulaires, la situation est bien plus complexe avec l’existence d’horloges couplées dans différents types d’organes et de cellules. De plus, bien que les mécanismes des OTT soient globalement conservés, les acteurs de cette horloge ne le sont pas entre les grands règnes du vivant.
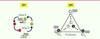 | Figure 1.
Deux types d’oscillateurs circadiens : l’oscillateur transcriptionnel-traductionnel (OTT) et l’oscillateur post-traductionnel (OPT). Dans l’OTT (à gauche), le rythme résulte de l’activation de la transcription du gène B par la protéine A, et de l’inhibition de la transcription du gène A par la protéine B. Dans le seul OPT connu (à droite), décrit chez Synechococcus, 3 protéines A, B et C s’assemblent, se désassemblent et subissent des modifications (phosphorylation de C) selon un rythme d’environ 24 heures, ceci en l’absence d’activité des gènes. |
|
Les oscillateurs biochimiques ou post-traductionnels En plus des circuits de gènes, un oscillateur post-traductionnel (OPT), c’est-à-dire non génétique, a été caractérisé chez les cyanobactéries. Cet oscillateur biochimique peut être reconstitué par les 3 protéines Kai
1 A, B et C qui, dans un tube, présentent des rythmes de 24 heures d’association/dissociation et de phosphorylation [
7] (Figure 1, droite). Deux articles publiés récemment dans la revue Nature rapportent la présence d’oscillateurs non génétiques dans le globule rouge humain, cellule énucléée et donc dépourvue d’OTT [
8], et dans la microalgue Ostreococcus chez laquelle la transcription du génome cesse rapidement après le passage à l’obscurité [
9]. Chez cette microalgue, les rythmes transcriptionnels reprennent lors du passage à la lumière, avec une mémoire du moment du passage à l’obscurité, ce qui indique qu’à l’obscurité une horloge non transcriptionnelle continue de fonctionner. Tant chez l’algue que dans le globule rouge, l’oxydation de la peroxyredoxine, une enzyme-clé dans la détoxification des espèces activées de l’oxygène, est sous le contrôle d’un OPT. De plus, dans le globule rouge, d’autres rythmes circadiens du redox comme celui du NAD(PH) ont été détectés, ce qui pose la question du rôle du redox (et plus généralement du métabolisme qui génère des fluctuations de l’état redox de la cellule) dans l’OPT. |
Les interactions de l’OPT et de l’OTT dans l’horloge Comment les oscillateurs génétiques et biochimiques interagissent-ils pour engendrer des rythmes circadiens robustes en réponse à des cycles environnementaux ? Chez les cyanobactéries, l’OTT serait un oscillateur esclave de l’OPT [
10], néanmoins les rythmes transcriptionnels persistent dans un mutant de phosphorylation de KaiC qui rend l’OPT inopérant [
11]. La nature de l’OPT et les interactions OTT/OPT sont inconnues chez les eucaryotes. Néanmoins, l’analyse de mutants de l’OTT d’Ostreococcus (mutant longue période TOC1 :Luc) et de souris (mutant nul Cry1Cry2) a révélé des anomalies des rythmes d’oxydation de la peroxyredoxine, marqueur de l’activité l’OPT, ce qui suggère des interactions complexes entre ces deux types d’oscillateurs [8, 9]. |
Au tout début de l’ère moderne d’étude des horloges circadiennes, commencée il y a environ soixante ans, les microalgues eucaryotes se sont avéré être des modèles biologiques de choix du fait de leur simplicité, mais elles furent progressivement délaissées par manque d’outils génétiques au profit d’organismes modèles multicellulaires comme la drosophile ou l’arabette, à l’origine de la découverte des OTT. La possibilité de développer des approches génétiques et de découpler les mécanismes transcriptionnels et post-traductionnels dans l’obscurité remet sur le devant de la scène des modèles émergents de microalgues comme Ostreococcus pour étudier le couplage des oscillateurs transcriptionnels et post-traductionnels au cœur du métronome circadien de la cellule et retracer l’évolution et la diversification des horloges circadiennes eucaryotes. Conflit d’intérêts
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Fu
L
,
Lee
CC
. The circadian clock: pacemaker and tumour suppressor . Nat Rev Cancer.
2003; ; 3 : :350.-361. 2.
Bass
J
,
Takahashi
JS
. Circadian integration of metabolism and energetics . Science.
2010; ; 330 : :1349.-1354. 3.
Corellou
F
,
Schwartz
C
,
Motta
JP
, et al.
Clocks in the green lineage: comparative functional analysis of the circadian architecture of the picoeukaryote ostreococcus . Plant Cell.
2009; ; 21 : :3436.-3449. 4.
Thommen
Q
,
Pfeuty
B
,
Morant
PE
, et al.
Robustness of circadian clocks to daylight fluctuations: hints from the picoeucaryote Ostreococcus tauri . PLoS Comput Biol.
2010; ; 6 : :e1000990.. 5.
Troein
C
,
Corellou
F
,
Dixon
LE
, et al.
Multiple light inputs to a simple clock circuit allow complex biological rhythms . Plant J.
2011 ; (sous presse).. 6.
Morant
PE
,
Thommen
Q
,
Pfeuty
B
, et al.
A robust two-gene oscillator at the core of Ostreococcus tauri circadian clock . Chaos.
2010; ; 20 : :045108.. 7.
Nakajima
M
,
Imai
K
,
Ito
H
, et al.
Reconstitution of circadian oscillation of cyanobacterial KaiC phosphorylation in vitro
. Science.
2005; ; 308 : :414.-415. 8.
O’Neill
JS
,
Reddy
AB
. Circadian clocks in human red blood cells . Nature.
2011; ; 469 : :498.-503. 9.
O’Neill
JS
,
van Ooijen
G
,
Dixon
LE
, et al.
Circadian rhythms persist without transcription in a eukaryote . Nature.
2011; ; 469 : :554.-558. 10.
Qin
X
,
Byrne
M
,
Xu
Y
, et al.
Coupling of a core post-translational pacemaker to a slave transcription/translation feedback loop in a circadian system . PLoS Biol.
2010; ; 8 : :e1000394.. 11.
Kitayama
Y
,
Nishiwaki
T
,
Terauchi
K
,
Kondo
T
. Dual KaiC-based oscillations constitute the circadian system of cyanobacteria . Genes Dev.
2008; ; 22 : :1513.-1521. 12.
Gagné
AM
,
Bouchard
G
,
Tremblay
P
, et al.
Quand la saison devient synonyme de dépression . Med Sci Med Sci Paris.
2010; ; 26 : :79.-82. |