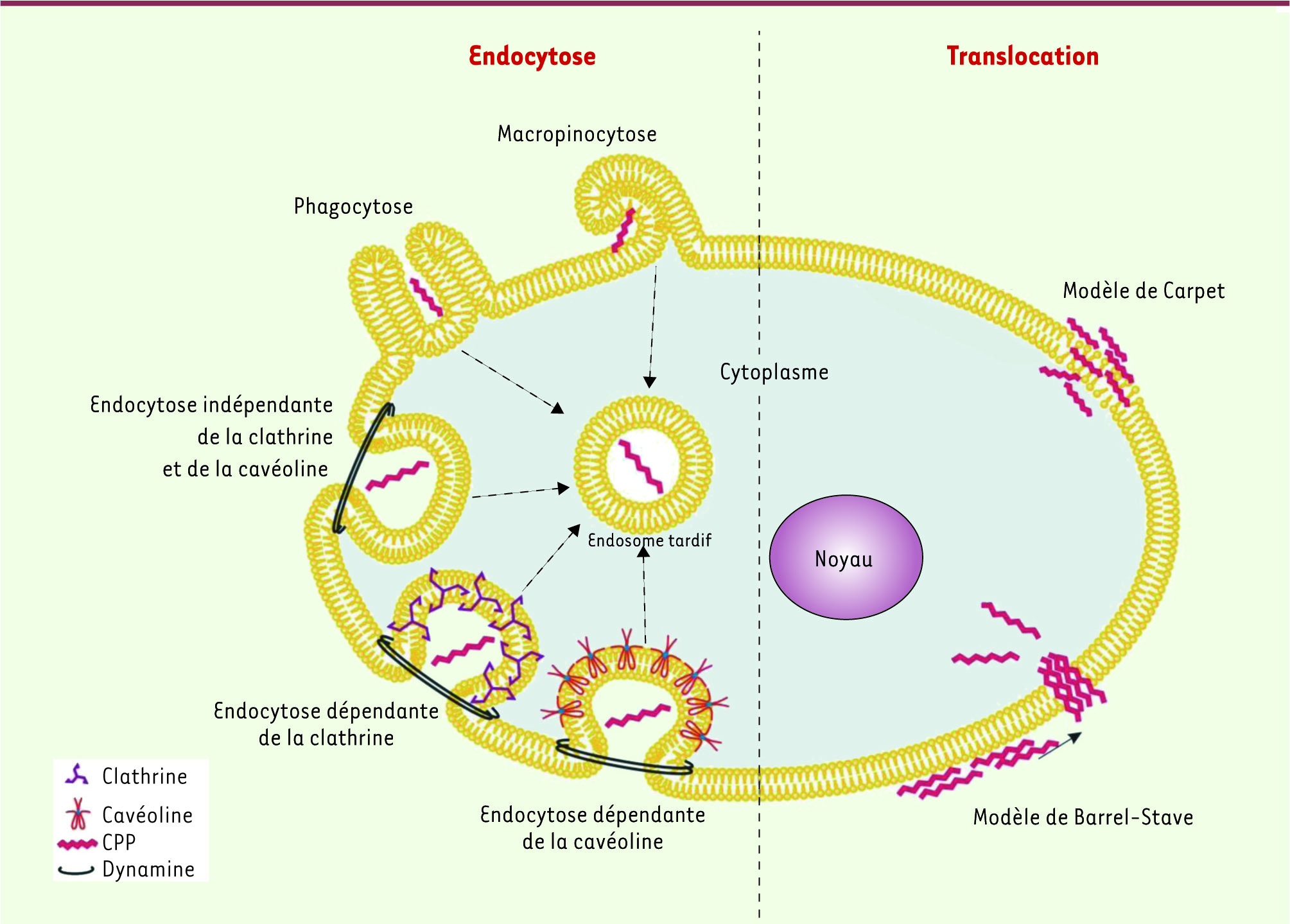
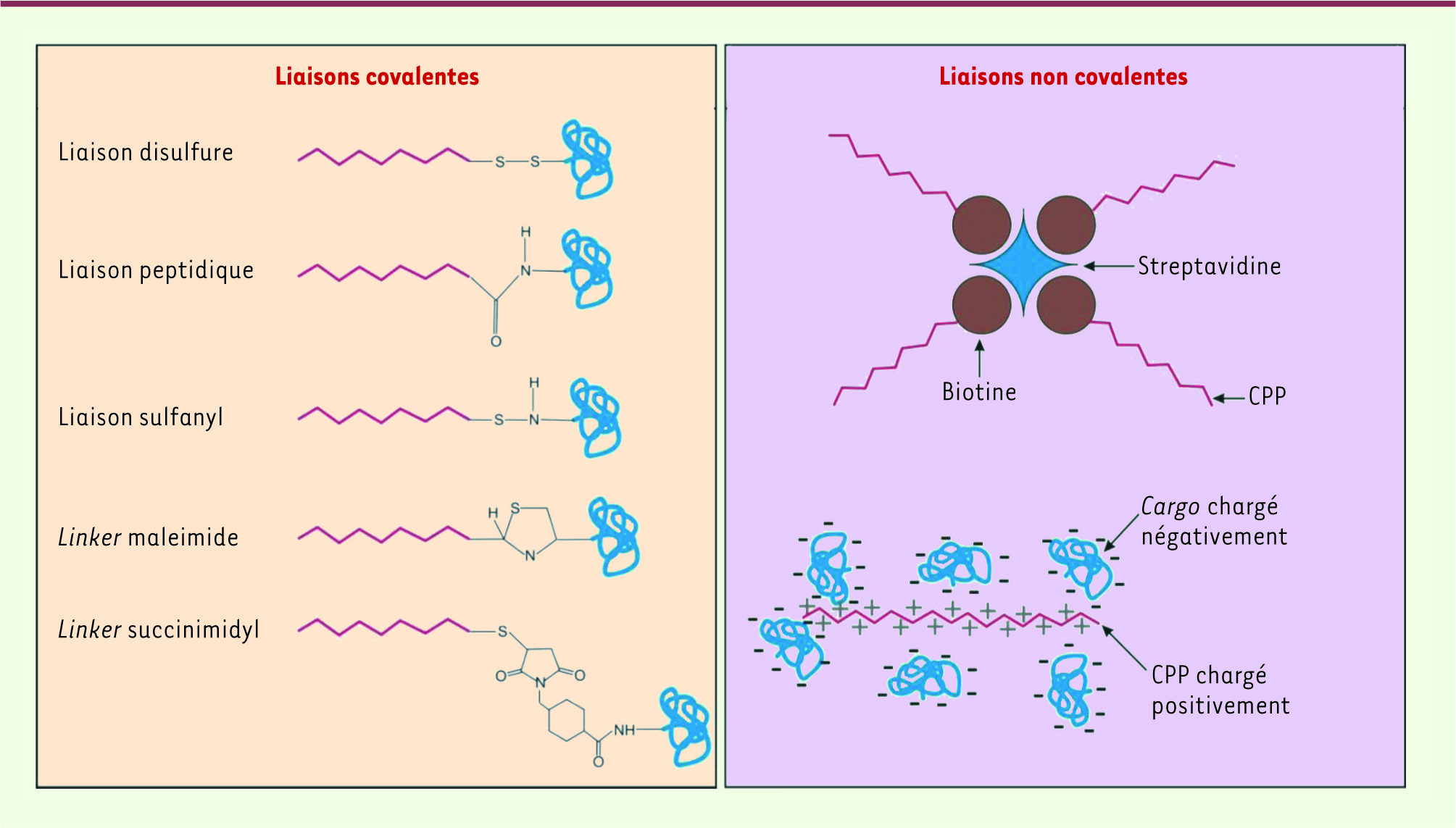
Le principal obstacle à l’administration de molécules actives dans l’organisme vient du blocage qu’oppose la membrane plasmique à l’entrée dans les cellules des molécules hydrophiles. Un accès intracellulaire pour ces composés s’effectue donc au prix de leur administration répétée et massive ou par le biais de stratégies de formulation adéquates. Une méthode permettant de pallier ce problème se développe à vitesse exponentielle. Il s’agit de l’utilisation de peptides de pénétration cellulaire (CPP pour cell penetrating peptide). Ce sont de petits peptides d’une taille variant de 10 à 30 acides aminés, et qui ont une charge nette positive, essentiellement apportée par des résidus lysines et arginines. Ils peuvent être internalisés dans les cellules par un ou plusieurs mécanismes, dont certains ne nécessitent pas d’apport énergétique cellulaire. En règle générale, les CPP n’ont pas de récepteurs cellulaires connus, à l’exception notable de certains d’entre eux issus de protéines fonctionnelles plus larges.
Ce sont Frankel et Pabo qui les premiers en 1988, en étudiant l’activité de la protéine Tat du virus de l’immunodéficience humaine (VIH), se sont aperçus que cette protéine purifiée était capable de pénétrer dans les cellules [ 1]. Par la suite, Joliot et al. ont montré en 1991 que la protéine Drosophila antennapedia homeodomain pénètre dans les cellules neuronales et qu’elle a la capacité de s’accumuler dans les noyaux cellulaires [ 2]. À l’issue de ces travaux, le tout premier CPP à être décrit, la pénétratine, encore appelée Antp, d’une longueur de 16 acides aminés, fut dérivé de la troisième hélice de Drosophila antennapedia homeodomain [ 3]. Cette étude démontrait pour la première fois que les propriétés de pénétration cellulaire d’une protéine sont dues à des séquences minimales au sein de ces protéines également appelées protein transduction domain (PTD). En 1998, Vives et al. [ 4] ont adopté la même approche d’étude pour les domaines tronqués de la protéine Tat et identifié une séquence minimale de la protéine capable d’entrer dans les cellules. Ce peptide a été appelé Tat également en référence à la protéine et ses utilisations ont connu un succès grandissant. Ces deux peptides, pénétratine et Tat, sont devenus les premiers CPP d’une longue liste de peptides capables de se distribuer au sein des cellules. Parmi ces nouveaux peptides, la maurocalcine est un CPP original [ 5] car issu du venin d’un scorpion tunisien Scorpio maurus palmatus. Ce peptide de 33 acides aminés fut identifié grâce à son activité pharmacologique en tant qu’activateur du récepteur à la ryanodine (RyR1) des muscles squelettiques. La cible est particulièrement originale puisqu’il s’agit d’un canal calcique intracellulaire impliqué dans le couplage excitation-contraction [ 6]. Ces observations avaient laissé entrevoir la possibilité que la maurocalcine devait traverser la bicouche lipidique des cellules afin d’exercer sa fonction d’activateur de canal calcique. Cette hypothèse était largement renforcée par le fait que le site d’interaction de la maurocalcine sur RyR1 est localisé dans une zone du cytoplasme [ 7]. La démonstration que la maurocalcine était effectivement un CPP est venue des observations suivantes : (1) l’application extracellulaire du peptide à des myotubes induit une libération calcique quasi instantanée [ 8]; et (2) la greffe d’une protéine streptavidine fluorescente sur la maurocalcine biotinylée permet sa translocation intracellulaire [5]. Par ailleurs, la maurocalcine partage en commun avec les autres CPP la propriété d’être un peptide basique dont de nombreux acides aminés sont chargés positivement (11 sur 33). De plus, la plupart des acides aminés basiques sont localisés sur une même face de la molécule en accord avec la distribution asymétrique observée sur des molécules telles que Tat et pénétratine [ 9].
Le Tableau I recense des exemples de divers peptides de pénétration cellulaire, et la Figure 1 illustre l’origine de quelques-uns d’entre eux. Ces peptides peuvent être a priori séparés en quatre classes distinctes. À la classe des PTD découverts à l’origine (Tat et pénétratine) s’ajoutent donc trois classes supplémentaires : (1) la classe des peptides chimères, comprenant CADY [ 10], MPG [ 11], Pep-1 [ 12] et transportan [ 13]; (2) la classe des peptides modèles, dont les plus connus sont les peptides polyarginine [ 14]; et (3) la classe des CPP naturels comme les toxines de venins dont font partie la maurocalcine et la crotamine [ 15]. Les peptides chimères sont souvent issus d’une protéine plus large (transportan et CADY). Les peptides comme les polyarginines ou MAP (model amphipathic peptide) sont, eux, totalement artificiels et leur conception de novo a été inspirée des propriétés de certains acides aminés (basiques et hydrophobes) nécessaires à la pénétration cellulaire des peptides.
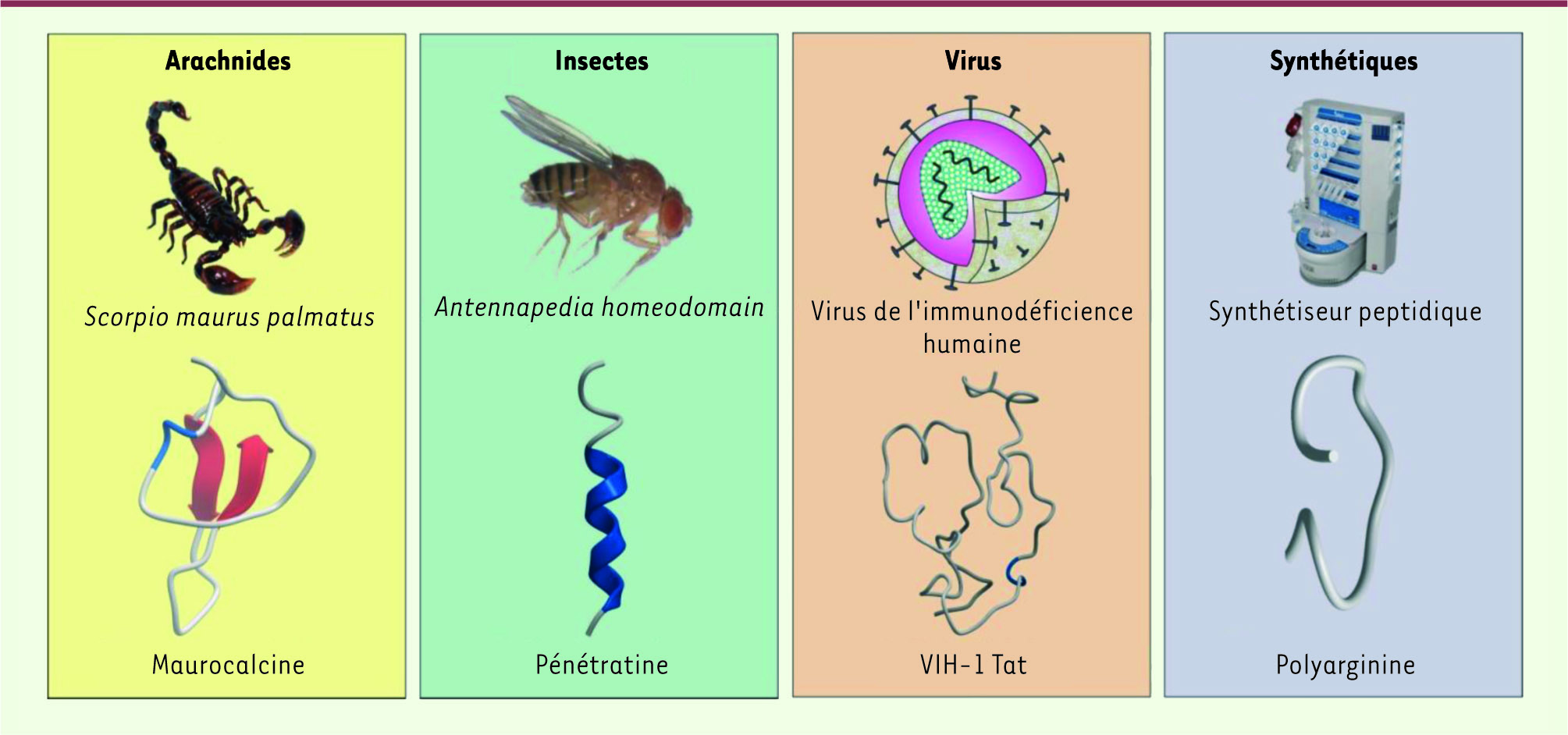
| Figure 1.
Origine de quelques CPP. Exemple de l’origine de quatre CPP : la maurocalcine, la pénétratine, Tat et la polyarginine. La maurocalcine, la pénétratine et Tat sont dérivés de séquences naturelles, alors que la polyarginine a été produite par conception de novo pour avoir une bonne pénétration cellulaire. |
Tableau I
Exemples de quatre classes de peptides de pénétration cellulaires et exemples de cargos transportés. La liste des cargos utilisés n’est pas exhaustive et est simplement donnée à titre d’illustration. x = 7, 8 ou 9 résidus arginine. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||