| |
| Med Sci (Paris). 2011 June; 27(6-7): 633–638. Published online 2011 July 1. doi: 10.1051/medsci/2011276016.Autoanticorps et diagnostic précoce des cancers Caroline Desmetz,1,2,3 Jérôme Lacombe,1,2,3 Alain Mange,1,2,3 Thierry Maudelonde,1,2,3 and Jérôme Solassol1,2,3* 1CHU Montpellier, Laboratoire de biologie cellulaire et hormonale, Hôpital Arnaud de Villeneuve, 371, avenue du Doyen Giraud, Montpellier, F-34295, France 2CRLC Val d’Aurelle, Laboratoire d’oncoprotéomique clinique, 208, rue des Apothicaires, Montpellier, F-34298, France 3Université Montpellier1, Montpellier, France |
Dans cette revue, nous nous intéressons aux propriétés qui font des autoanticorps des biomarqueurs potentiels et décrivons les techniques qui permettent leur identification. Nous insistons ensuite plus particulièrement sur l’intérêt des signatures humorales en pratique clinique et enfin, nous discutons des défis futurs, notamment ceux qui concernent la validation de ces tests. La détection des cancers aux premiers stades de la maladie est un des enjeux majeurs en cancérologie. Elle se justifie notamment par le fait que le risque de récidive locale ou à distance est bien plus faible lorsque le cancer est diagnostiqué précocement que lorsqu’on le décèle à un stade avancé [
1]. Ceci est particulièrement important dans les populations de patients à haut risque de développer un cancer, l’incidence de la maladie y étant significativement plus élevée que dans la population générale. L’imagerie a depuis plusieurs années permis des avancées significatives dans l’aide au diagnostic. Des appareillages de plus en plus sensibles ont été développés, capables désormais de mettre en évidence des tumeurs inframillimétriques. Des efforts importants d’organisation ont aussi été accomplis pour assurer l’accès de la population générale à ces appareillages comme on le voit par exemple avec le dépistage organisé du cancer du sein en France [
30] (→), ou encore avec la mise en place de réseaux nationaux de formation pour les utilisateurs. Malheureusement, le même constat ne peut être fait pour les marqueurs tumoraux sériques. En effet, la majorité d’entre eux ont été identifiés il y a maintenant plusieurs décennies et rares sont ceux dont la détection peut être proposée dans le cadre d’un dépistage ou d’un diagnostic précoce du cancer [
2]. Leur utilisation est actuellement limitée, le plus souvent à l’établissement du bilan initial du cancer (valeur de référence), à l’évaluation de l’efficacité thérapeutique et à la surveillance d’une récidive. (→) Voir l’article de Claire Julian-Reynier, page 657 de ce numéro Une voie de recherche intéressante dans l’identification de nouveaux marqueurs sériques des formes précoces de cancers semble être l’étude de la réponse humorale. Ainsi, au cours de ces dernières années, un très grand nombre d’articles de recherche ont apporté la preuve de l’existence d’autoanticorps circulants dans le sérum de patients atteints de cancers [
3]. Cette inflation littéraire s’explique notamment par l’importance des avancées technologiques réalisées ces dix dernières années. |
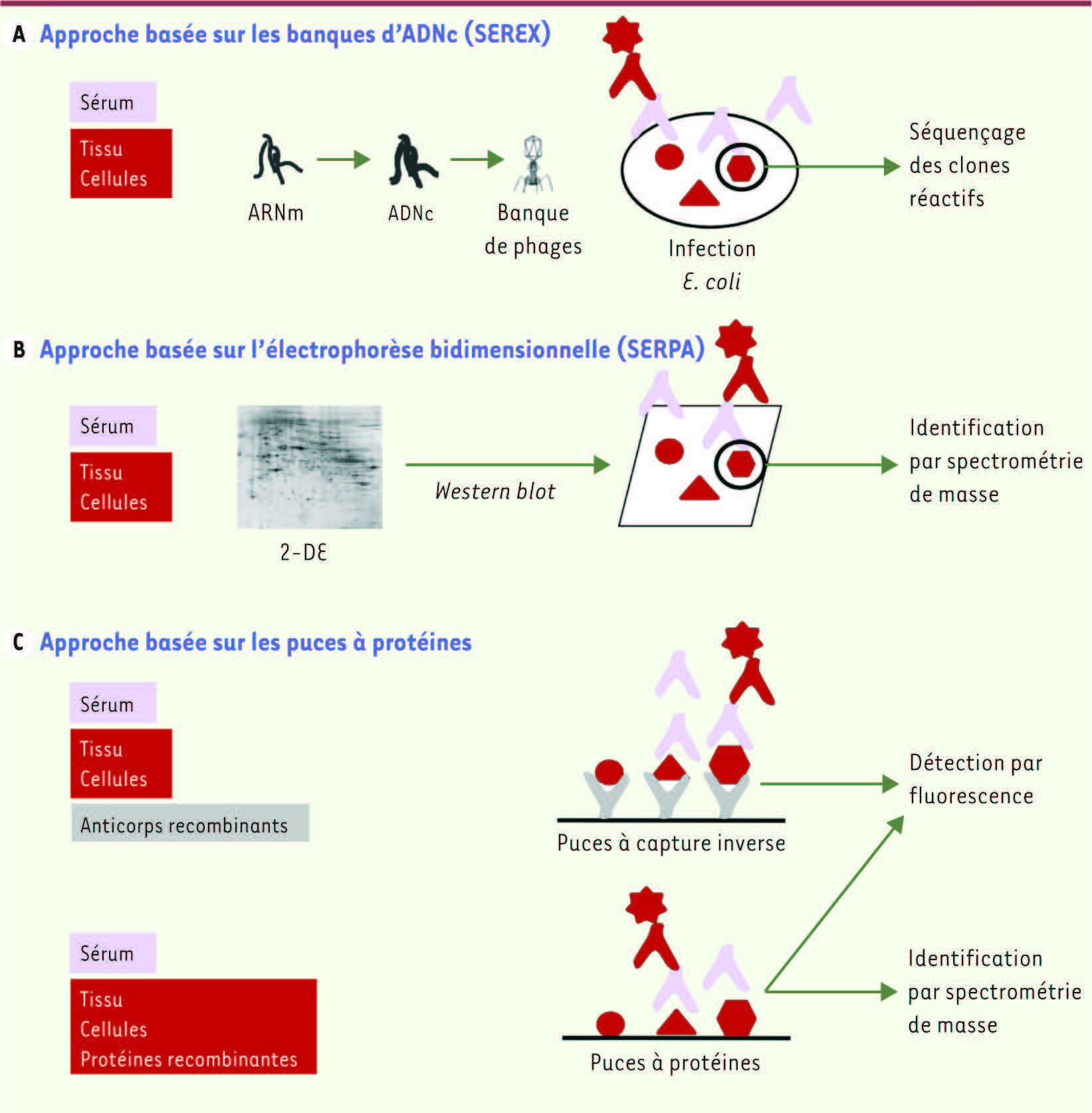
Autoantigènes et autoanticorps associés : techniques d’identification Le répertoire d’autoanticorps liés aux tumeurs est généralement étudié par des techniques de protéomique [
29]. Les deux techniques principales qui ont permis d’identifier un très grand nombre d’autoantigènes sont le SEREX (serological identification of antigens by recombinant expression cloning) et le SERPA (serological proteome analysis) (Figure 1A et B). Elles restent à ce titre les techniques de référence pour l’étude de la réponse humorale au développement d’un cancer. Cette analyse a largement profité des progrès technologiques réalisés ces dernières années dans la miniaturisation des outils. En effet, sur le même principe que celui des puces à ADN, des puces à protéines ont été développées (Figure 1C). Leur principe est basé sur l’immobilisation d’antigènes ou d’anticorps sur un support (lame) et sur une analyse différentielle des interactions autoantigène/autoanticorps. Ces puces à protéines ont facilité la découverte de nouveaux autoanticorps et des antigènes qui leur sont associés dans le sérum de patients atteints de cancer (pour revue, voir [3]).
 | Figure 1
Techniques de protéomique utilisées pour l’identification des autoantigènes tumoraux. A. Le criblage des autoantigènes exprimés par les tumeurs a d’abord été réalisé par la technique du SEREX [
25,
26]. Une banque d’expression d’ADNc est construite à partir d’échantillons tumoraux et clonée dans des phages d’expression. Les phages recombinants sont ensuite transfectés dans des bactéries ( E. coli). Les protéines recombinantes, exprimées durant l’infection des bactéries, sont transférées sur une membrane de nitrocellulose qui est ensuite incubée avec le sérum autologue du patient. Les clones réagissant avec les anticorps des patients (IgG) sont identifiés par un second anticorps conjugué à une enzyme. L’ADNc correspondant est ensuite séquencé. Le principal avantage du SEREX est qu’il permet l’exploration de la réponse humorale dans le sérum des patients avec leur propre tumeur comme source antigénique. B. La seconde technique, le SERPA, associe une séparation des protéines tumorales par électrophorèse bidimensionnelle (2-DE) en fonction de leur point isoélectrique (pI) et de leur poids moléculaire (PM). Les protéines sont transférées et immobilisées sur une membrane. Les sérums des patients atteints de cancer ou des contrôles sont criblés individuellement, permettant l’immunodétection d’antigènes spécifiques parmi plusieurs milliers de protéines séparées. Le marquage comparatif des blots permet la détection de spots réagissant spécifiquement avec les sérums de cancer. Ces spots sont ensuite excisés du gel et les protéines sont identifiées par spectrométrie de masse. Le SERPA permet l’identification d’isoformes et de modifications post-traductionnelles, mais est limité concernant l’identification de protéines de faible poids moléculaire ou de faible abondance, à cause de la sensibilité de détection. C. L’approche par puces regroupe 2 formats. Les puces à protéines (C) sont basées sur des centaines voire des milliers d’antigènes connus immobilisés sur une lame de verre. Les puces sont ensuite incubées avec des sérums de patients et de contrôles afin d’isoler les antigènes qui réagissent spécifiquement. En général, les protéines sont produites dans des systèmes procaryotes ( E. coli), ce qui empêche l’identification de modifications post-traductionnelles. Les puces à capture inverse immobilisent non plus des protéines, mais des anticorps connus et spécifiques synthétisés pour lier les antigènes natifs contenus dans les extraits de tumeurs ou de lignées cellulaires. Les autoanticorps provenant de patients et de contrôles sont marqués avec différentes cyanines fluorescentes et, après incubation, le ratio de fluorescence détermine l’abondance relative des autoanticorps dans un échantillon donné. L’identification est directe grâce aux anticorps connus, et cette technique, contrairement aux puces à protéines, permet l’identification d’épitopes tumoraux naturels et de modifications post-traductionnelles. |
|
Intérêt clinique de l’étude des profils sériques d’autoanticorps pour la détection précoce des cancers Les autoanticorps comme source de biomarqueurs Bien que peu de données soient disponibles concernant l’origine de la production d’autoanticorps en réponse à la présence tumorale, il est maintenant bien établi que les patients atteints de cancers produisent des autoanticorps contre des protéines mutées [
4], mal repliées [
5], surexprimées [
6], dégradées de manière aberrante [
7], glycosylées de manière aberrante [
8,
9], ou exprimées de manière ectopique [
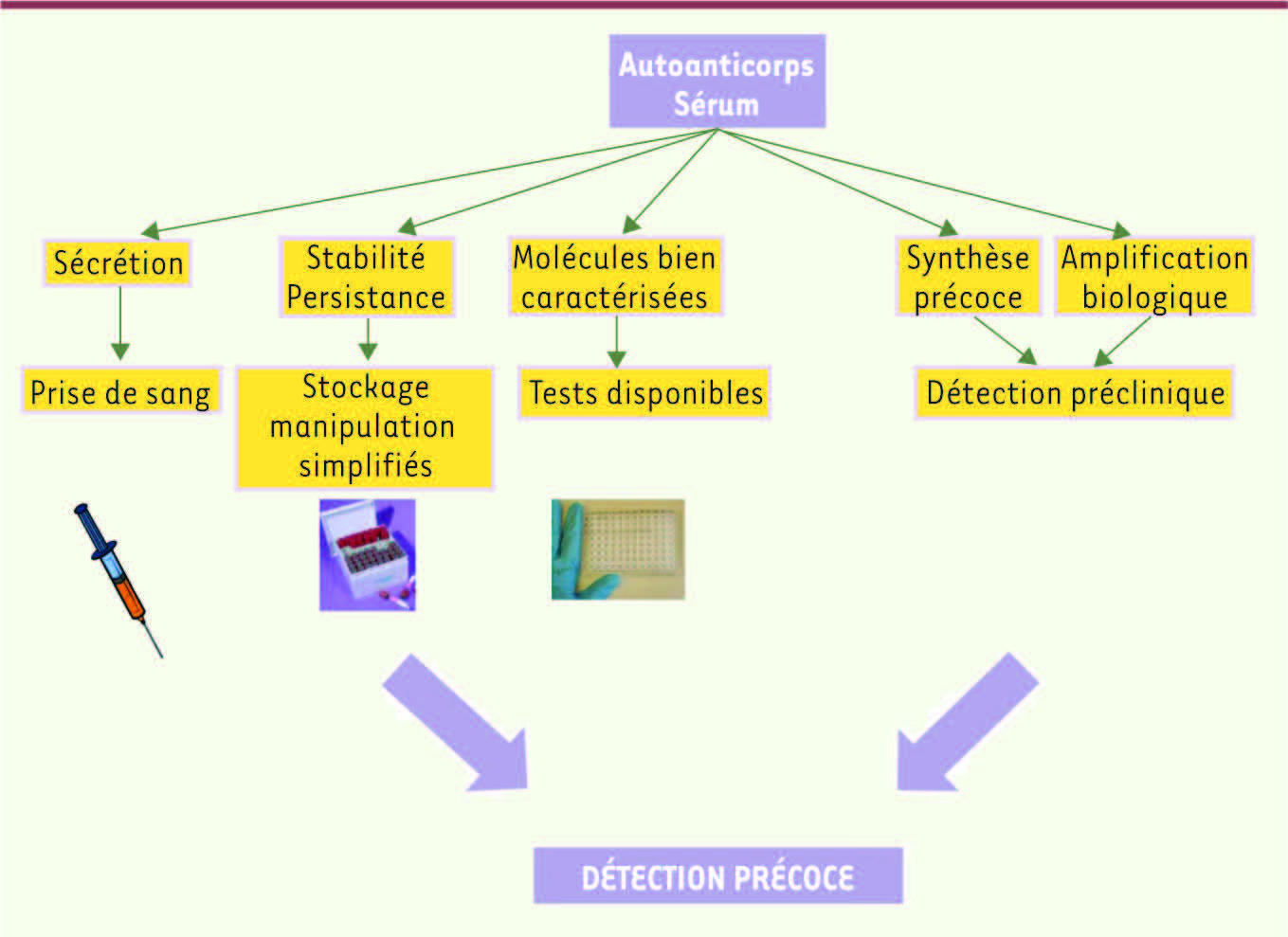
10]. Ces réponses spontanées sont fréquemment détectées chez les patients, de 5 à 30 % des patients pour un seul autoantigène. Les autoanticorps sont un groupe de biomarqueurs sériques qui présentent des propriétés intéressantes pour la détection précoce des cancers (Figure 2). En effet, ils apparaissent très tôt au cours du développement tumoral [
11]. De plus, ils sont sécrétés dans la circulation systémique et peuvent donc être facilement accessibles par une simple prise de sang. Par ailleurs, leur stabilité dans le sérum des patients en fait des marqueurs tout à fait remarquables comparativement à d’autres marqueurs potentiels, y compris les autoantigènes eux-mêmes qui sont rapidement dégradés dans le sérum ou rapidement éliminés [
12]. En effet, les anticorps ne sont pas soumis à la protéolyse, ce qui simplifie la manipulation et la collecte des échantillons. Enfin, les anticorps sont des molécules biochimiquement bien caractérisées, et de nombreux réactifs et techniques sont disponibles pour leur détection, ce qui simplifie le développement de tests.
 | Figure 2
Synthèse des avantages d’un test précoce basé sur une signature d’autoanticorps.
|
Principe d’une signature humorale spécifique des cancers Au cours de ces dernières années, les études sur les autoanticorps se sont focalisées sur l’identification non pas de marqueurs uniques mais d’un panel de biomarqueurs, constituant de véritables signatures humorales des cancers. En effet, la plupart des études montrent qu’en moyenne, la fréquence d’apparition chez les patients d’un autoanticorps pris isolément est d’environ 30 %. De plus, un même autoanticorps peut être produit dans différents types de cancer. Par exemple, seuls 20 à 40 % des patients atteints de cancer développent des autoanticorps dirigés contre la protéine p53 mutée [
13]. L’hétérogénéité cellulaire des cancers ainsi que la variabilité interindividuelle de la réponse immunitaire en général expliquent probablement à elles seules l’hétérogénéité de la réponse humorale chez les patients. Ainsi, étant donné qu’il n’existe pas d’autoanticorps produits systématiquement chez tous les patients atteints de cancer, il est apparu important d’identifier une combinaison de marqueurs bien définie qui permette d’augmenter la sensibilité et la spécificité de la détection. Les signatures humorales des populations à haut risque de cancer broncho-pulmonaire La reconnaissance de panels (signatures) d’autoanticorps a un intérêt tout particulier dans certaines populations présentant un risque élevé de cancer mais il est difficile de les identifier à cause du manque de sensibilité des méthodes de détection. Ceci est particulièrement vrai dans le cas des cancers du poumon. En effet, la radiographie pulmonaire et le scanner hélicoïdal sont les méthodes de dépistage les plus couramment utilisées chez les patients ayant un tabagisme chronique et à haut risque de cancer, présentant le plus souvent un degré avancé de fibrose pulmonaire [
27]. Tout nodule suspect est alors exploré par biopsie bronchique voire thoracotomie exploratrice, ou alors, si cela est impossible, par la mise en place d’une surveillance radiographique et clinique rapprochée. Or, il s’avère que près de 90 % des nodules pulmonaires détectés se révèlent être bénins, ce qui signifie que le geste interventionnel est inutile dans plus de 20 % des cas [
14]. La surveillance radiographique est donc très délicate chez ces patients et cette approche montre ici ses limites. Plusieurs signatures humorales ont été décrites dans différentes cohortes de patients à risque élevé de cancer du poumon. Celle proposée par l’équipe de Hanash est probablement la plus prometteuse. À partir d’une approche basée sur le principe des puces à protéines, cette équipe a tout d’abord sélectionné un groupe de trois autoanticorps (dirigés contre l’annexine I, le récepteur de la laminine 1 [LAMR1], et la protéine 14-3-3 thêta) spécifique d’un groupe de cancers. Par la suite, la sensibilité et la spécificité de ce profil ont été étudiées dans un second groupe indépendant de 85 patients bronchitiques chroniques qui ne présentaient aucune anomalie clinique ou radiographique pathognomonique d’un cancer du poumon. De manière très intéressante, les patients chez lesquels les valeurs d’anticorps étaient élevées développeront quelques mois plus tard un cancer bronchopulmonaire [
15]. Chen et ses collaborateurs ont développé une approche similaire à partir de banque de phages [
16]. Un profil humoral de 22 peptides immunogènes a été analysé dans une population de 125 patients porteurs d’un cancer du poumon comparée à une population tabagique chronique. Les résultats ont montré que ce panel permettait de discriminer les 2 groupes avec une sensibilité de 85 % et une spécificité de 86 %. De même, le groupe de Robertson a étudié un panel de sept autoanticorps (dirigés contre les protéines p53, c-myc, HER2 [human epidermal growth factor receptor 2], NY-ESO-1 [de la famille des cancer-testis antigens], CAGE [cancer-associated antigen gene], MUC1 [Mucin 1, cell surface associated] et GBU4-5) par la technique ELISA dont la sensibilité et la spécificité étaient respectivement de 76 % et 92 % [
17]. Dans une étude publiée très récemment, des sensibilités de 36 %, 39 % et 37 % et des spécificités de 91 %, 89 % et 90 % ont été observées dans trois cohortes indépendantes de patients porteurs d’un cancer du poumon à partir d’un profil humoral de six autoanticorps (dirigés contre les protéines p53, NY-ESO-1, CAGE, GBU4-5, annexine 1 et SOX2) [
18]. Enfin, des travaux récents ont utilisé une banque d’expression d’ADN complémentaire pour identifier six peptides immunogènes. Ceux-ci ont été proposés comme signature humorale et ont permis de distinguer les patients atteints de cancers (n#x00A0;= 90) de ceux qui n’étaient pas atteints (n = 90) et des patients bronchitiques chroniques (n = 30) avec une sensibilité et une spécificité élevées (> 93#x00A0;%) [
19]. Ainsi, cette signature humorale basée sur l’étude de la fréquence d’apparition d’un panel d’anticorps est une approche prometteuse pour le diagnostic des formes précoces de cancer. Une telle signature, si elle devait être utilisée, le serait en complément des examens radiographiques afin de diminuer le nombre de faux positifs qui reste extrêmement élevé en pratique clinique. Toutefois, les résultats de ces études soulignent également qu’il est difficile de distinguer par ces approches les cancers de bas grade des cancers de haut grade [
20], et les différents sous-types histologiques de cancer du poumon [18, 20], probablement parce que des sous-ensembles communs d’autoanticorps sont produits en réponse à un type histologique, voire moléculaire, de cancer. Intérêt des autoanticorps dans le diagnostic précoce des formes pré-invasives de cancer du sein L’identification d’une signature humorale spécifique des formes précoces des cancers du sein est également une voie de recherche largement explorée. Ceci s’explique notamment par les limites actuelles du dépistage par mammographie. La mammographie est une technique dont la sensibilité est élevée dans la population générale, ce qui explique en grande partie l’augmentation de l’incidence des formes précoces de cancer du sein en France depuis 20 ans [
21,
28]. Malgré tout, sa sensibilité chute considérablement dans les cancers sans signes d’appel radiographiques évidents, le plus souvent chez des patientes ayant une densité mammaire radiographique élevée. Les principaux signes d’appel sont les microcalcifications des tumeurs et la réaction stromale desmoplastique 1,. Les microcalcifications, qui proviennent de la calcification de la nécrose axiale des formes de haut grade histologique, ne sont pas systématiques puisque 15 à 20 % de nécroses axiales n’ont pas de calcifications. De plus, elles sont absentes dans les tumeurs de bas grade. Par ailleurs, la radiographie des seins denses produit une quantité importante de rayonnements diffusés responsables d’un manque de contraste entre les opacités et le tissu mammaire environnant. Les signes indirects (signe de la tente, bombement anormal dans la graisse rétroglandulaire, surdensité focale, rupture architecturale et attraction convergente anormale des crêtes de Duret 2) sont alors importants à rechercher mais ils sont difficiles à mettre en évidence et parfois même absents. Dans ce contexte, notre équipe a mis en évidence par la technique du SERPA une signature humorale composée de cinq autoanticorps dirigés contre les protéines FKBP52, cyclophiline A, péroxiredoxine 2, HSP60 et MUC1, qui a permis de discriminer 82 patientes atteintes de carcinomes ductaux in situ (DCIS) de 93 femmes sans cancer avec une sensibilité de 72,2 % et une spécificité de 72,6 % [
22]. Une autre équipe a développé un test comprenant sept autoanticorps (dirigés contre p53, c-myc, NY-ESO-1, BRCA1, BRCA2, HER2, MUC1) [
23]. Ce test a une sensibilité de 45 % chez les femmes ayant développé un DCIS et de 68 % chez les femmes atteintes de carcinomes primaires, avec une spécificité de 85 %. De telles signatures, si elles étaient utilisées en pratique clinique, pourraient permettre de proposer aux femmes chez lesquelles la mammographie s’avère négative mais le test autoanticorps positif des examens complémentaires plus adaptés (échographie, imagerie à résonance magnétique, etc.). |
Ils portent principalement sur l’identification des combinaisons d’antigènes les plus pertinentes possibles. Plusieurs points sont à prendre en considération. Premièrement, la source d’antigènes doit être la plus proche possible des conditions physiopathologiques à l’origine de la réponse humorale chez les individus atteints de cancers. Les extraits protéiques tumoraux sont probablement le meilleur choix, bien que la disponibilité de ces tissus soit en pratique très dépendante du type tumoral. À titre d’exemple, l’obtention d’échantillons de lésions pré-invasives est souvent de l’ordre de l’impossible du fait de la nécessité pour le pathologiste d’étudier la pièce opératoire dans son ensemble afin de s’assurer de l’absence d’invasion ou de micro-invasion. Ces conditions permettent également de conserver les protéines immunogènes avec leurs modifications post-traductionnelles (glycosylation, phosphorylation, sumoylation, etc.). L’amélioration des techniques de protéomique est également un des défis majeurs dans un avenir proche. Dans cet objectif, des techniques de séparation telles que la nanochromatographie liquide permettent aux protéines de relativement faible abondance d’être analysées. Enfin, il faudrait probablement utiliser les données de la littérature afin de proposer une combinaison de nouveaux marqueurs et de marqueurs existants. Dans une étude de premier ordre, Wang et ses collaborateurs [
24] ont proposé de combiner un panel de 22 peptides immunogènes avec la détection du marqueur de référence, l’antigène spécifique de prostate (PSA). Cette signature permet d’obtenir une sensibilité significativement supérieure (93 %) à celle du PSA seul (80 %), améliorant ainsi sa valeur diagnostique. Ce panel pourrait être utilisé pour les patients qui présentent des taux sériques de PSA inférieurs ou égaux à 10 ng/ml, comme aide à la décision de pratiquer une biopsie. |
Conclusion et perspectives La sensibilité et la spécificité des panels d’autoanticorps utilisés pour détecter précocement les cancers se sont significativement améliorées et ont ainsi apporté la preuve que la détection préclinique était réalisable dans les groupes à haut risque tels que les bronchitiques chroniques dans le cancer du poumon. Ces tests seraient alors proposés en complément des examens radiographiques standard afin de réduire la proportion des faux positifs. Dans d’autres types de cancers comme le cancer du sein, ces études sont entravées par le manque de disponibilité de sérums, de tumeurs à des stades précoces, et de cohortes pré-diagnostiques. À ce titre, l’analyse des populations porteuses de formes familiales de cancer (mutations de BRCA1-2) serait d’un grand intérêt. La disponibilité d’échantillons humains est donc un facteur très limitant pour étudier la réponse humorale dans les cancers. Comme nous l’avons vu, les données actuelles concernant les autoanticorps sont prometteuses mais manquent d’études de validation. Dans l’avenir, la plupart des études devront être validées cliniquement dans de larges cohortes de patients indépendantes et multicentriques afin de déterminer la valeur des biomarqueurs potentiels en termes de sensibilité, spécificité et de valeur prédictive. |
Footnotes |
1.
Etzioni
R
,
Urban
N
,
Ramsey
S
, et al.
The case for early detection . Nat Rev Cancer.
2003; ; 3 : :243.-252. 2.
Kulasingam
V
,
Diamandis
EP
. Strategies for discovering novel cancer biomarkers through utilization of emerging technologies . Nat Clin Pract Oncol.
2008; ; 5 : :588.-599. 3.
Tan
HT
,
Low
J
,
Lim
SG
,
Chung
MC
. Serum autoantibodies as biomarkers for early cancer detection . Febs J.
2009; ; 276 : :6880.-6904. 4.
Soussi
T
. p53 Antibodies in the sera of patients with various types of cancer : a review . Cancer Res.
2000; ; 60 : :1777.-1788. 5.
Schubert
U
,
Antón
LC
,
Gibbs
J
, et al.
Rapid degradation of a large fraction of newly synthesized proteins by proteasomes . Nature.
2000; ; 404 : :770.-774. 6.
Chen
YT
,
Scanlan
MJ
,
Sahin
U
, et al.
A testicular antigen aberrantly expressed in human cancers detected by autologous antibody screening . Proc Natl Acad Sci USA.
1997; ; 94 : :1914.-1918. 7.
Ulanet
DB
,
Torbenson
M
,
Dang
CV
, et al.
Unique conformation of cancer autoantigen B23 in hepatoma : a mechanism for specificity in the autoimmune response . Proc Natl Acad Sci U S A.
2003; ; 100 : :12361.-12366. 8.
von Mensdorff-Pouilly
S
,
Petrakou
E
,
Kenemans
P
, et al.
Reactivity of natural and induced human antibodies to MUC1 mucin with MUC1 peptides and n-acetylgalactosamine (GalNAc) peptides . Int J Cancer.
2000; ; 86 : :702.-712. 9.
Wandall
HH
,
Blixt
O
,
Tarp
MA
, et al.
Cancer biomarkers defined by autoantibody signatures to aberrant O-glycopeptide epitopes . Cancer Res.
2010; ; 70 : :1306.-1313. 10.
Hansen
MH
,
Nielsen
H
,
Ditzel
HJ
. The tumor-infiltrating B cell response in medullary breast cancer is oligoclonal and directed against the autoantigen actin exposed on the surface of apoptotic cancer cells . Proc Natl Acad Sci USA.
2001; ; 98 : :12659.-12664. 11.
Hanash
S
. Harnessing immunity for cancer marker discovery . Nat Biotechnol.
2003; ; 21 : :37.-38. 12.
Anderson
KS
,
LaBaer
J
. The sentinel within : exploiting the immune system for cancer biomarkers . J Proteome Res.
2005; ; 4 : :1123.-1133. 13.
Li
Y
,
Karjalainen
A
,
Koskinen
H
, et al.
p53 autoantibodies predict subsequent development of cancer . Int J Cancer.
2005; ; 114 : :157.-160. 14.
International Early Lung Cancer Action Program Investigators. ,
Henschke
CI
,
Yankelevitz
DF
,
Libby
DM
, et al.
Survival of patients with stage I lung cancer detected on CT screening . N Engl J Med.
2006; ; 355 : :1763.-1771. 15.
Madoz-Gúrpide
J
,
Kuick
R
,
Wang
H
,
Misek
DE
,
Hanash
SM
. Integral protein microarrays for the identification of lung cancer antigens in sera that induce a humoral immune response . Mol Cell Proteomics.
2008; ; 7 : :268.-281. 16.
Chen
G
,
Wang
X
,
Yu
J
,
Varambally
S
, et al.
Autoantibody profiles reveal ubiquilin 1 as a humoral immune response target in lung adenocarcinoma . Cancer Res.
2007; ; 67 : :3461.-3467. 17.
Chapman
CJ
,
Murray
A
,
McElveen
JE
, et al.
Autoantibodies in lung cancer : possibilities for early detection and subsequent cure . Thorax.
2008; ; 63 : :228.-233. 18.
Boyle
P
,
Chapman
CJ
,
Holdenrieder
S
, et al.
Clinical validation of an autoantibody test for lung cancer . Ann Oncol.
2011; ; 22 : :383.-389. 19.
Leidinger
P
,
Keller
A
,
Ludwig
N
, et al.
Toward an early diagnosis of lung cancer : an autoantibody signature for squamous cell lung carcinoma . Int J Cancer.
2008; ; 123 : :1631.-1636. 20.
Leidinger
P
,
Keller
A
,
Heisel
S
, et al.
Identification of lung cancer with high sensitivity, specificity by blood testing . Respir Res.
2010; ; 11 : :18.. 21.
Launoy
G
. Epidemiology of cancers in France . Rev Prat.
2010; ; 60 : :178.-182. 22.
Desmetz
C
,
Bascoul-Mollevi
C
,
Rochaix
P
, et al.
Identification of a new panel of serum autoantibodies associated with the presence of in situ carcinoma of the breast in younger women . Clin Cancer Res.
2009; ; 15 : :4733.-4741. 23.
Chapman
C
,
Murray
A
,
Chakrabarti
J
, et al.
Autoantibodies in breast cancer : their use as an aid to early diagnosis . Ann Oncol.
2007; ; 18 : :868.-873. 24.
Wang
X
,
Yu
J
,
Sreekumar
A
,
Varambally
S
, et al.
Autoantibody signatures in prostate cancer . N Engl J Med.
2005; ; 353 : :1224.-1235. 25.
Caron
M
,
Choquet-Kastylevsky
G
,
Joubert-Caron
R
. Cancer immunomics using autoantibody signatures for biomarker discovery . Mol Cell Proteomics.
2007; ; 6 : :1115.-1122. 26.
Sahin
U
,
Türeci
O
,
Pfreundschuh
M
. Serological identification of human tumor antigens . Curr Opin Immunol.
199 ; (9): :709.-716. 27.
Flahault
A
,
Costagliola
D
. Is lung cancer screening by the helical scanner justified ?
Med Sci (Paris).
2007; ; 23 : :333.-334. 28.
Hill
C
. Critical interpretation of the cancer incidence increase in France . Med Sci (Paris).
2009; ; 25 : :297.-299. 29.
Desmetz
C
,
Mangé
A
,
Solassol
J
. Comparison of proteomic strategies to identify antibodies resulting from the humoral immune response to cancer . Med Sci (Paris).
2008; ; 24 : :1071.-1076. 30.
Julian-Reynier
C
. Prédisposition génétique aux cancers du sein et de l’ovaire : importance des résultats des tests . Med Sci (Paris).
2011; ; 27 : :657.-661. |