| |
| Med Sci (Paris). 2011 June; 27(6-7): 639–650. Published online 2011 July 1. doi: 10.1051/medsci/2011276017.Imagerie et cognition (5) - La neuro-imagerie De la psychiatrie à la pédopsychiatrie Jean-Luc Martinot1,2* and Stéphanie Mana1,2 1Unité 1000 Inserm, CEA, université Paris Sud, université Paris Descartes; Maison de Solenn, Maison des adolescents, Hôpital Cochin, 97, boulevard de Port Royal, 75014Paris, France 2SHFJ-CEA, Orsay, France |
L’étude des bases physiologiques des troubles psychiques est un champ d’investigation relativement récent qui a largement bénéficié de l’avènement des techniques de neuro-imagerie au cours des années 1980. En rendant possible la mesure de l’activité du cerveau in vivo chez l’homme, elles ont permis d’explorer l’incarnation des maladies mentales. Différentes modifications cérébrales fonctionnelles et structurelles ont été identifiées pour chacune de ces maladies et ce, quels que soient le diagnostic psychiatrique et l’âge de la vie. Sans préjuger de l’origine de ces modifications, leur démonstration dans quasiment tous les troubles psychiatriques révèle que ces affections ne sont pas de simples « maux de l’âme » mais de réelles maladies liées aux modifications et aux dysfonctionnements d’un organe : le cerveau. Un tel constat devrait aider à changer le regard porté par la société sur ces patients et leur entourage, et dans certains cas où l’évolution est marquée par la chronicité, tels l’autisme infantile et certaines schizophrénies ou troubles affectifs. C’est toute la problématique du handicap psychique ayant un substrat organique qui pourrait être soulevée. Récemment, les techniques d’imagerie ont révélé que ces déviations cérébrales sont souvent présentes dès l’enfance et parfois avant même l’apparition des symptômes, suggérant l’interaction de facteurs (psycho) pathogènes avec le développement du cerveau. Il est ainsi logique de développer les recherches sur ces interactions cérébrales en psychiatrie de l’enfant et de l’adolescent1. À terme, ces informations issues de la recherche en imagerie pourraient, parmi d’autres, aider à définir une politique de prévention plus efficace et moins coûteuse et ainsi contribuer aux décisions en faveur de la santé mentale. Enfin, un champ nouveau en imagerie est celui de l’impact des thérapeutiques psychiatriques quelles qu’elles soient, sur la plasticité cérébrale. Par exemple, en psychopharmacologie in vivo, l’imagerie permet d’évaluer les mécanismes liés à l’efficacité des médicaments et d’affiner leur logique de prescription en clinique. Sans prétendre à l’exhaustivité, nous allons illustrer ces différentes idées en développant quelques-unes des connaissances acquises en imagerie au cours des deux dernières décennies. |
Les troubles de la maturation cérébrale Les schizophrénies Les psychoses schizophréniques constituent un groupe de troubles mentaux chroniques caractérisés par l’association hétérogène de symptômes dits positifs (idées délirantes, hallucinations) et négatifs (réduction ou inadéquation des affects, réduction de la communication, déficits cognitifs). Elles débutent le plus souvent vers la fin de l’adolescence. Leurs causes demeurent inconnues, mais les mécanismes cérébraux qui sous-tendent cette symptomatologie commencent à être entrevus. |
Schizophrénie et trouble du développement des cortex associatifs De nombreuses modifications de la morphologie cérébrale ont été observées en imagerie, telles des réductions de la matière grise et du volume des cortex associatifs antérieurs, postérieurs et médio-frontaux, et des régions paralimbiques [
1–
4]. Il semblerait que ces divers changements apparaissent de façon relativement précoce. Ainsi, une réduction significative de la matière grise a été observée dès l’adolescence (Figure 1). D’abord localisée au niveau des régions pariétales, elle progresse ensuite en avant, vers les régions limbiques et temporales, puis frontales [
5,
6]. Pris dans leur ensemble, les travaux d’imagerie s’accordent pour éliminer les explications neurodégénératives et favoriser les hypothèses neurodéveloppementales des anomalies structurales observées dans la schizophrénie. Ainsi, une partie des patients ayant un diagnostic de schizophrénie aurait une perturbation du développement cérébral, éventuellement très précoce, entraînant des modifications de la maturation des régions limbiques et des cortex associatifs. La nature moléculaire de cette implication neurale dans la genèse des troubles reste à préciser.
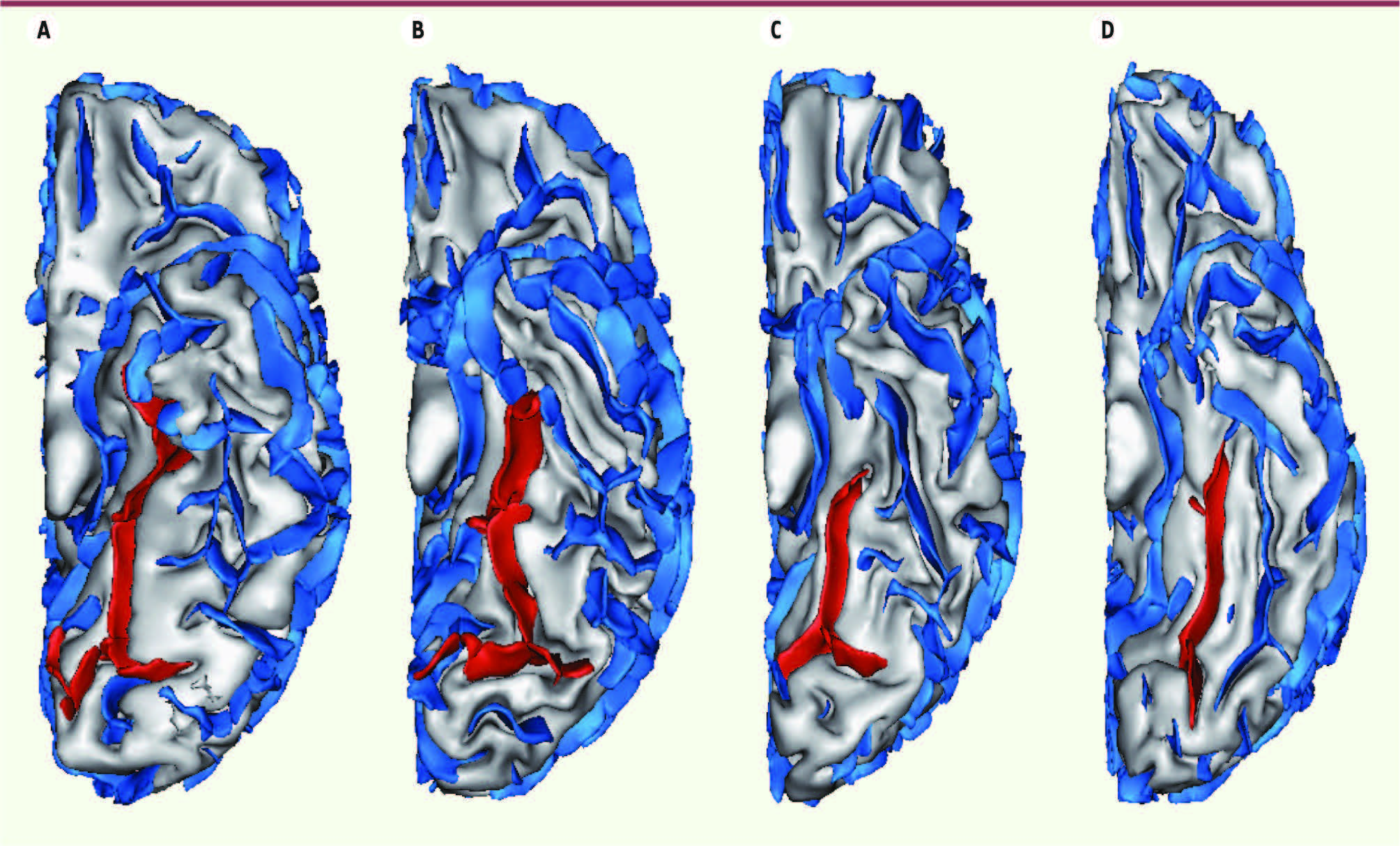
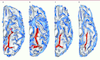 | Figure 1Cortex temporal limbique (vue de dessous) et schizophrénie à l’adolescence : région parahippocampique. A, B. Sillon collatéral chez deux adolescents témoins. C, D. Sillon collatéral chez deux adolescents atteints de schizophrénie. Cette modification de l’architecture du cortex traduit une déviation de la structure du complexe amygdalo-hippocampique [
3]. |
|
Imagerie cérébrale des hallucinations auditives Parallèlement à la mise en évidence de variations de la maturation cérébrale, les concomitants cérébraux des symptômes psychotiques ont été recherchés, notamment ceux qui accompagnent les phénomènes hallucinatoires, le plus souvent de nature auditive (voix). Les études d’imagerie portant sur ce type d’hallucinations convergent vers un même résultat, celui d’un traitement anormal des représentations auditives au niveau du lobe temporal et des cortex associatifs postérieurs, conjoint à une relative « faillite » des réseaux fronto-cingulaires contrôlant l’affichage à la conscience [
7–
9]. Ainsi, les hallucinations auditives s’accompagnent d’une augmentation de l’activation de régions impliquées dans le langage (régions du lobe temporal, thalamus et aire de Broca) au moment même de leur perception subjective [
10,
11]. En revanche, l’analyse de ces réseaux fonctionnels au cours de la présentation de mots montre une réduction de leur activation chez les patients schizophrènes comparés aux sujets témoins [
12,
13]. De même, lorsque l’on demande aux sujets de générer des mots, une hypoactivité des régions frontales gauches (aire de Broca) est observable tandis que les régions frontales et pariétales droites (effort intentionnel de recherche en mémoire) sont d’autant plus actives que les performances des patients schizophrènes sont dégradées [7]. Tout se passe comme si les patients ne parvenaient pas à activer les aires classiquement sollicitées par la tâche linguistique et compensaient ce déficit par le recrutement d’autres régions. Sur la base de ces données, il peut être avancé que les hallucinations auditives sont liées à des anomalies neurales situées dans les mêmes réseaux cérébraux que ceux qui sont impliqués dans la perception normale du langage. De fait, l’étude des volumes et de la morphologie du cortex montre l’existence de réductions statistiquement significatives des régions temporales supérieures et du carrefour pariéto-temporal [1]. Des aspects intimes de la phénoménologie hallucinatoire comme leur caractère égodystonique2, pourraient même être liés à des modifications de la gyrification3, ou de la volumétrie de ce carrefour temporo-pariétal [12]. Des modifications de la connectivité anatomique sont probables car une réduction de la matière blanche frontale - constituée des faisceaux d’axones myélinisés reliant les régions cérébrales − a été observée [
2]. De même, une altération du faisceau arqué, qui relie les régions associatives antérieures et postérieures, a été observée chez les schizophrènes ayant des hallucinations auditives comparés aux patients qui n’en ont pas [
14]. Ainsi, de telles altérations pourraient constituer une vulnérabilité aux phénomènes hallucinatoires, facilitant ensuite le développement de modifications plus labiles des activités cérébrales régionales. Les informations apportées par l’imagerie sur l’identification des bases neurales des hallucinations schizophréniques ont aussi eu pour intérêt de guider et d’évaluer des stratégies thérapeutiques nouvelles comme la stimulation magnétique transcrânienne [
15] dont l’efficacité dans le traitement des hallucinations pharmacorésistantes a été rapportée [
16,
17]. Toutefois, cette innovation thérapeutique a fait naître des espoirs qui doivent être relativisés car son efficacité n’est pas toujours confirmée lorsque l’essai thérapeutique est contrôlé et l’effet placebo pris en compte rigoureusement [
18]. |
Imagerie et étude des médicaments neuroleptiques L’évaluation in vivo de l’action des psychotropes est un autre domaine d’application des techniques d’imagerie fonctionnelle. Les patients schizophrènes sont traités par des médicaments neuroleptiques, généralement pendant la majeure partie de leur vie. Ces médicaments agissent sur les récepteurs dopaminergiques, et, selon les modèles animaux, leurs effets antipsychotiques seraient liés à leur fixation sur les voies méso-cortico-limbiques, tandis que leur action sur la voie nigro-striatale provoquerait des effets moteurs indésirables. Le développement d’un marqueur des récepteurs D2 extrastriataux a permis de tester cette hypothèse chez des patients traités en comparant la fixation de différents neuroleptiques par la technique de tomographie à positons. On distingue deux catégories de neuroleptiques : les neuroleptiques classiques, comme l’halopéridol, et les neuroleptiques atypiques comme la clozapine ou l’amisulpride. Le principal résultat de cette étude est celui d’une fixation différentielle de ces deux groupes. Ainsi, les neuroleptiques classiques, dont l’inconvénient majeur est qu’ils génèrent de nombreux effets secondaires de type moteur (tremblements, raideurs musculaires, etc.), se fixent fortement dans le striatum, alors que les neuroleptiques atypiques, dépourvus de ces complications motrices, bloquent essentiellement les récepteurs dopaminergiques D2 des régions extrastriatales [
19]. Ces résultats renforcent l’hypothèse de l’implication différentielle des voies dopaminergiques dans les effets thérapeutiques et secondaires des neuroleptiques. Ils démontrent aussi l’intérêt de ce type d’investigation pour l’évaluation du rapport bénéfice/risque d’effets indésirables dans le développement de nouvelles molécules. D’autre part, les résultats montrent que pour de faibles doses, de petites variations de posologie induisent d’importantes variations de l’occupation des récepteurs D2, ce qui devrait inciter les prescripteurs à modifier les doses administrées en procédant par petits paliers. Enfin, de fortes différences ont été observées d’un médicament à l’autre, de telle sorte que l’amélioration des symptômes négatifs correspond à des niveaux de blocage différents des récepteurs D2 en fonction des neuroleptiques [
20]. Ces travaux contribuent à optimiser la logique de prescription du traitement pharmacologique des schizophrènes. L’autisme infantile Des anomalies affectant tant les structures que la vitesse de la maturation cérébrale ont été détectées. Le résultat le plus marquant est la démonstration, chez des enfants ayant un syndrome autistique idiopathique, d’un déficit d’activation du gyrus temporal supérieur et de modifications de la volumétrie et de l’ultrastructure de cette région. Les mesures de la région temporale supérieure ont été corrélées à la gravité du syndrome autistique. Étant donné que cette région joue un rôle majeur dans le langage et les interactions sociales, ces données constituent un argument en faveur d’un lien entre des altérations de la maturation de cette région et le syndrome autistique. |
États dépressifs et système fronto-limbique La dépression regroupe un ensemble de troubles dont l’expression clinique est variable mais qui partagent certaines altérations communes. Il en est ainsi des modifications de l’humeur et des déficits cognitifs (réduction de concentration, troubles de la mémoire, etc.). Les techniques d’imagerie fonctionnelle ont permis de rechercher les régions cérébrales dont les modifications d’activité sont concomitantes de certains de ces symptômes dépressifs. Il en ressort une relation forte entre dépression et variations d’activité dans les régions limbiques et les cortex frontaux [
21]. Un hypométabolisme frontal gauche a notamment été identifié chez des patients souffrant d’une dépression bipolaire ou unipolaire qui corrèle avec l’intensité du ralentissement dépressif [
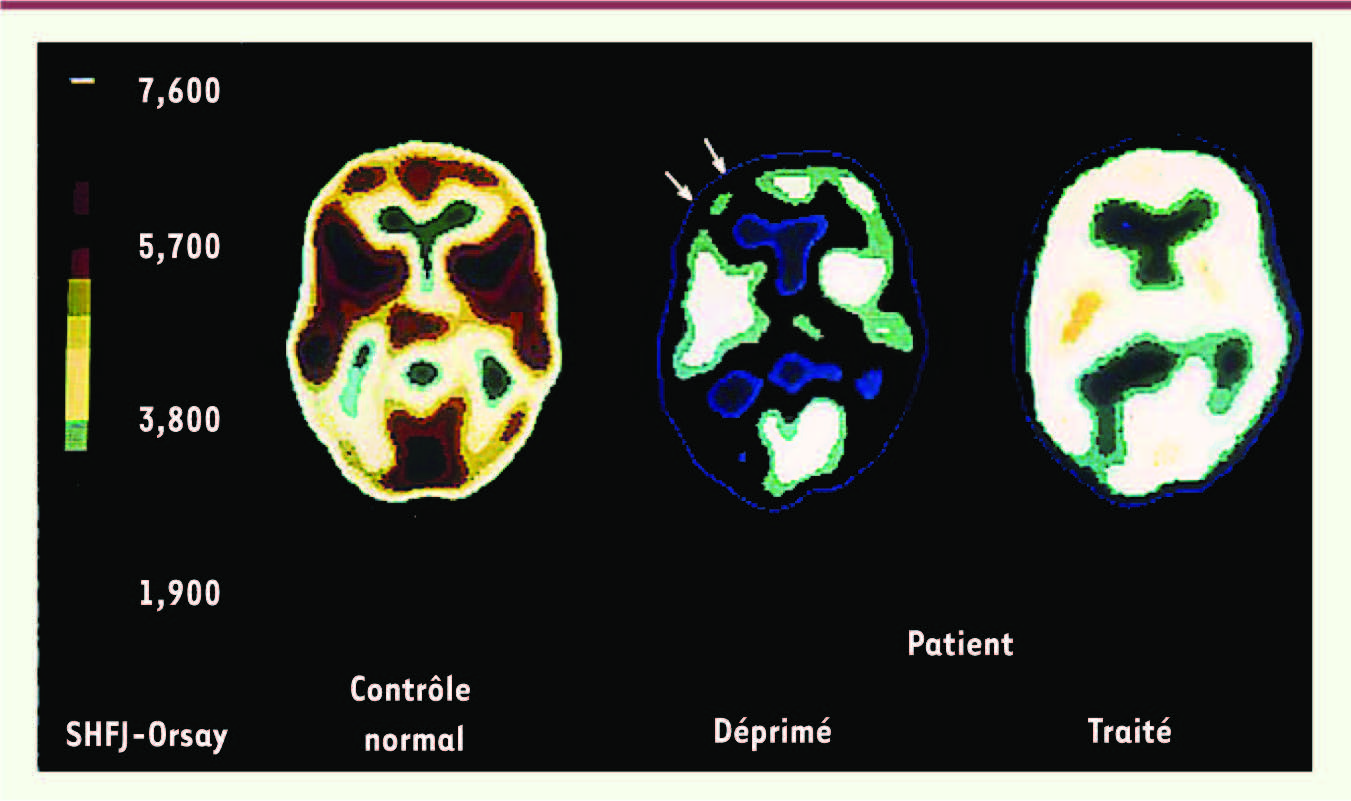
22] et s’amende partiellement lorsque les symptômes dépressifs ont disparu (Figure 2).
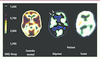 | Figure 2
Tomographie à positons au 18F-fluorodéoxyglucose chez un patient atteint d’état dépressif de type mélancolique. À gauche, image obtenue chez un sujet témoin. Au centre, chez un patient déprimé, le métabolisme est diminué dans l’ensemble de la coupe. De plus, une hypofrontalité relative est plus marquée dans les régions préfrontales gauches (flèches). À droite, après un mois de traitement antidépresseur efficace, l’asymétrie frontale disparaît, mais le métabolisme global reste plus bas que celui des témoins. En général, un traitement antidépresseur doit être maintenu au moins quatre mois pour minimiser le risque de rechute [ 22] (© J.L. Martinot et SHFT-CEA). |
Troubles cognitifs, dépression et imagerie d’activation L’IRM (imagerie par résonance magnétique) fonctionnelle (IRMf) a permis de mettre en évidence des différences de localisation des dysfonctionnements cérébraux en fonction des tests réalisés par les patients dépressifs bipolaires et unipolaires. Il en ressort une dichotomie entre troubles cognitifs « froids » (altération des fonctions exécutives, troubles de la mémoire, etc.), généralement associés à des déficits d’activation des réseaux préfrontaux, et troubles de la cognition « chaude » (traitement intégrant des informations émotionnelles) associés à des anomalies fonctionnelles des réseaux limbiques. Ainsi, une augmentation de l’activité dans l’amygdale, structure-clé du traitement des émotions, a été montrée au cours de protocoles consistant à présenter aux sujets des stimulus émotionnels tels des visages affichant différentes expressions (peur, joie, colère, etc.). De plus, chez les patients unipolaires, cette structure est davantage activée par les stimulus émotionnels à connotation négative, ce qui pourrait expliquer la tendance des sujets déprimés à focaliser leur attention sur les aspects tristes et à mémoriser davantage ces derniers [
23]. Des anomalies fonctionnelles ont également été notées au niveau de deux afférences majeures de l’amygdale, les cortex cingulaires antérieur et orbitaire, ainsi qu’au niveau des connexions unissant ces territoires. Par exemple, chez des sujets souffrant d’un trouble dépressif majeur, Matthews et al. [
24] ont constaté une réduction du couplage fonctionnel entre l’amygdale et le cortex cingulaire antérieur lors de traitements émotionnels, qui de plus corrèle avec la sévérité de la dépression. Ces données suggèrent une perte du contrôle cortical sur les réponses limbiques et pourraient expliquer l’augmentation de la réactivité de l’amygdale aux images négatives dans le groupe des sujets dépressifs. Il semble donc bien qu’un dysfonctionnement du circuit fronto-limbique soit une caractéristique majeure de l’état dépressif. États dépressifs et imagerie des systèmes de neurotransmission Les résultats de l’imagerie en tomographie à positons ont permis de développer des modèles neurobiologiques de la dépression, articulant ce trouble au dysfonctionnement des équilibres fonctionnels monoaminergiques fronto-limbiques [
25] suggéré par les modèles précliniques [
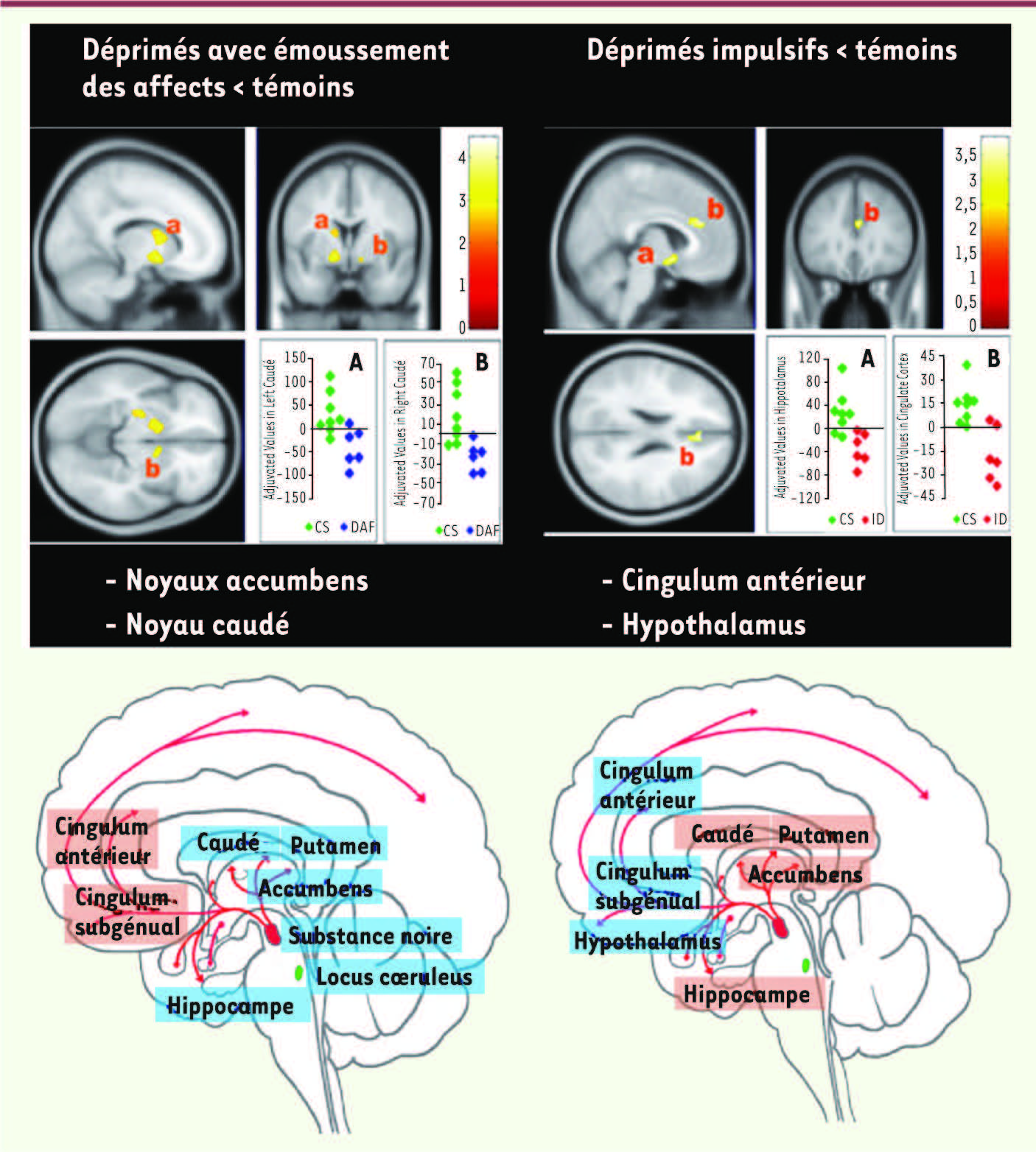
26]. Par exemple, des variations du métabolisme de la 18F-dopa ont été observées en fonction de la distinction phénoménologique entre les états dépressifs unipolaires marqués par l’impulsivité et ceux marqués par l’émoussement affectif (Figure 3).
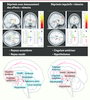 | Figure 3Variations du métabolisme de la 18F-dopa dans les syndromes dépressifs. En haut : sous-types de dépressions et métabolisme de la 18F-dopa, un précurseur des monoamines mesuré par tomographie à positons. Les graphes représentent les valeurs de l’incorporation de la DOPA mesurées chez chaque sujet dans ces différentes régions. CS : sujets témoins; DAF : déprimés avec émoussement des affects; ID : déprimés impulsifs. En bas : schémas synthétisant l’ensemble des modifications de la 18F-dopa détectées. En bleu : diminution; en orange clair : augmentation. À gauche : déprimés ayant un émoussement des affects et un ralentissement psychomoteur marqués : les diminutions sont circonscrites aux noyaux gris centraux et au tronc cérébral. À droite, déprimés ayant une impulsivité et une irritabilité marquées. Le pattern des modifications semble presque symétrique par rapport au schéma de gauche, avec des diminutions dans des régions de l’attention sélective (cingulum antérieur) et inhibant les sécrétions endocriniennes (hypothalamus). Le corollaire de ces résultats est qu’un même médicament antidépresseur agissant sur les catécholamines ne peut avoir la même action en fonction du type de dépression et que la recherche de traitements plus ciblés en fonction des dysfonctionnements régionaux est une voie innovante [ 25,
54]. |
États dépressifs et déviations structurales chez des patients résistants ou répondeurs Récemment, la détection de modifications statistiquement significatives de l’anatomie et de l’ultrastructure fronto-limbique chez des patients souffrant d’un syndrome dépressif souligne que les méthodologies d’imagerie peuvent mettre en évidence une vulnérabilité aux troubles dépassant le cadre de dysfonctionnements. Des collaborateurs de l’UMR 1000 Inserm-CEA ont ainsi observé que les états dépressifs résistants aux thérapeutiques usuelles s’accompagnent de diminutions volumétriques et morphométriques de ces régions [
27]. Des modifications de la matière blanche ont aussi pu être démontrées chez des sujets euthymiques en période de rémission, suivis pour un trouble de l’humeur bipolaire. Les altérations de l’ultrastructure de la matière blanche ont été détectées grâce à l’imagerie du tenseur de diffusion dans le faisceau unciné rassemblant les fibres qui relient deux épicentres impliqués dans l’interface entre fonctions cognitives et émotionnelles : les régions cingulaires antérieures subgénuales et le complexe amygdalo-hippocampique [
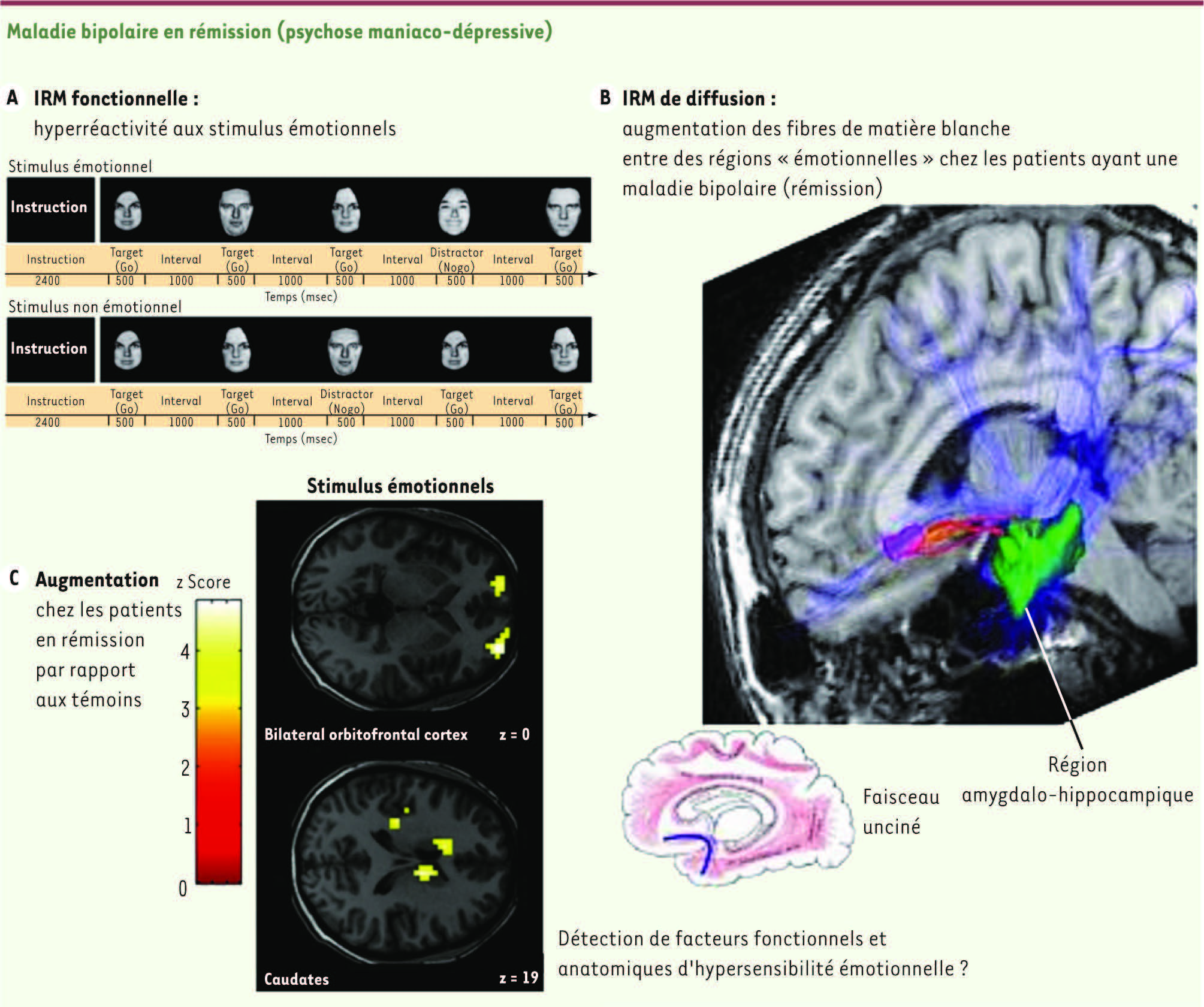
28]. Une augmentation du nombre de fibres existait conjointement à l’hyperactivation des régions fronto-limbiques au cours d’une tâche de reconnaissance émotionnelle chez ces mêmes patients bipolaires [
29] (Figure 4). Ces résultats soutiennent l’hypothèse de facteurs cérébraux anatomiques et fonctionnels d’hypersensibilité des régions impliquées dans le traitement des informations émotionnelles, persistant même lorsque le syndrome dépressif est résolu. Chez ces sujets apparemment « guéris », il pourrait donc s’agir de systèmes régionaux jouant un rôle dans la vulnérabilité dépressive et le risque de rechute.
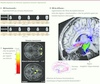 | Figure 4Dépression en rémission, activations et structure de la matière blanche. A. Hyperréactivité aux stimulus émotionnels. B. Chez des patients ayant une maladie bipolaire en rémission (patients « pharmaco-répondeurs »), nous avons détecté une élévation de la mesure des fibres par tractographie du faisceau unciné qui relie des régions impliquées dans la réponse au traitement (le cortex cingulaire subgénual et le complexe amygdalo-hippocampique) et des modifications ultrastructurales de la matière blanche (anisotropie frontale et cingulaire) [ 28]. C. Une hyperactivation de régions frontales et paralimbiques lors de stimulus émotionnels a été détectée en IRMf effectuée chez ces mêmes patients [ 29]. Le traitement de stimulus émotionnels a révélé des hyperactivations relatives des régions orbito-frontales, cingulaires, de l’insula, et des noyaux caudés. |
Vers une aide au pronostic thérapeutique Les modifications de l’activité régionale sous l’effet des traitements sont mesurables en imagerie. Ainsi, une normalisation des réponses limbiques à la présentation de visages est détectable chez les patients dépressifs unipolaires lorsqu’ils sont re-testés après traitement par antidépresseurs [
30,
31] ou psychothérapies [
32], et ce uniquement chez ceux dont le traitement est suivi d’une amélioration des symptômes. Perspective intéressante, l’activité régionale avant traitement pourrait présager de son efficacité - ouvrant une voie de recherche sur l’imagerie pronostique - et du choix thérapeutique en psychiatrie. Par exemple, les sujets dépressifs unipolaires ayant une forte réponse du cortex cingulaire antérieur aux stimulus émotionnels négatifs seraient ceux qui répondent le mieux aux traitements antidépresseurs [32] tandis que les sujets dont la réponse est faible et associée à une hyperactivité de l’amygdale répondraient mieux aux thérapies comportementales [
33]. Dans ce sens, des chercheurs de l’UMR 1000 ont montré, chez des sujets résistants aux médicaments antidépresseurs, que les images du métabolisme cérébral des régions frontales limbiques et amygdaliennes avant traitement permettent de distinguer les groupes ultérieurement répondeurs ou non répondeurs aux stimulations magnétiques transcrâniennes [18]. Cette voie de recherche est intéressante car l’imagerie en psychiatrie pourrait ainsi identifier des biomarqueurs ayant une valeur statistique prédictive au niveau individuel [
34]. |
Maladies mentales, (des)inhibition et modèle fronto-striatal L’incapacité à contrôler des pensées envahissantes ou à bloquer l’exécution de comportements répétitifs est une caractéristique que l’on retrouve dans plusieurs affections psychiatriques souvent comorbides telles que le syndrome de Gilles de la Tourette qui se manifeste par la production de tics moteurs et verbaux, les troubles obsessionnels compulsifs caractérisés par la présence de pensées obsessionnelles et de comportements compulsifs, et l’hyperactivité avec déficit attentionnel marqué par l’impulsivité et l’agitation motrice [
35]. Les données de l’imagerie ont démontré que ces trois troubles ont pour caractéristique commune la présence d’anomalies au sein d’un même système fronto-striatal, impliqué dans l’acquisition et l’élaboration des automatismes moteurs et jouant un rôle majeur dans la régulation comportementale. Ces affections sont en effet associées à des altérations morphologiques et fonctionnelles des cortex et noyaux gris appartenant à ce réseau (cortex frontal, striatum et thalamus), et pourraient provenir d’une dysmaturation de ce système qui, en rendant l’inhibition corticale insuffisante, entraînerait la mise en jeu de circuits striataux et de comportements involontaires. Les différences de phénotype (tics versus compulsions) qui existent entre ces maladies psychiatriques pourraient provenir de l’implication de sous-réseaux distincts. En effet, le système fronto-striatal est composé de cinq circuits fonctionnels impliquant chacun des territoires corticaux, striataux et thalamiques différents. Or les données d’imagerie ont montré que le syndrome de Gilles de la Tourette s’accompagne davantage d’anomalies impliquant les circuits moteur et prémoteur alors que les troubles obsessionnels compulsifs impliquent des perturbations des portions orbitaire et cingulaire du système [
36,
37]. Ces données soulignent que la similitude clinique qui existe entre certains symptômes psychopathologiques pourrait être sous-tendue par le dysfonctionnement de systèmes neuraux en partie communs associé à des mécanismes cognitifs déficients. Finalement, outre cette modélisation, les troubles obsessionnels compulsifs sont également marqués par la capacité des patients à résister ou pas aux rituels et autres compulsions qui, eux, engagent les interactions fronto-cingulo-pariétales, vecteur des fonctions d’attention sélective − working memory − contrôlant l’inhibition des représentations parvenant à la conscience [
38,
39]. |
L’analyse des modifications cérébrales induites par la consommation de drogues et les conséquences à long terme de l’intoxication ont validé certains modèles théoriques de l’addiction. Altérations de la maturation structurale à l’adolescence Concernant les effets délétères des substances, les études ont détecté de façon convergente des modifications cérébrales durables après leur consommation. Par exemple, des collaborateurs de l’UMR 1000 Inserm-CEA ont montré que les sujets alcoolo-dépendants sevrés, ayant une bonne insertion sociale, ont des diminutions marquées de la matière grise et de la matière blanche, corrélées à la dégradation de leurs performances, la gravité étant d’autant plus importante que la consommation d’alcool a commencé tôt à l’adolescence [
40,
41]. Comme la structure du cerveau varie beaucoup à l’adolescence, ceci suggère que la prise aiguë d’alcool altère directement la maturation cérébrale à cette période. Un modèle animal a d’ailleurs récemment montré que le binge drinking détruisait des cellules souches cérébrales, soulignant l’effet délétère durable de l’intoxication à cet âge et la nécessité de poursuivre les investigations chez l’homme. En santé publique, ces résultats motivent les campagnes de prévention à l’égard des jeunes [
42]. Dépendance, envie et attention Par ailleurs, l’exploration des effets des substances addictives sur les systèmes de neurotransmission, longtemps essentiellement réalisée chez l’animal, peut dorénavant être effectuée directement chez l’homme. Parmi les différents systèmes, les efforts se sont concentrés sur la dopamine dont il a été montré qu’elle est étroitement impliquée dans les systèmes de récompense et dans les comportements d’addiction. L’exploration des altérations des systèmes inhibiteurs est une voie commune à plusieurs affections psychiatriques. Ainsi, les interactions entre envie − craving − et attention ont été explorées en IRMf au cours de l’addiction au tabac. Il en ressort une désactivation de régions classiquement impliquées dans la dépendance au tabac (cingulum antérieur, amygdale, parahippocampe et striatum ventral) chez les fumeurs en situation de craving lorsqu’on leur présente des images évoquant le tabac tandis qu’ils réalisent une épreuve cognitive (Figure 5). Ces résultats peuvent refléter la tentative des sujets fumeurs à inhiber l’envie induite par les indices quand ils ont à réaliser une tâche attentionnelle. Ainsi, ce phénomène d’inhibition pourrait être utile à la recherche sur les thérapies de désensibilisation des fumeurs dépendants [
43].
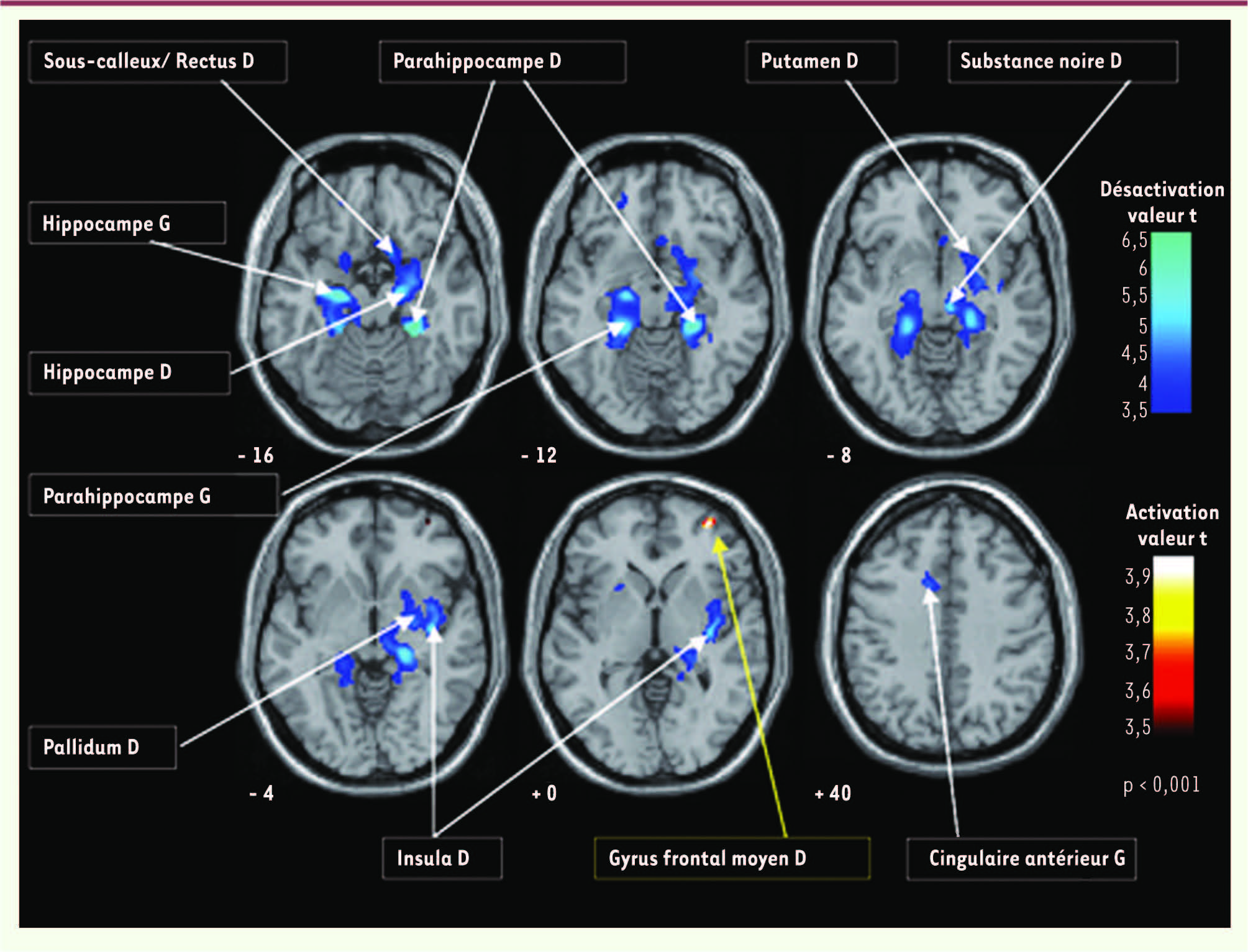
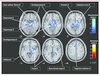 | Figure 5Hypoactivations régionales au cours d’une tâche attentionnelle effectuée par des sujets en situation de craving pour le tabac. Contrairement à ce qui était observé chez les témoins, ces régions se désactivaient pendant que les sujets dépendants effectuaient correctement la tâche. Ces régions paralimbiques sont souvent associées au système dit « de récompense » ou du plaisir [ 43]. |
|
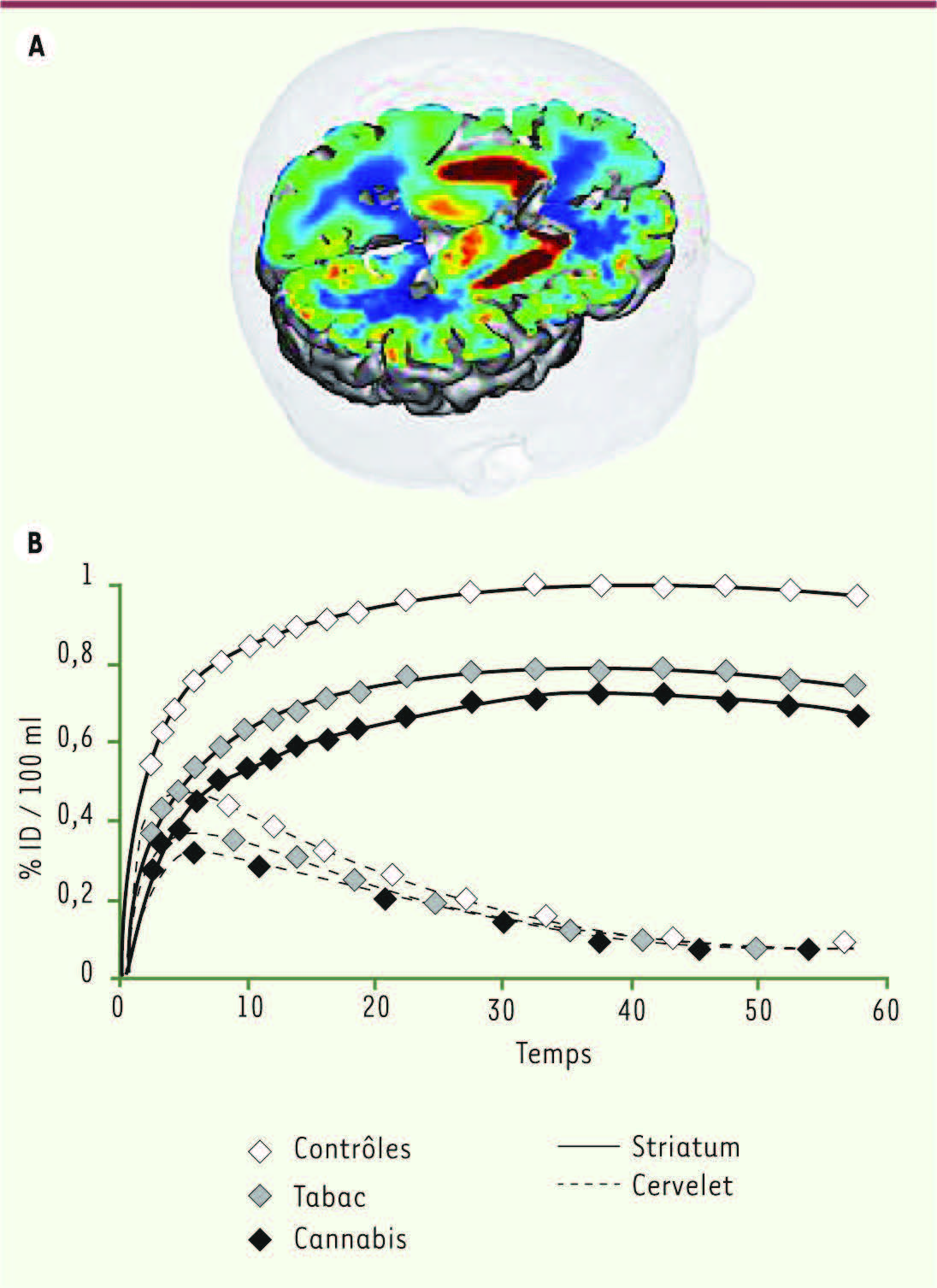
Les études d’imagerie ont permis d’étendre à l’homme les données obtenues chez l’animal en confirmant le lien entre consommation de drogues et variations des mesures dopaminergiques. Par exemple, les niveaux du transporteur de la dopamine sont diminués d’environ 20 % chez les fumeurs de tabac et de 25 % chez les fumeurs de cannabis, confirmant in vivo la dysrégulation de la dopamine dans ces deux dépendances [
44] (Figure 6). Cette approche a également précisé la relation entre la libération de dopamine dans le striatum et les effets ressentis par les sujets en montrant que c’est lorsque la concentration dopaminergique est la plus élevée que les effets subjectifs high (euphorie) sont les plus importants [
45]. Finalement, les résultats issus de l’imagerie ont permis de progresser dans la compréhension des phénomènes de rechute. L’une des hypothèses à ce sujet est que les drogues, en provoquant une libération de dopamine, entraîneraient un conditionnement de type pavlovien. Ainsi, tout stimulus associé à la prise de substance deviendrait lui-même un signal qui aurait à son tour la capacité d’augmenter la libération de dopamine et de déclencher un comportement de recherche de drogue. Cela expliquerait la rechute des sujets après sevrage dès lors qu’ils sont exposés à ces signaux conditionnés. Des études ont confirmé cette hypothèse en révélant que chez les personnes dépendantes à la cocaïne, tout signal lié à la drogue augmente les taux de dopamine striatale, et que ce phénomène est couplé à une sensation de manque [
46].
 | Figure 6Mesure du transporteur de la dopamine en tomographie à positons au C 11-PE2I. A. Les couleurs chaudes montrent la répartition intracérébrale du radioligand du transporteur de la dopamine. B. Diminution du transporteur de la dopamine (approximativement - 20 %) chez des sujets dépendants au tabac et au cannabis; le cervelet, où le radioligand ne se fixe quasiment pas, sert de région de référence pour la quantification [ 44]. |
|
Les récepteurs dopaminergiques, un facteur commun de dépendance ? Chez les sujets dépendants à l’alcool, à la cocaïne, à l’héroïne et à la methamphétamine, le nombre des récepteurs D2 mesurés en tomographie à positons dans le striatum est diminué, anomalie qui persiste plusieurs mois après la désintoxication. Cette découverte, jointe à d’autres arguments [
47], a conduit à formuler l’hypothèse qu’un faible taux de récepteurs D2, quelles qu’en soient les raisons, constituerait un facteur de vulnérabilité à la dépendance. En raison d’un équipement plus pauvre en récepteurs dopaminergiques, les sujets éprouveraient des difficultés à ressentir du plaisir, ce qui les rendraient plus susceptibles de répéter l’euphorie provoquée par la libération massive de dopamine consécutive à la consommation de drogues [
48]. |
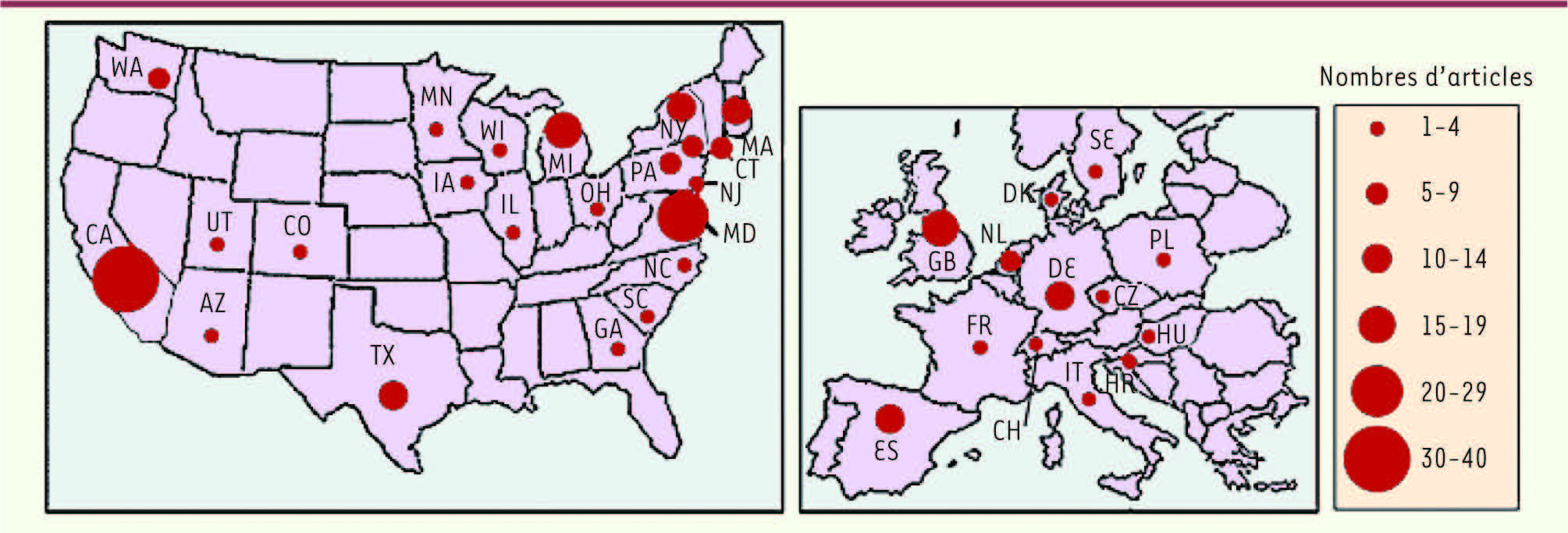
L’imagerie en pédopsychiatrie La mise en évidence chez des patients adultes de modifications du cerveau dans pratiquement toutes les maladies mentales a posé la question de l’interaction des affections psychiatriques et des addictions avec le développement du cerveau. Si l’apparition de ces modifications est effectivement précoce, quelle qu’en soit la cause, ces pathologies ne risquent-elles pas de s’inscrire durablement dans l’architecture cérébrale au cours du développement ? Ainsi, la compréhension de la mise en place de ces anomalies cérébrales pourrait contribuer à des campagnes de prévention mieux ciblées, par exemple contre les addictions, en fonction de critères objectifs. Les études d’imagerie chez les enfants ou adolescents atteints de troubles psychiatriques se sont par conséquent nettement développées ces dernières années et représentent un domaine de recherche croissant. Ainsi, le nombre d’études réalisées a doublé entre 2005 et 2008 [
49], ces études étant en majorité menées aux États-Unis (61 % des articles publiés) (Figure 7). Elles ont essentiellement porté sur l’hyperactivité et l’autisme (47 % des études). La dépression, dont la prévalence est pourtant forte et qui est une cause de mortalité majeure (suicides), n’est encore que très peu étudiée en imagerie, et insuffisamment prise en charge [
50,
51].
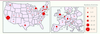 | Figure 7Répartition géographique des études d’imagerie chez les enfants ou adolescents atteints de troubles psychiatriques. Les cercles indiquent les états ou pays qui ont publié des articles de neuro-imagerie sur les troubles mentaux chez l’enfant ou l’adolescent au cours de la période 2005-2008. Les diamètres des points sur les cartes sont proportionnels au nombre d’articles [ 49]. |
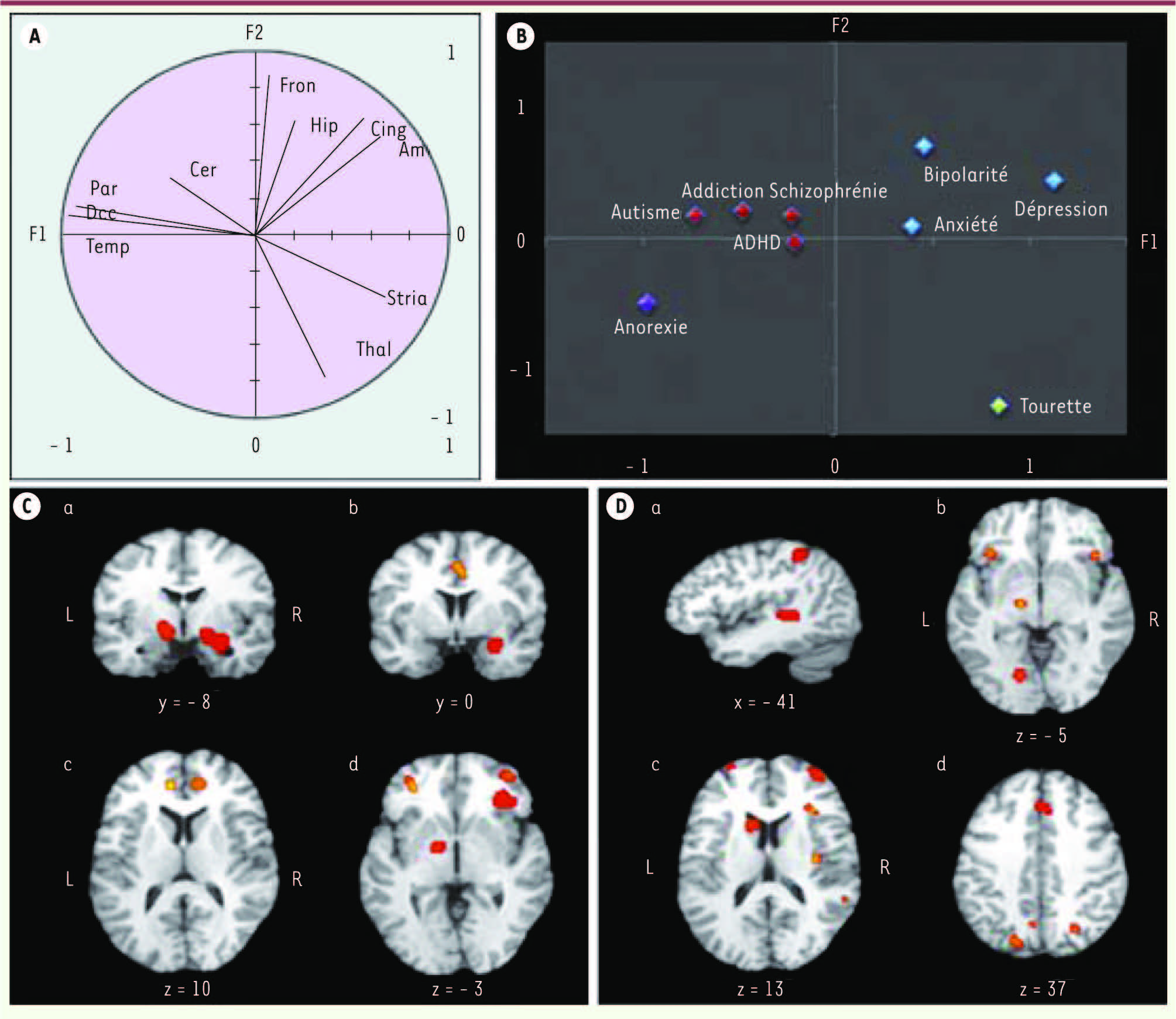
Aspect transnosographique des altérations cérébrales en pédopsychiatrie Une analyse en composantes principales a regroupé les troubles mentaux en fonction des régions cérébrales où des altérations structurales et/ou fonctionnelles ont été observées quelle que soit la méthode d’imagerie utilisée [ 49]. Cette approche a isolé trois groupes (Figure 8). Les troubles affectifs (anxiété, dépression majeure, trouble bipolaire) caractérisés par des altérations fronto-limbiques, les troubles comportant des distorsions cognitives marquées (autisme, schizophrénie, hyperactivité, anorexie et addiction) associées à des altérations des cortex associatifs postérieurs et frontaux, et un trouble moteur, le syndrome de Gilles de la Tourette associé aux noyaux gris centraux [
52]. Le fait que l’hyperactivité ne soit pas groupée avec ce dernier s’explique par l’intérêt porté au cours de ces dernières années à l’étude des troubles attentionnels qui marquent cette maladie et qui, eux, impliquent une perturbation du système fronto-pariétal.
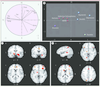 | Figure 8Méta-analyse de 270 articles d’imagerie en pédopsychiatrie. En haut (A, B), analyse en composantes principales : le graphique B représente la dispersion des troubles mentaux, selon les deux principaux facteurs (F1 et F2 en A). La proximité entre les troubles représente leurs similitudes, en fonction de la localisation des altérations cérébrales selon les articles, qu’elles soient anatomiques ou fonctionnelles. Cette méta-analyse valide une distinction entre (1) les troubles psychoaffectifs (en bleu), (2) les troubles s’accompagnant de distorsions cognitives (en rouge ou violet), (3) les troubles où la composante motrice est majeure (en vert), engageant les noyaux gris centraux. ADHD : déficit d’attention avec hyperactivité; Amy : amygdales; Cing : cortex cingulaire; Fron : cortex frontal; Hip : hippocampe; Occ : cortex occipital; Par : cortex pariétal; Stria : striatum; Temp : cortex temporal; Thal : thalamus. En bas (C, D) : méta-analyse des coordonnées de Talairach des altérations anatomiques ou fonctionnelles rapportées dans les articles. C. Les troubles affectifs engagent des épicentres fronto-limbiques. D. Les troubles mentaux s’accompagnant de distorsions cognitives engagent les cortex associatifs antérieurs et postérieurs [ 49]. |
En définitive, la plupart des altérations régionales et systémiques qui ont été observées chez l’adulte sont aussi retrouvées chez l’enfant ou l’adolescent, avec des variations suggérant que la majorité de ces altérations apparaissent de façon précoce. Elles précèdent parfois l’émergence de la maladie et constitueraient des facteurs de risque. C’est pourquoi des investigations longitudinales sont en cours [
53]. |
Au cours des deux dernières décennies, l’imagerie a contribué à faire évoluer nos connaissances et à élaborer de nouveaux modèles des troubles mentaux. Ainsi, les maladies psychiatriques caractérisées sont toutes associées à des déviations statistiques de la structure et/ou du fonctionnement du cerveau, parfois dès l’enfance ou l’adolescence. Par son caractère non invasif, l’imagerie apporte enfin à la pédopsychiatrie le moyen d’appréhender la physiopathologie des troubles psychiques au cours du développement. D’autre part, la synthèse des données acquises souligne l’implication de réseaux neuraux propres à chaque affection, ou communs à plusieurs d’entre elles dès lors qu’elles présentent des similitudes cliniques ou cognitives et des phénomènes de comorbidité. Nous avons là également, à notre portée, une méthodologie pour affiner nos connaissances sur l’efficacité des traitements, fournir des informations utiles pour la logique de prescription, générer des modèles sources d’innovations thérapeutiques et aider au pronostic et à la prévention. À côté de leur intérêt en recherche, ces découvertes contribuent à changer le regard porté sur ces affections et à déstigmatiser les patients et leur famille, et ainsi, modifient aussi les prises en charge. ‡ |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Cachia
A
,
Paillère-Martinot
ML
,
Galinowski
A
, et al.
Cortical folding abnormalities in schizophrenia patients with resistant auditory hallucinations . Neuroimage.
2008; ; 39 : :927.-935. 2.
Paillère-Martinot
M
,
Caclin
A
,
Artiges
E
, et al.
Cerebral gray and white matter reductions and clinical correlates in patients with early onset schizophrenia . Shizophr res.
2001; ; 50 : :19.-26. 3.
Penttilä
J
,
Paillère-Martinot
ML
,
Martinot
JL
, et al.
Global and temporal cortical folding in patients with early-onset schizophrenia . J Am Acad Child Adolesc Psychiatry.
2008; ; 47 : :1125.-1132. 4.
Wright
IC
,
Rabe-hesketh
S
,
Woodruff
P
, et al.
Meta-analysis of regional brain volumes in schizophrenia . Am J Psychiatry.
2000; ; 157 : :16.-25. 5.
Thompson
PM
,
Vidal
C
,
Giedd
JN
, et al.
Mapping adolescent brain change reveals dynamic wave of accelerated gray matter loss in very early-onset schizophrenia . Proc Natl Acad Sci USA.
2001; ; 98 : :11650.-11655. 6.
Vidal
CN
,
Rapoport
JL
,
Hayashi
KM
, et al.
Dynamically spreading frontal and cingulate deficits mapped in adolescents with schizophrenia . Arch Gen Psychiatry.
2006; ; 63 : :25.-34. 7.
Artiges
E
,
Martinot
JL
,
Verdys
M
, et al.
Altered hemispheric functional dominance during word generation in negative schizophrenia . Schizophr Bull.
2000; ; 26 : :709.-721. 8.
Dehaene
S
,
Artiges
E
,
Naccache
L
, et al.
Conscious and subliminal conflicts in normal subjects and patients with schizophrenia: the role of the anterior cingulate . Proc Natl Acad Sci USA.
2003; ; 100 : :13722.-13727. 9.
Huret
JD
,
Mazoyer
BM
,
Lesur
A
, et al.
Cortical metabolic patterns in schizophrenia: a mismatch with the positive-negative paradigm . European Psychiatry.
1991; ; 6 : :7.-19. 10.
Silbersweig
DA
,
Stern
E
,
Frith
CD
, et al.
A functional neuroanatomy of hallucinations in schizophrenia . Nature.
1995; ; 378 : :176.-179. 11.
Weiss
AP
,
Heckers
S
. Neuroimaging of hallucinations: a review of the literature . Psychiatry Res.
1999; ; 92 : :61.-74. 12.
Plaze
M
,
Paillère-Martinot
ML
,
Penttilä
J
, et al.
«Where do auditory hallucinations come from?»–A brain morphometry study of pchizophrenia patients with inner or outer space hallucinations . Schizophr Bull.
2011; ; 37 : :212.-221. 13.
Zhang
Z
,
Shi
J
,
Yuan
Y
, et al.
Relationship of auditory verbal hallucinations with cerebral asymmetry in patients with schizophrenia: an event-related fMRI study . J Psychiatr Res.
2008; ; 42 : :477.-486. 14.
Hubl
D
,
Koenig
T
,
Strik
W
, et al.
Pathways that make voices: white matter changes in auditory hallucinations . Arch Gen Psychiatry.
2004; ; 61 : :658.-668. 15.
Hoffman
RE
,
Hawkins
KA
,
Gueorguieva
R
, et al.
Transcranial magnetic stimulation of left temporoparietal cortex and medication-resistant auditory hallucinations . Arch GenPsychiatry.
2003; ; 60 : :49.-56. 16.
Aleman
A
,
Sommer
IE
,
Kahn
RS
. Efficacy of slow repetitive transcranial magnetic stimulation in the treatment of resistant auditory hallucinations in schizophrenia: a meta-analysis . J Clin Psychiatry.
2007; ; 68 : :416.-421. 17.
Tranulis
C
,
Sepehry
AA
,
Galinowski
A
,
Stip
E
. Should we treat auditory hallucinations with repetitive transcranial magnetic stimulation? A metaanalysis . Can J Psychiatry.
2008; ; 53 : :577.-586. 18.
Paillère Martinot
ML
,
Galinowski
A
,
Ringuenet
D
, et al.
Influence of prefrontal target region on the efficacy of repetitive transcranial magnetic stimulation in patients with medication-resistant depression: a [(18)F]-fluorodeoxyglucose PET and MRI study . Int J Neuropsychopharmacol.
2010; ; 13 : :45.-59. 19.
Xiberas
X
,
Martinot
JL
,
Mallet
L
, et al.
Extrastriatal and striatal D (2) dopamine receptor blockade with haloperidol or new antipsychotic drugs in patients with schizophrenia . Br J Psychiatry.
2001; ; 179 : :503.-508. 20.
Xiberas
X
,
Martinot
JL
,
Mallet
L
, et al.
In vivo extrastriatal and striatal D2 dopamine receptor blockade by amisulpride in schizophrenia . J Clin Psychopharmacol.
2001; ; 21 : :207.-214. 21.
Haldane
M
,
Frangou
S
. Functional neuroimaging studies in mood disorders . Acta Neuropsychiatrica.
2006; ; 18 : :88.-99. 22.
Martinot
JL
,
Hardy
P
,
Feline
A
, et al.
Left prefrontal glucose hypometabolism in the depressed state: a confirmation . Am J Psychiatry.
1990; ; 147 : :1313.-1317. 23.
Thomas
EJ
,
Elliot
R
. Brain imaging correlates of cognitive impairment in depression . Front Hum Neurosci.
2009; ; 3 : :1.-9. 24.
Matthews
SC
,
Strigo
IA
,
Simmons
AN
, et al.
Decreased functional coupling of the amygdala and supragenual cingulate is related to increased depression in unmedicated individuals with current major depressive disorder . J Affect Disord.
2008; ; 111 : :13.-20. 25.
Bragulat
V
,
Paillère-Martinot
ML
,
Artiges
E
, et al.
Dopaminergic function in depressed patients with affective flattening or with impulsivity: [18F]fluoro-L-dopa positron emission tomography study with voxel-based analysis . Psychiatry Res.
2007; ; 154 : :115.-124. 26.
Rainer
Q
,
Gardier
AM
,
Hen
R
,
David
D
. Mécanismes des effets comportementaux de type anxiolytique/antidépresseur de la fluoxétine (Prozac®) : implication de la neurogenèse hippocampique . Med/Sci (Paris).
2009; ; 25 : :795.-798. 27.
Sandu
AL
,
Artiges
E
,
Lemaitre
H
, et al.
VBM in patients with treatment-resistant depression using standard, new segmentation and DARTEL. Communication to the 16th annual meeting of the organization for human brain mapping. , Barcelone: , 6-10 juin.
2010. 28.
Wessa
M
,
Houenou
J
,
Leboyer
M
, et al.
Microstructural white matter changes in euthymic bipolar patients: a whole-brain diffusion tensor imaging study . Bipolar Disord.
2009; ; 11 : :504.-514. 29.
Wessa
M
,
Houenou
J
,
Paillère-Martinot
ML
, et al.
Increased frontal-striatal activation during response inhibition to emotional faces in euthymic bipolar disorder . Am J Psychiatry.
2007; ; 164 : :638.-646. 30.
Fu
CH
,
Williams
SC
,
Brammer
MJ
, et al.
Neural responses to happy facial expressions in major depression following anti-depressant treatment . Am J Psychiatry.
2007; ; 164 : :599.-607. 31.
Sheline
YI
,
Barch
DM
,
Donnelly
JM
, et al.
Increased amygdala response to masked emotional faces in depressed subjects resolves with antidepressant treatment: an fMRI study . Biol Psychiatry.
2001; ; 50 : :651.-658. 32.
Fu
CH
,
Williams
SC
,
Cleare
AJ
, et al.
Neural responses to sad facial expressions in major depression following cognitive behavioral therapy . Biol Psychiatry.
2008; ; 64 : :505.-512. 33.
Siegle
GJ
,
Carter
CS
,
Thase
ME
. Use of fMRI to predict recovery from unipolar depression with cognitive behavior therapy . Am J Psychiatry.
2006; ; 163 : :735.-737. 34.
Duchesnay
E
,
Cachia
A
,
Roche
A
, et al.
Classification based on cortical folding patterns . IEEE Trans Med Imaging.
2007; ; 26 : :553.-565. 35.
Purper-Ouakil
D
,
Lepagnol-Bestel
AM
,
Grosbellet
E
, et al.
Neurobiologie du trouble déficit de l’attention/hyperactivité . Med Sci (Paris).
2010; ; 26 : :487.-496. 36.
Kerstin
J
,
Plessen
MD
,
Jason
M
, et al.
Neuroimaging of tic disorders with co-existing attention-deficit/hyperactivity disorder . Eur Child Adolesc Psychiatry.
2007; ; 16 : :60.-70. 37.
Marsh
R
,
Maia
TV
,
Peterson
BS
. Functional disturbances within frontostriatal circuits across multiple childhood psychopathologies . Am J Psychiatry.
2009; ; 166 : (6)
:664.-674. 38.
Martinot
JL
,
Allilaire
JF
,
Mazoyer
BM
, et al.
Obsessive-compulsive disorder: a clinical, neuropsychological and positron emission tomography study . Acta Psychiatr Scand.
1990; ; 82 : :233.-242. 39.
Viard
A
,
Flament
MF
,
Artiges
E
, et al.
Cognitive control in childhood-onset obsessive-compulsive disorder: a functional MRI study . Psychol Med.
2005; ; 35 : :1007.-1017. 40.
Chanraud
S
,
Martelli
C
,
Delain
F
, et al.
Brain morphometry and cognitive performance in detoxified alcohol-dependents with preserved psychosocial functioning . Neuropsychopharmacology.
2007; ; 32 : :429.-438. 41.
Chanraud
S
,
Reynaud
M
,
Wessa
M
, et al.
Diffusion tensor tractography in mesencephalic bundles: relation to executive dysfunction in detoxified alcohol-dependent subjects . Neuropsychopharmacology.
2009; ; 34 : :1223.-1232. 42.
Beck
F
,
Godeau
E
,
Legleye
S
,
Spilka
S
. Les usages de drogues des plus jeunes adolescents. 1. Données épidémiologiques . Med Sci (Paris).
2007; ; 23 : :1162.-1168. 43.
Artiges
E
,
Ricalens
E
,
Berthoz
S
, et al.
Exposure to smoking cues during an emotion recognition task can modulate limbic fMRI activation in cigarette smokers . Addict Biol.
2009; ; 14 : :469.-477. 44.
Leroy
C
,
Karila
L
,
Martinot
JL
, et al.
Striatal and extrastriatal dopamine transporter in cannabis and tobacco addiction: a high-resolution PET study . Addiction Biology.
2011 ; sous presse.. 45.
Volkow
ND
,
Wang
GJ
,
Fischman
MW
, et al.
Relationship between subjective effects of cocaine and dopamine transporter occupancy . Nature.
1997; ; 386 : :827.-830. 46.
Wong
DF
,
Kuwabara
H
,
Schretlen
DJ
, et al.
Increased occupancy of dopamine receptors in human striatum during cue-elicited cocaine craving . Neuropsychopharmacology.
2006; ; 31 : :2716.-2727. 47.
Thibault
D
,
Kortleven
C
,
Fasano
C
, et al.
Découvertes récentes sur la fonction et la plasticité des voies dopaminergiques du cerveau . Med/Sci (Paris).
2010; ; 26 : :165.-170. 48.
Volkow
ND
,
Fowler
JS
,
Wang
GJ
, et al.
Imaging dopamine’s role in drug abuse and addiction . Neuropharmacology.
2009; ; 56 : :3.-8. 49.
Mana
S
,
Paillère
ML
,
Martinot
JL
. Brain imaging findings in children and adolescents with mental disorders: A cross-sectional review . Eur Psychiatry.
2010; ; 25 : :345.-354. 50.
Carmichael
M
. Healthy at any age . Newsweek.
2010; ; 5 : :54.-65. 51.
Meschan Foy
J
. For the american academy of pediatrics task force on mental health. Introduction . Pediatrics.
2010; ; 125 : :S69.-S74. 52.
Marsh
R
,
Maia
TV
,
Peterson
BS
. Functional disturbances within frontostriatal circuits across Multiple childhood psychopathologies . Am J Psychiatry.
2009; ; 166 : :664.-674. 53.
Paus
T
. Population neuroscience: why and how . Hum Brain Mapp.
2010; ; 31 : :891.-903. 54.
Paillère-Martinot
ML
,
Bragulat
V
,
Artiges
E
, et al.
Decreased presynaptic dopamine function in the left caudate of depressed patients with affective flattening and psychomotor retardation . Am J Psychiatry.
2001; ; 158 : :314.-316. |