| |
| Med Sci (Paris). 2011 October; 27(10): 802–804. Published online 2011 October 21. doi: 10.1051/medsci/20112710003.L’occasion fait la connexion La migration cellulaire dans l’évolution du néocortex Franck Bielle1,2 and Sonia Garel1,2* 1École normale supérieure, Institut de biologie de l’ENS, IBENS, 46, rue d’Ulm, 75230Paris Cedex 05, France 2Inserm, U1024, équipe avenir; CNRS, UMR 8197, Paris, France MeSH keywords: Animaux, Axones, physiologie, Évolution biologique, Lignage cellulaire, Mouvement cellulaire, Régulation de l'expression des gènes au cours du développement, Humains, Mammifères, anatomie et histologie , embryologie, croissance et développement, Morphogenèse, Néocortex, cytologie, Neurones, Vertébrés |
Le néocortex constitue chez tous les mammifères une large partie du cerveau qui est essentielle à la perception de l’environnement, à l’élaboration de réponses motrices aux stimulus externes, ainsi qu’aux fonctions cognitives. L’architecture du néocortex et sa connectivité commencent à se mettre en place au cours du développement embryonnaire, permettant ainsi aux nouveau-nés d’appréhender leur environnement sensoriel. Comment cette structure complexe se forme au cours de l’embryogenèse est devenu une question centrale car il a été montré que des anomalies de développement sont associées à diverses pathologies humaines qui incluent le retard mental, la schizophrénie, l’épilepsie ou encore l’autisme. Par ailleurs, si le néocortex joue un rôle essentiel dans le fonctionnement de notre cerveau, il est unique aux mammifères. Comment le néocortex est-il apparu au cours de l’évolution des vertébrés reste encore largement mystérieux. |
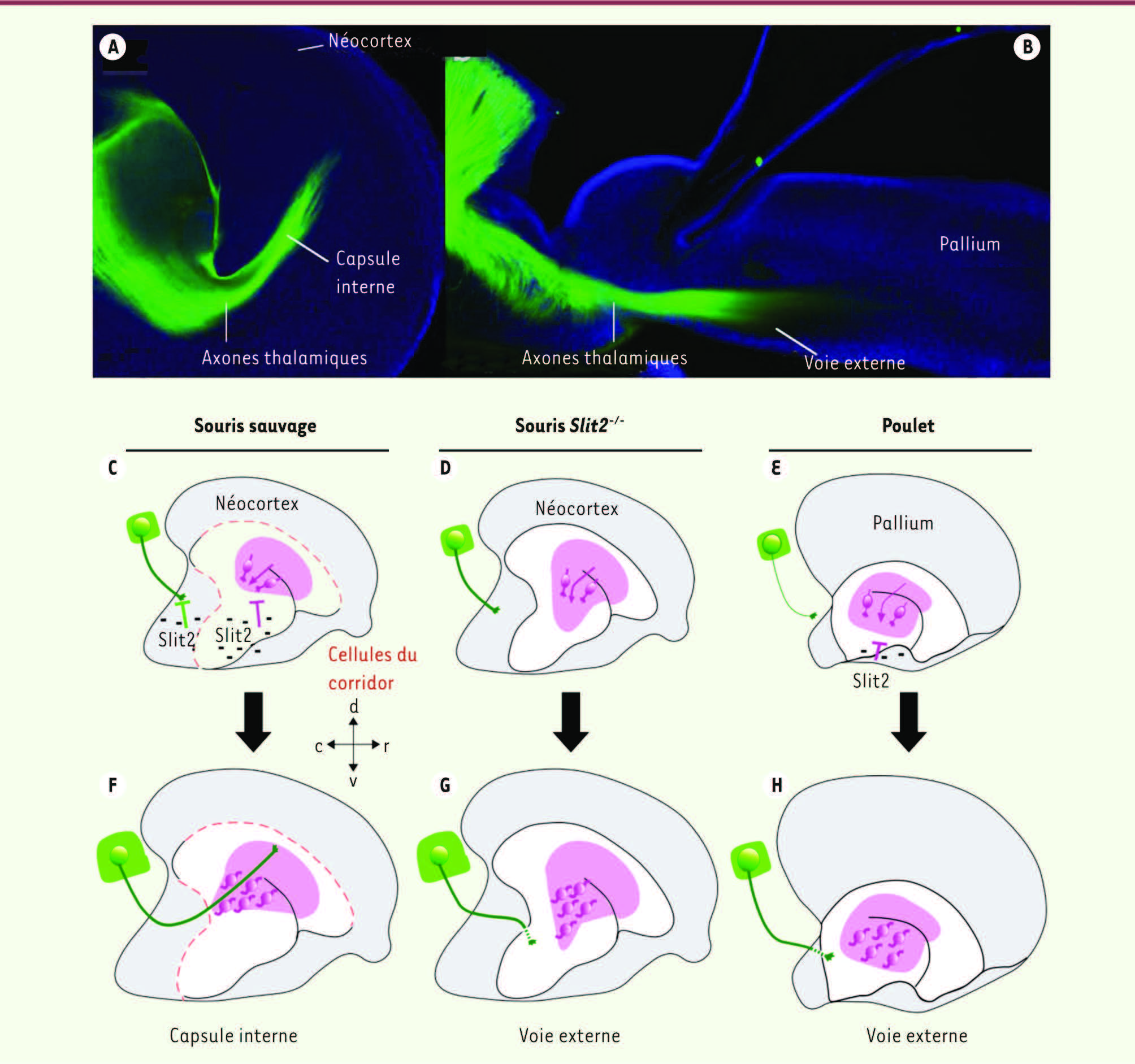
Le néocortex : une architecture et un patron de connexions élaborés Le fonctionnement du néocortex repose sur des réseaux neuronaux locaux dont l’architecture en six couches se met en place au cours du développement embryonnaire. Il repose également sur l’existence de connexions massives avec le reste du cerveau et de la moelle épinière. En particulier, une grande partie de l’information sensorielle (vision, audition, toucher, goût) est relayée au néocortex par un large faisceau de projections axonales générées par le thalamus dorsal. Ces projections thalamiques constituent donc une afférence essentielle au néocortex et l’atteignent en suivant une voie en profondeur du cerveau dénommée la « capsule interne » : les axones thalamiques, d’abord étroitement assemblés, divergent en éventail, permettant une connexion à toute la surface corticale et adressant ainsi différentes informations sensorielles vers des aires corticales spécifiquement dédiées à leur traitement
(Figure 1A , F)
[
11].
 | Figure 1
La trajectoire interne des axones thalamiques mammifères est déterminée par le positionnement spécifique de cellules « guides ». A. Les axones thalamiques sont visualisés dans la capsule interne après traçage antérograde chez l’embryon de souris. B. La trajectoire externe des axones thalamiques est mise en évidence par immunofluorescence chez l’embryon de poulet. C-E. À un stade embryonnaire précoce, le positionnement des cellules « guides » (cellules roses) diffère entre l’embryon de souris et de poulet et est contrôlé par l’effet répulsif de Slit2 (signes moins) sur leur migration (flèches violettes). Chez l’embryon de souris Slit2
-/-
, les cellules « guides » ont un positionnement anormal. F. À un stade ultérieur, les axones thalamiques (en vert) rencontrent les cellules « guides » qui les dirigent dans la capsule interne chez l’embryon de souris normal. G-H. Au contraire, les axones thalamiques ne peuvent entrer en contact avec les cellules « guides » chez l’embryon de souris Slit2
-/-
ou de poulet et empruntent une trajectoire externe. c : caudal; d : dorsal; r : rostral; v : ventral. |
|
L’apparition du néocortex : facteurs intrinsèques et extrinsèques L’apparition du néocortex au cours de l’évolution des vertébrés et son expansion massive chez certains mammifères comme les primates ont requis des changements intrinsèques de prolifération cellulaire et de migration neuronale qui contrôlent la formation d’une architecture en six couches. Par ailleurs et de façon extrinsèque, l’émergence fonctionnelle du néocortex est associée à la formation d’afférences thalamiques massives et d’une trajectoire interne spécifique aux mammifères
(Figure 1A)
. En effet, chez tous les autres vertébrés dépourvus de néocortex, les afférences thalamiques empruntent une voie externe et se destinent soit à des cortex dotés de moins de couches, soit à des noyaux
(Figure 1B)
. Cette dernière organisation correspond à celle de l’ancêtre commun des vertébrés. Les projections thalamiques se sont donc modifiées dans la lignée évolutive des mammifères, d’une voie externe vers une voie interne, de manière à connecter le néocortex. Comment est apparu ce changement extrinsèque qui a sans doute favorisé le succès évolutif du néocortex, reste largement inconnu. En utilisant le modèle expérimental de l’embryon de souris, notre équipe avait précédemment montré que le guidage interne des axones thalamiques requiert, en plus des activités et molécules déjà impliquées ([
1] et pour revue [
2]), la formation d’un corridor permissif construit par une migration de neurones dénommés de ce fait « cellules du corridor »
(Figure 1C)
[
3]. Cette découverte ouvrait la perspective que les cellules « guides » du corridor puissent être impliquées dans la différence de trajectoire des axones thalamiques entre les mammifères et les autres vertébrés. Dans des travaux récemment publiés [
4], nous avons étudié cette hypothèse en analysant les mécanismes contrôlant la trajectoire des axones thalamiques chez différentes espèces de mammifères, reptiles et oiseaux vivants. |
La migration de neurones « guides » : un facteur d’évolution de la connectivité corticale En examinant l’expression de gènes homologues, nous avons montré que des cellules du corridor sont conservées en position interne chez d’autres mammifères que la souris, dont l’homme, mais aussi chez d’autres vertébrés : chez les oiseaux et reptiles, les cellules du corridor sont présentes en position interne mais ne guident pas les axones thalamiques qui suivent une trajectoire externe
(Figure 1E)
. En utilisant le modèle expérimental de l’embryon de poulet, nous avons révélé que les cellules du corridor chez cette espèce possèdent la capacité de guider les axones thalamiques en position interne, mais ne le font pas in vivo. Comment expliquer ce paradoxe ? En réalisant une étude détaillée de la position des cellules du corridor, nous avons observé que chez le poulet, celles-ci migrent différemment de chez la souris et leur position finale ne permet pas de contact avec les axones thalamiques, qui empruntent une trajectoire externe. À la recherche d’acteurs moléculaires contrôlant ce positionnement, nous avons identifié le gène Slit2 qui est exprimé dans une région adjacente au corridor de façon plus étendue chez la souris que chez le poulet. La protéine sécrétée Slit2 est connue pour son rôle dans le guidage de la migration cellulaire et de la pousse axonale [
5–
9] et exerce une répulsion sur les axones thalamiques chez la souris [5,
6,
8]. Par des expériences de cultures organotypiques et in vitro, d’électroporation in ovo et d’invalidation génétique, nous avons montré que Slit2 a une activité répulsive sur la migration des cellules du corridor et contrôle leur positionnement chez les embryons de souris et de poulet
(Figure 1C-E)
. Les différences de profils d’expression de Slit2 pourraient ainsi participer à la différence de positionnement des cellules du corridor par rapport aux axones thalamiques entre les deux espèces. En effet, en combinant des expériences de greffes en cultures organotypiques dans des embryons de souris sauvages et mutants pour Slit2, nous avons établi que Slit2 contrôle la rencontre des cellules du corridor avec les axones thalamiques et ainsi le passage des axones dans la capsule interne
(Figure 1F-H)
[4]. Nos données montrent qu’un changement subtil à petite échelle dans une migration cellulaire située sur le trajet des axones peut avoir des conséquences importantes sur l’organisation de projections axonales à longue distance dans le cerveau. L’effet de Slit2 sur les cellules du corridor agit ainsi comme un aiguillage permettant de diriger les axones thalamiques dans la capsule interne, une voie courte vers le néocortex, plutôt que dans une voie par défaut, externe, vers les régions ventrales du cerveau. Ces résultats révèlent que la migration cellulaire, en plus de sa fonction de positionnement des neurones au sein des circuits, agit également comme un acteur dynamique dans la formation des connexions nerveuses. En outre, ce mécanisme permet de proposer un scénario évolutif de l’apparition du néocortex mammifère et de ses connexions. La conservation des cellules du corridor chez les reptiles et oiseaux indique qu’elles possèdent une autre fonction que le guidage des axones thalamiques et qu’elles existaient chez l’ancêtre commun des mammifères, oiseaux et reptiles. Cependant, dans la lignée des mammifères, un nouveau positionnement des cellules du corridor a permis de manière opportuniste de rediriger les axones thalamiques vers le territoire où est apparu le néocortex. Enfin notre étude sur la capsule interne et d’autres études sur le corps calleux (pour revue [
10]), deux faisceaux propres aux mammifères, ouvrent la voie d’une meilleure compréhension des défauts du développement cérébral. Elles montrent que des défauts de migration neuronale peuvent causer des défauts de guidage axonal et pourraient permettre de démêler l’écheveau de pathologies altérant la connectivité cérébrale. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Metin
C
,
Godement
P.
The ganglionic eminence may be an intermediate target for corticofugal and thalamocortical axons . J Neurosci.
1996; ; 16 : :3219.–3235. 2.
Lopez-Bendito
G
,
Molnar
Z.
Thalamocortical development: how are we going to get there?
Nat Rev Neurosci.
2003; ; 4 : :276.–289. 3.
Lopez-Bendito
G
,
Cautinat
A
,
Sanchez
JA
, et al.
Tangential neuronal migration controls axon guidance: a role for neuregulin-1 in thalamocortical axon navigation . Cell.
2006; ; 125 : :127.–142. 4.
Bielle
F
,
Marcos-Mondejar
P
,
Keita
M
, et al.
Slit2 activity in the migration of guidepost neurons shapes thalamic projections during development and evolution . neuron.
2011; ; 69 : :1085.–1098. 5.
Bagri
A
,
Marin
O
,
Plump
AS
, et al.
Slit proteins prevent midline crossing and determine the dorsoventral position of major axonal pathways in the mammalian forebrain . Neuron.
2002; ; 33 : :233.–248. 6.
Braisted
JE
,
Ringstedt
T
,
O’Leary
DD
, Slits are chemorepellents endogenous to hypothalamus steer thalamocortical axons into ventral telencephalon.
Cereb Cortex.
2009; ; 19 ((suppl 1)) : :i144.–i151. 7.
Brose
K
,
Bland
KS
,
Wang
KH
, et al.
Slit proteins bind Robo receptors and have an evolutionarily conserved role in repulsive axon guidance . Cell.
1999; ; 96 : :795.–806. 8.
Lopez-Bendito
G
,
Flames
N
,
Ma
L
, et al.
Robo1 and Robo2 cooperate to control the guidance of major axonal tracts in the mammalian forebrain . J Neurosci.
2007; ; 27 : :3395.–3407. 9.
Nguyen Ba-Charvet
KT
,
Brose
K
,
Marillat
V
, et al.
Slit2-Mediated chemorepulsion and collapse of developing forebrain axons . Neuron.
1999; ; 22 : :463.–473. 10.
Chedotal
A.
Further tales of the midline . Curr Opin Neurobiol.
2011; ; 21 : :68.–75. 11.
Lepousez
G
,
Gheusi
G..
Olfaction : quand le cortex redistribue les cartes . Med Sci (Paris).
2011; ; 27 : :687.–689. |