| |
| Med Sci (Paris). 2011 October; 27(10): 817–819. Published online 2011 October 21. doi: 10.1051/medsci/20112710008.Quand CRAF remplace BRAF dans le mélanome Nicolas Dumaz,1* Martine Bagot,1 and Armand Bensussan1 1Inserm U976 ; Université Paris Diderot, Sorbonne Paris Cité, UMR-S-976 ; Service de dermatologie, Institut de recherche sur la peau, Hôpital Saint-Louis, pavillon Bazin, 1, avenue Claude Vellefaux, 75010Paris, France. MeSH keywords: Animaux, Anticorps monoclonaux, usage thérapeutique, Antigène CTLA-4, antagonistes et inhibiteurs , Humains, Immunothérapie, Mélanome, secondaire, thérapie |
Le mélanome est la tumeur cutanée la plus agressive, son incidence augmente chaque année et actuellement il n’existe pas de traitement efficace aux stades avancés de la maladie [
1] (→).
(→) Voir l’article de C. Robert et C. Mateus, page 850 de ce numéro
Le mélanome résulte de la transformation maligne des mélanocytes qui sont les cellules productrices de mélanine, pigment qui nous protège des effets délétères des radiations UV [
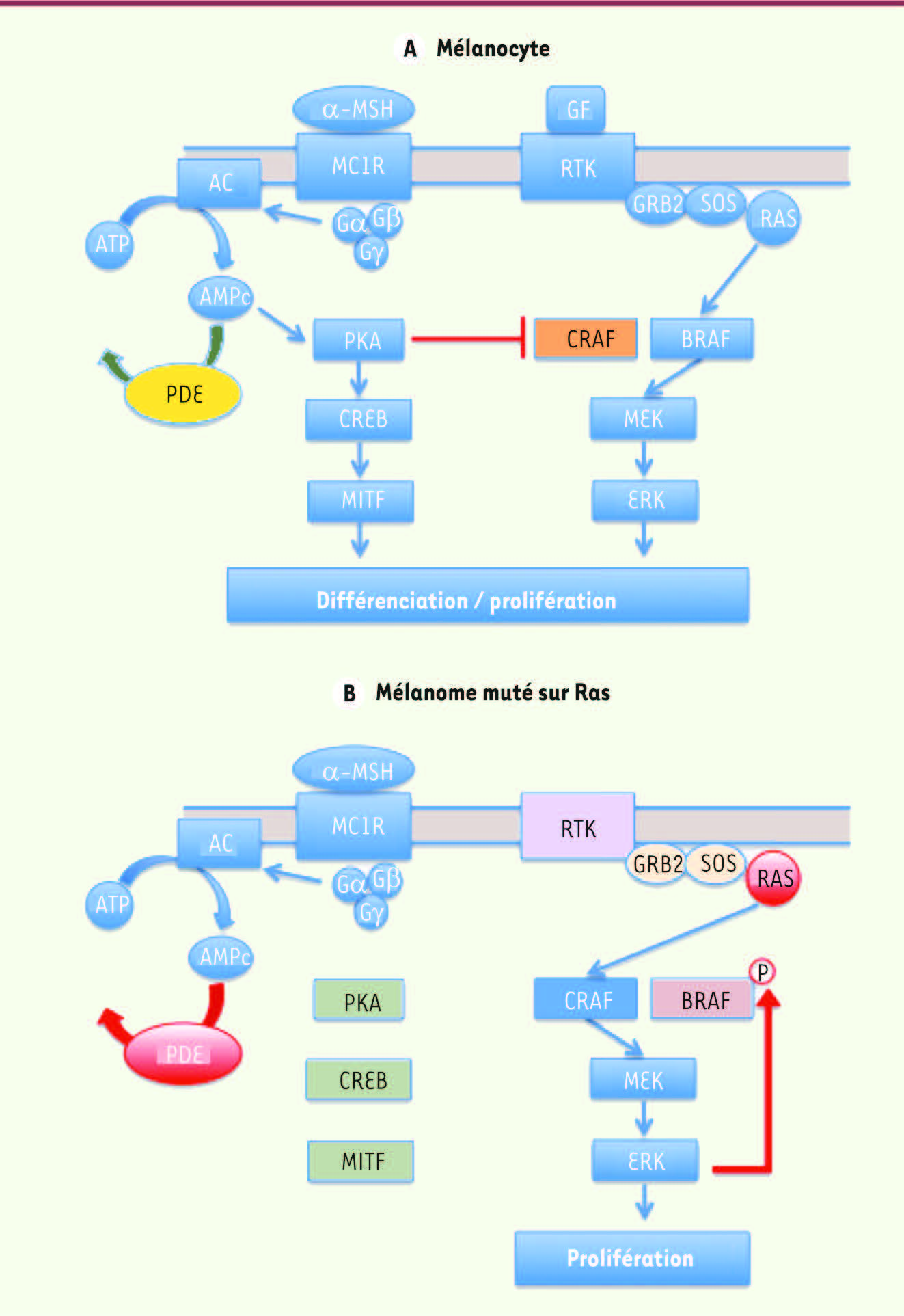
2]. La prolifération, la différenciation et la migration des mélanocytes sont régulées par plusieurs voies de signalisation activées simultanément par des facteurs de croissance et des hormones libérés dans le microenvironnement local, et dont les interactions sont essentielles pour réguler la fonction des mélanocytes. Deux grandes voies de signalisation sont activées simultanément dans les mélanocytes : la voie des MAPK (mitogen activated protein kinase) et celle de l’AMP cyclique (AMPc). |
Activation des voies MAPK et AMPc dans les mélanocytes normaux et tumoraux Dans les conditions physiologiques, la voie MAPK est activée par l’interaction de facteurs de croissance avec leurs récepteurs de surface à activité tyrosine kinase (RTK) et la transmission de ces signaux via la petite GTPase RAS. Lorsqu’elle est active, RAS stimule un certain nombre d’effecteurs et en particulier les sérine/thréonine kinases de la famille RAF. Il existe trois isoformes de RAF : ARAF, BRAF et CRAF (également appelée RAF1), qui activent les MAP-kinase kinases (MEK) chargées d’activer à leur tour les MAP-kinases (ERK) [
3]. Les kinases ERK ont de nombreux substrats, qui sont principalement impliqués dans la régulation de la prolifération des mélanocytes
(Figure 1)
. La transformation tumorale des mélanocytes s’accompagne de mutations activatrices des oncogènes BRAF ou N-RAS dans respectivement 50 % et 20 % de ces tumeurs cutanées, ce qui entraîne une activation constitutive de la voie MAPK [
4]. Ces mutations sont mutuellement exclusives car leur activité oncogénique résulte, dans les deux cas, de la stimulation de la voie MAPK.
 | Figure 1.
Changement d’isoforme de RAF en réponse à une mutation de RAS. A. Dans les mélanocytes l’activation de la voie de l’AMPc non seulement stimule la mélanogenèse mais aussi inhibe la kinase CRAF. C’est donc BRAF qui active la voie MAPK en aval des RTK. B. Dans les mélanomes contenant une mutation de RAS, la kinase BRAF est phosphorylée par ERK inhibant ainsi son interaction avec RAS. C’est donc CRAF qui active la voie MAPK en aval de RAS. La surexpression des PDE permet l’inhibition de la voie de l’AMPC empêchant l’inhibition de CRAF par PKA. α-MSH : melanocyte stimulating hormone ; MC1R : melanocortin-1 receptor ; AC : adenylyl cyclase ; PDE : phosphodiesterase ; PKA : protein-kinase A ; CREB : cAMP responsive element binding protein ; MITF : microphtalmia associated transcription factor ; GF : growth factor ; RTK : receptor tyrosine kinase.
|
L’AMPc est un second messager produit dans les mélanocytes en aval des hormones mélanotropes telles que l’α-MSH (alpha-melanocyte stimulating hormone) qui se lie au récepteur des mélanocortines de type 1 (MC1R). La voie de l’AMPc est étroitement associée à la différenciation des mélanocytes, car elle stimule l’expression de plusieurs enzymes spécifiques impliquées dans la synthèse de mélanine. L’activation de MC1R par ses ligands induit une augmentation de l’AMPc intracellulaire : ce dernier active la protéine kinase A (PKA), qui, à son tour, stimule la phosphorylation et l’activation du facteur de transcription CREB. CREB stimule la transcription du gène codant le facteur de transcription microphthalmia (MITF), qui joue un rôle-clé dans la différenciation des mélanocytes en contrôlant directement la transcription de nombreux gènes impliqués dans la synthèse de la mélanine ou le fonctionnement des mélanosomes (TYR, TYRP1, DCT, RAB27A et GPR1431) [
5, 2]
(Figure 1)
. La voie de l’AMPc est sous le contrôle spatiotemporel des phosphodiestérases (PDE) qui constituent la seule voie de dégradation de l’AMPc cellulaire. Il y a huit familles différentes de PDE capables de dégrader l’AMPc et plus de 30 isoformes différentes générées par épissage alternatif. L’activité des PDE - régulée via leur phosphorylation par plusieurs kinases - joue un rôle central dans l’interaction entre la voie de l’AMPc et d’autres voies de signalisation intracellulaire. |
CRAF active la voie MAPK dans les mélanomes en présence d’une mutation de RAS Les mélanocytes sont un excellent modèle d’étude de l’interaction entre les voies de l’AMPc et des MAPK puisque toutes deux sont activées simultanément dans les conditions physiologiques normales. Ainsi, l’activation constitutive de la voie de l’AMPc conduit à la phosphorylation et l’inactivation de CRAF par PKA, et l’engagement des RTK par des facteurs de croissance à l’activation de la voie MAPK via BRAF
(Figure 1A)
. Le rôle fondamental de BRAF dans la biologie des mélanocytes est attesté par le taux très élevé de mutations oncogéniques de cette kinase dans les mélanomes, alors que les autres kinases de la famille RAF ne sont jamais mutées. Néanmoins, alors que CRAF ne semblait pas jouer de rôle majeur dans le mélanome, des résultats récents révèlent l’importance de cette sérine/thréonine kinase dans l’activation de la voie MAPK et définissent comment CRAF peut activer les MAPK. Liaison des mutants V600E BRAF de faible activité à CRAF Bien que la plupart des travaux sur le rôle de BRAF dans les mélanomes aient porté sur la mutation V600E de BRAF, au moins 70 autres mutations de ce gène ont été identifiées. Beaucoup de ces dernières entraînent une réduction de l’activité kinase de BRAF par rapport à celle de la forme mutante V600E BRAF. Ces mutants, considérés de faible activité, sont toutefois capables d’activer la voie MAPK en se liant directement à CRAF et en l’activant lorsqu’ils sont exprimés dans des cellules COS-1. Les mêmes observations sont faites dans les lignées de mélanome contenant une mutation de BRAF de faible activité. Cibler CRAF dans ces cellules induit leur mort par apoptose suggérant que cette kinase pourrait constituer une cible thérapeutique dans ce groupe de mélanomes [
6]. Activation de CRAF et résistance aux inhibiteurs de BRAF La prévalence de la mutation V600E de BRAF dans certaines tumeurs dont le mélanome a suscité la conception d’inhibiteurs spécifiques de V600E BRAF, comme PLX4032 (Plexxikon) et GSK2118436 (GSK : GlaxoSmithKline). Des résultats spectaculaires ont été obtenus avec ces inhibiteurs dans les mélanomes métastatiques avec une mutation de BRAF [
7]. Cependant, l’enthousiasme initial engendré par ces résultats cliniques a été tempéré rapidement par le caractère transitoire de cet effet thérapeutique, dû au développement de résistances qu’expliquent plusieurs mécanismes. Curieusement, ces résistances ne sont pas associées à des mutations supplémentaires de BRAF mais à l’altération d’autres oncogènes (NRAS, PDGFR, IGF-1R, etc.) 2 intervenant dans la même voie de signalisation ou même dans le recrutement de nouvelles voies de signalisation [
8]. Or, beaucoup de ces résistances impliquent l’activation de la kinase CRAF qui est relativement résistante au PLX4032 ; cibler CRAF pourrait donc retarder l’apparition de résistances aux inhibiteurs de BRAF. Mélanome contenant une mutation de RAS : comment restaurer la voie de l’AMPc ? Alors que dans les mélanocytes normaux BRAF active la voie MAPK, dans les mélanomes associés à une mutation de RAS, c’est une autre isoforme de RAF, CRAF, qui active cette voie MAPK [
9]. L’incapacité de BRAF à recruter la voie MAPK dans les mélanomes dont RAS est mutée s’explique par la phosphorylation par ERK de la sérine 151 de BRAF, située près du domaine de liaison de BRAF à RAS et dont la phosphorylation inhibe l’interaction BRAF-RAS
(Figure 1)
. Pour échapper à cette régulation négative du gène BRAF par ERK, les cellules de mélanome ont développé deux stratégies : (1) elles ont acquis la mutation BRAF V600E qui rend cette kinase indépendante de RAS ; (2) les cellules de mélanome portant une mutation RAS utilisent non plus BRAF, mais l’isoforme CRAF pour activer la voie MAPK. En conséquence, l’inhibition de CRAF dans les mélanocytes réduit fortement la capacité oncogénique de RAS [
10]. Toutefois, pour que CRAF puisse être utilisée pour stimuler la voie MAPK, les cellules de mélanome doivent inactiver la voie de l’AMPc qui, dans les mélanocytes, inhibe CRAF de manière constitutive. De fait, dans les mélanocytes transformés par RAS et les lignées de cellules de mélanome dont RAS est mutée, la voie de l’AMPc ne peut plus être activée par les hormones mélanotropes telles que l’α-MSH [ 9]. Un des mécanismes fait intervenir PDE4 - et principalement les enzymes PDE4B2 et PDE4D5 - dont l’activité est augmentée dans les cellules de mélanomes par rapport aux mélanocytes normaux [ 10]. L’activation de la voie AMPc pourrait donc être restaurée en inhibant l’activité des PDE et en particulier celle des enzymes de la famille PDE4. De fait, nous avons montré que l’inhibition de l’expression ou de l’activité des enzymes PDE4 par le rolipram en combinaison avec une faible dose de forskoline (un activateur de l’adénylate cyclase) réduit fortement la transformation des mélanocytes par l’oncogène RAS et induit une diminution significative de la prolifération des lignées de mélanome (conséquence d’une induction de l’apoptose) mais pas des mélanocytes, démontrant l’importance physiologique des PDE4 dans la transformation des mélanocytes [ 10]
(Figure 1)
. |
Perspectives thérapeutiques Nos résultats montrent que l’inhibition de la voie de l’AMPc est nécessaire à la prolifération des mélanomes porteurs d’une mutation de RAS. Ces données identifient les enzymes de la famille PDE4 - intermédiaires nécessaires - comme une nouvelle cible thérapeutique particulièrement intéressante dans les mélanomes lorsqu’existe une mutation de RAS. Cette hypothèse est d’autant plus intéressante que ce groupe de mélanomes est résistant aux thérapies ciblées en cours de développement. BRAF étant inactivée dans ces mélanomes, les inhibiteurs spécifiques de BRAF en développement clinique y sont inefficaces, voire même préjudiciables comme l’indiquent des données récentes [
11]. En outre, ces mélanomes sont relativement résistants aux inhibiteurs de MEK. L’intérêt des inhibiteurs sélectifs de PDE4 est accru par le fait que ces molécules sont en développement dans le traitement d’autres maladies, notamment de l’asthme, de l’inflammation pulmonaire et de l’arthrite rhumatoïde [
12]. Ils pourraient être testés dans certains mélanomes afin d’augmenter l’AMPc intracellulaire et ainsi inhiber la prolifération de cellules de mélanome portant une mutation de RAS, et peut-être plus généralement de tous les mélanomes qui utilisent CRAF pour activer la voie MAPK. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Robert
C
,
Mateus
C.
Anticorps anti–CTLA 4 : une avancée thérapeutique majeure dans le traitement du mélanome métastatique . Med Sci (Paris).
2011; ; 27 : :850.–858. 2.
Delevoye
C
,
Giordano
F
,
van Niel
G
,
Raposo
G.
La biogenèse des mélanosomes : l’échiquier de la pigmentation . Med Sci (Paris) .
2011; ; 27 : :153.–162. 3.
Galmiche
A
,
Ezzoukhry
Z.
Régulation de la survie cellulaire par les kinases de la famille RAF . Med Sci (Paris).
2010; ; 26 : :729.–733. 4.
Dalle
S
,
Martin-Denavit
T
,
Thomas
L.
Hypervariabilité génotypique des mélanomes : un défi thérapeutique . Med Sci (Paris).
2006; ; 22 : :178.–182. 5.
Bertolotto
C
,
Busca
R
,
Ballotti
R
,
Ortonne
JP.
L’AMP cyclique est un régulateur de la pigmentation de la peau . Med Sci (Paris).
2001; ; 17 : :177.–85. 6.
Smalley
KS
,
Nathanson
KL
,
Flaherty
KT.
Genetic subgrouping of melanoma reveals new opportunities for targeted therapy . Cancer Res.
2009; ; 69 : :3241.–3244. 7.
Flaherty
KT
,
Puzanov
I
,
Kim
KB
, et al.
Inhibition of mutated, activated BRAF in metastatic melanoma . N Engl J Med.
2010; ; 363 : :809.–819. 8.
Poulikakos
PI
,
Rosen
N.
Mutant BRAF melanomas-dependence and resistance . Cancer Cell.
2011; ; 19 : :11.–15. 9.
Dumaz
N
,
Hayward
R
,
Martin
J
, et al.
In melanoma, RAS mutations are accompanied by switching signaling from BRAF to CRAF and disrupted cyclic AMP signaling . Cancer Res.
2006; ; 66 : :9483.–9491. 10.
Marquette
A
,
Andre
J
,
Bagot
M
, et al.
ERK and PDE4 cooperate to induce RAF isoform switching in melanoma . Nat Struct Mol Biol.
2011; ; 18 : :584.–591. 11.
Cox
AD
,
Der
CJ.
The raf inhibitor paradox: unexpected consequences of targeted drugs . Cancer Cell.
2010; ; 17 : :221.–223. 12.
Boswell-Smith
V
,
Spina
D
,
Page
CP.
Phosphodiesterase inhibitors . Br J Pharmacol.
2006; ; 147 ( suppl 1) : :S252.–S257. |