| |
| Med Sci (Paris). 2011 October; 27(10): 850–858. Published online 2011 October 21. doi: 10.1051/medsci/20112710013.Anticorps anti-CTLA-4 Une avancée thérapeutique majeure dans le traitement du mélanome métastatique Caroline Robert1* and Christine Mateus1 1Service de dermatologie et Inserm U891, Institut Gustave Roussy, 114, rue Édouard Vaillant, 94805Villejuif, France |
Le système immunitaire et le mélanome : immunosurveillance et immunothérapie Nous vivons aujourd’hui une révolution dans le domaine du traitement du mélanome métastatique. Cette maladie au pronostic fatal en quelques mois, qui n’avait connu aucune avancée thérapeutique notable depuis plus d’un demi-siècle, est aujourd’hui défiée sur deux fronts. L’une des stratégies prometteuses repose sur l’utilisation de médicaments inhibant de façon ciblée certaines enzymes impliquées dans la biologie de la tumeur comme les inhibiteurs de BRAF, capables de bloquer la fonction kinase de cette enzyme qui est constitutivement activée dans plus de 50 % des mélanomes (→) [
45]. À la différence de ces thérapies dites ciblées, agissant directement sur la tumeur, une autre approche thérapeutique, développée dans cet article, cible non pas la tumeur, mais le système immunitaire du patient. Il s’agit d’une immunothérapie reposant sur le blocage de la molécule CTLA-4 (cytotoxic T-lymphocyte antigen 4), exprimée à la surface des lymphocytes et dont le rôle physiologique est de limiter l’activation du système immunitaire (→) [
46].
(→) Voir l’article de Nicolas Dumaz et al., page 817 de ce numéro
(→) Voir l’article de Daniel Olive et al., page 842 de ce numéro
La notion d’immunosurveillance et l’implication du système immunitaire dans l’émergence et le développement des cancers sont connues depuis plusieurs années [
1,
2]. Le mélanome est une des tumeurs dont l’incidence est la plus influencée par le système immunitaire, après les cancers viro-induits comme les sarcomes de Kaposi1 [
3]. Des régressions spontanées de mélanomes, qui peuvent s’accompagner de manifestations d’auto-immunité comme des vitiligos, sont parfois rapportées. Ainsi arrive-t-il souvent que des signes de régression histologique à type d’infiltrat lymphocytaire ou des zones de fibrose cicatricielle soient notés dans les comptes rendus anatomopathologiques des tumeurs primitives des patients. Il arrive également de façon non exceptionnelle que le diagnostic soit porté chez des patients d’emblée au stade métastatique, sans qu’aucune tumeur primitive ne soit retrouvée. Ces mélanomes ont un meilleur pronostic que les mélanomes classiques dont la tumeur primitive est connue [
4], et on peut supposer que ce meilleur pronostic est lié à une meilleure défense immunitaire qui aurait, dans un premier temps, entraîné une régression totale du mélanome primitif. Plusieurs antigènes associés au mélanome ont été identifiés : antigènes de différenciation mélanocytaire comme MELAN-A (MART-1) ou gp100, ou antigènes de la famille cancer testis, comme les antigènes MAGE ou NY-Eso1 [
47]. Nous disposons aussi d’outils nous permettant de mettre en évidence des sous-populations lymphocytaires CD4+ et surtout CD8+ cytotoxiques capables de reconnaître ces antigènes. De nombreux modèles animaux ont été publiés et suggèrent que le système immunitaire est capable de rejeter des mélanomes implantés chez les souris, et de très nombreux essais d’immunothérapie ont été effectués [
5]. Les méthodes de stimulation du système immunitaire sont très variées (→) [
48]. Il peut s’agir d’une immunostimulation non spécifique qui est l’objectif des traitements par certaines cytokines : interféron alpha ou interleukine-2. Il peut s’agir d’une immunothérapie spécifique visant à développer une réponse vis-à-vis d’un antigène de tumeur, comme les vaccinations protéiques ou peptidiques avec des peptides gp100 ou des protéines MAGE par exemple [48]. Des essais de thérapie cellulaire reposant sur l’administration de cellules dendritiques ou encore de lymphocytes cytotoxiques autologues préparés ex vivo (immunothérapie adoptive) ont été développés et sont encore en cours d’optimisation dans certains centres spécialisés [
6, 48] (→). Cependant, il faut admettre que, jusqu’à présent, aucune immunothérapie n’avait été démontrée comme étant efficace en termes de gain de survie. Un amer constat d’échec des stratégies vaccinales a même été publié en 2004, relatant un taux de réponse cumulé des différents essais inférieur à 3 % [
7]. Le concept de l’immunothérapie du mélanome paraissait à l’époque bien affaibli et ses défenseurs avaient du mal à faire entendre leur voix. C’est à cette époque que les premiers résultats obtenus avec les anticorps anti-CTLA-4 commencèrent à être connus et donnèrent à l’immunothérapie du mélanome un « deuxième souffle ». Ces espoirs thérapeutiques sont aujourd’hui confirmés par des résultats d’essais cliniques récents démontrant enfin un gain de survie chez les patients souffrant de mélanome métastatique. À la jonction entre les données fondamentales et les premiers développements cliniques chez l’homme, on dispose des résultats des modèles animaux, qui étaient déjà prometteurs. Effectivement, le blocage de CTLA-4 chez la souris induit une activation des lymphocytes, la production de cytokines et a un effet antitumoral in vivo sur des tumeurs établies. Les animaux ainsi traités ont aussi une immunité accrue vis-à-vis d’une réimplantation tumorale [
8, 46]. L’association du blocage de CTLA-4 à une vaccination antitumorale ou une radiothérapie augmentait encore l’immunité antitumorale [46]. Fort de ces résultats précliniques, le développement clinique chez l’homme a débuté. Nous exposerons ici les résultats des essais thérapeutiques en termes d’efficacité mais aussi d’effets secondaires observés, ainsi que les méthodes d’évaluation de ces nouveaux traitements, qui sont très différentes de celles des chimiothérapies classiques.
(→) Voir l’article de Éric Tartour et al., page 833 de ce numéro
Initialement, deux anticorps monoclonaux (Acm) ciblant CTLA-4 étaient simultanément en développement. Le tremelimumab (une IgG2 ; laboratoires Pfizer) et l’ipilimumab (un anticorps humanisé IgG1 ; laboratoires BMS, Medarex). Aujourd’hui seul l’ipilimumab a poursuivi son développement, car celui du tremelimumab a été interrompu à la suite des résultats négatifs de la phase III d’enregistrement. Le développement clinique de l’ipilimumab a été couronné de succès puisque ce médicament vient d’être approuvé par la FDA (Food and drug administration), sous le nom commercial de Yervoy®. |
Développement clinique des anticorps anti-CTLA-4 Les premiers essais de phase I et II du tremelimumab et de l’ipilimumab ont été effectués à partir de 2002. L’expérience du tremelimumab Le tremelimumab a été testé initialement en administrant une dose unique et des concentrations croissantes d’anticorps allant de 0,01 mg à 15 mg/kg. Des résultats objectifs encourageants ont été observés essentiellement chez les patients atteints de mélanome métastatique à partir de 3 mg/kg et plus fréquemment de 15 mg/kg. Les réponses étaient parfois très impressionnantes et durables [
9]. Une phase II comparant deux régimes de doses incita à choisir une dose de 15 mg/kg tous les trois mois au lieu de 10 mg/kg tous les mois [
10]. Ce choix reposait sur la longue demi-vie du produit (22 jours) et le maintien d’une concentration jugée comme suffisante pendant trois mois après une injection de 15 mg ainsi que sur des résultats d’efficacité et de tolérance plutôt en faveur de ce régime. À l’issue de cette phase II, des résultats intéressants étant observés chez 10 % à 15 % des patients et la toxicité, essentiellement d’ordre immunologique, étant considérée comme acceptable, le régime de 15 mg tous les trois mois fut finalement choisi pour la phase III à visée d’enregistrement. Celle-ci comparaît le tremelimumab à la chimiotérapie standard (dacarbazine ou témozolomide) chez des patients atteints de mélanome métastatique en première ligne de traitement. Lors de l’analyse intermédiaire, alors que la plupart des patients n’avaient été traités que depuis 6 à 11 mois, il n’y avait pas de différence significative de survie entre les deux bras de traitement (11,7 mois pour le tremelimumab versus 10,7 pour la chimiothérapie) et des taux de réponse faibles (7,6 % versus 8,3 %) : l’essai a été considéré comme négatif, mettant ainsi fin au développement du tremelimumab [
11,
12]. Or, l’analyse plus tardive des résultats montre qu’une tendance en faveur du bras tremelimumab commence à apparaître, mais sans atteindre cependant le seuil de significativité ( p = 0,14). Plus récemment, une analyse de sous-groupes a montré que le tremelimumab semblait bénéficier plus particulièrement aux patients ayant un taux de CRP ( C reactive protein) bas plutôt qu’aux patients ayant une CRP élevée [
13]. Ce taux de CRP pourrait refléter un état particulier de réaction de l’hôte au mélanome, car on sait que cette enzyme est synthétisée dans le foie en réponse à l’inflammation. Cependant, cette analyse rétrospective de sous-groupes n’avait pas de puissance statistique puisqu’il n’y avait pas eu de stratification initiale en fonction de ce taux enzymatique. L’analyse finale des résultats de survie apportera peut être des informations nouvelles et intéressantes sur l’évolution dans le temps des réponses observées sous traitement. Cependant, il faut admettre que le choix de ce schéma d’administration ne reposait sur aucun critère pharmacodynamique ou pharmacocinétique consensuel, car il n’existe pas de biomarqueur pouvant indiquer la fenêtre d’efficacité thérapeutique. Un travail effectué sur dix patients inclus dans un essai de phase II et traités tous les trois mois suggère qu’il serait peut être plus efficace d’administrer le traitement de façon mensuelle [
14]. Le tremelimumab fut aussi testé en association avec d’autres immunothérapies comme les vaccins dendritiques exprimant des antigènes associés au mélanome ou encore de l’interféron alpha. Au cours de ces essais de phase I et II, des réponses cliniques rares, mais parfois importantes et durables, ont été observées [
15]. L’expérience de l’ipilimumab En ce qui concerne l’ipilimumab 2
(→), les études de phase I/II ont utilisé des doses de traitement variant de 0,1 mg/kg à 20 mg/kg. Des doses inférieures à 3 mg/kg se sont révélées inefficaces, et celle de 20 mg/kg a été considérée comme dose toxique limitante [
16–
26]. Les doses de 3 et 10 mg/kg ont été retenues comme doses thérapeutiques. Une des premières études publiées démontra un effet très bénéfique avec l’apparition d’une nécrose tumorale massive chez des patients atteints de mélanome métastatique préalablement vaccinés par un vaccin autologue sécrétant du GM-CSF ( granulocyte-macrophage colony stimulating factor) (→) [
19, 48]. Des résultats prometteurs furent ensuite obtenus par la combinaison de l’ipilimumab et d’une vaccination par peptides gp100 chez des patients ayant un haplotype HLA-A2 permettant la présentation de ces peptides [ 16,
22]. Des taux de réponse variant de 13 % à 21 % encouragèrent en 2004 un essai de phase III à trois bras portant sur 674 patients avec une randomisation 3/1/1 comparant : (1) l’association ipilimumab à la dose de 3 mg/kg + peptides gp100, (2) l’association ipilimumab + placebo, et (3) la vaccination peptidique seule chez des patients atteints de mélanome métastatique préalablement traités [
27]. Cette étude dont les résultats furent publiés en 2010, six ans après son début, fut la première à démontrer un bénéfice d’un traitement sur la survie globale des patients atteints de mélanome métastatique. L’ipilimumab, sans ou avec vaccin peptidique, diminue de 34 % et de 32 % respectivement le risque de décès par rapport au vaccin seul. La survie médiane des patients est autour de 10 mois avec l’ipilimumab avec ou sans vaccin versus 6,4 mois pour le vaccin seul. Ces résultats ont permis d’obtenir l’autorisation de mise sur le marché (AMM) de l’ipilimumab. Par ailleurs, une étude de phase II avait comparé trois doses : 0,3 mg/kg, 3 mg/kg et 10 mg/kg [ 26]. Les réponses dépendaient de la dose administrée, et s’établissaient à 0 %, 4,2 % et 11,1 % respectivement. La toxicité était également dose-dépendante mais restait acceptable même à 10 mg/kg [ 26]. Cette dose de 10 mg/kg fut utilisée pour un autre essai de phase III comparant l’association d’ipilimumab et de dacarbazine à la dacarbazine seule chez des patients atteints de mélanome métastatique n’ayant pas encore reçu de traitement (première ligne de traitement). Dans cet essai également, le bras thérapeutique contenant de l’ipilimumab a eu un effet bénéfique sur la survie des patients avec un taux de survie augmenté de 10 % environ après 1, 2 et 3 ans par rapport au bras chimiothérapie seule [
28]. Les résultats cliniques chez les patients recevant de l’ipilimumab semblent assez superposables dans ces deux grands essais randomisés avec un net bénéfice pour environ 15 % à 20 % des patients en termes de prolongation de la survie. Ni la vaccination, ni la dacarbazine ne semblent apporter un bénéfice supplémentaire.
(→)Voir m/s n° 12 décembre 2009, Anticorps monoclonaux en thérapeutique
(→) Voir l’article de Éric Tartour et al., page 833 de ce numéro
D’autre part, quelques résultats obtenus sur de petits effectifs de patients suggèrent une efficacité possible sur les métastases cérébrales de mélanome qui sont habituellement réfractaires à tout traitement [22,
29,
30]. |
Les effets secondaires des traitements par Acm anti-CTLA-4 Comme on pouvait s’y attendre compte tenu du mécanisme d’action des anticorps anti-CTLA-4 (→) [46], les effets secondaires sont différents de ceux des chimiothérapies cytotoxiques classiques. Ils sont d’ordre immunologique et dénommés immune related adverse events ou IRAE, qu’on pourrait traduire par « effets secondaires d’ordre immunitaire ». Même si leur mécanisme exact n’est pas clairement élucidé, l’intervention de lymphocytes activés a été démontrée dans les tissus extratumoraux cibles de ces effets iatrogènes [
32].
(→) Voir l’article de Daniel Olive et al., page 842 de ce numéro
Les tissus cibles de la toxicité des immune related adverse events Les principales cibles sont la peau, le tube digestif, le foie et l’axe hypothalamo-hypophysaire. Manifestations cutanées Elles sont fréquentes, mais de grade modéré et ne mettent le plus souvent pas en jeu le pronostic vital, ni même la poursuite du traitement. Il s’agit de prurit cutané (20 % à 26,5 % des patients) ou d’éruptions (17 % à 68 % des patients), rarement de grade 3 [ 10, 16,
17,
21,
24– 27], et cédant à un traitement symptomatique par dermocorticoïdes topiques et antihistaminiques oraux. Des biopsies cutanées ont montré un œdème dermique et des infiltrats cellulaires périvasculaires contenant des lymphocytes CD4 + et CD8 + et/ou des polynucléaires éosinophiles [ 16,
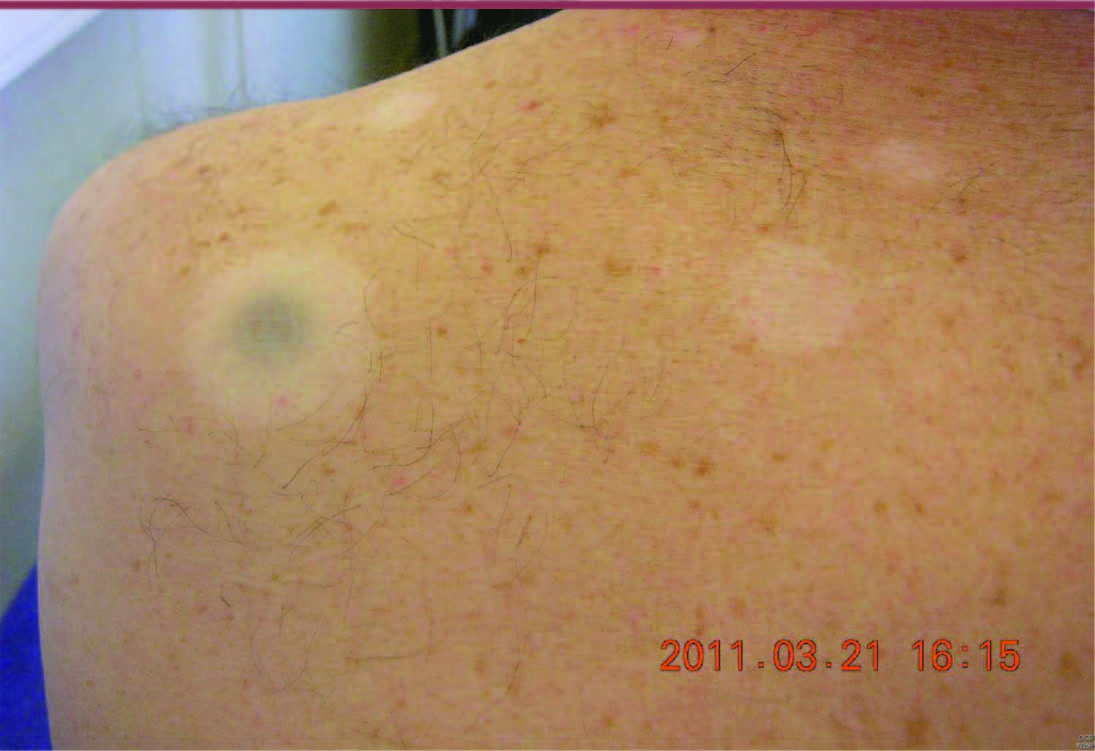
33]. Des vitiligos ou des lésions vitiligoïdes en regard de métastases en régression ont été rapportées (Figure 1), ce qui bien sûr évoque une réponse immunologique bénéfique qui déborderait la cible des mélanocytes tumoraux en s’attaquant aussi aux mélanocytes normaux [ 16, 26, 27].
 | Figure 1.
Lésions dépigmentées vitiligoïdes autour des métastases cutanées de mélanome chez un patient traité par ipilimumab et ayant une réponse thérapeutique depuis plus de deux ans.
|
Atteinte colique Se manifestant par une diarrhée, elle est observée chez 25 % à 50 % des patients traités par 10 mg/kg d’ipilimumab. Chez 5 % à 20 % d’entre eux, la diarrhée peut être de grade 3 à 4 [ 10, 16, 17, 21, 24– 27, 33]. Des complications graves à type de perforations coliques ont été observées dans moins de 1 % des cas, conduisant à des colectomies en urgence. Trois types d’atteintes histologiques ont été décrits : un infiltrat fait de neutrophiles (46 % des cas), de lymphocytes (15 % des cas) et mixte (38 % des cas) [ 16,
34,
35]. Les protocoles de prise en charge de ces colites qui ont été mis en place ont considérablement amélioré le retentissement de cet effet secondaire. Pour les cas de grade 1, un traitement symptomatique est préconisé et dans les cas de grade 2, un traitement corticoïde lentement dégressif. Le traitement par ipilimumab pourra généralement être poursuivi. Pour les atteintes de grade 3 ou 4, de fortes doses de corticoïdes par voie intraveineuse sont prescrites et un traitement par infliximab peut éventuellement être nécessaire en cas de colite sévère et corticorésistante [ 21, 27, 34]. Dans ces cas, le traitement par ipilimumab ne sera pas reconduit. Un traitement préventif par budésonide 3 s’est révélé inefficace et, à ce jour, aucun biomarqueur prédictif de cette toxicité digestive n’a pu être mis en évidence [
36]. Hépatites D’allure auto-immune, elles ont été observées chez 3 % à 9 % des patients [ 10, 17, 21, 26, 27]. Il faut bien sûr éliminer une atteinte métastatique, une infection virale ou une atteinte médicamenteuse autre. Ici aussi un algorithme de prise en charge a été validé pour l’ipilimumab, reposant sur la corticothérapie systémique, voire (pour les cas résistants) sur le mycophénolate mofétil 4 (Cellcept®). Atteintes endocriniennes Des hypophysites ont été notamment rapportées chez 1 % à 8 % des patients [ 10, 17, 21,
25– 27]. Le diagnostic est posé sur les déficits hormonaux ainsi que sur l’élargissement de l’hypophyse parfois bien visible à l’IRM (imagerie par résonance magnétique). Le traitement repose sur la substitution hormonale qui peut parfois être prolongée voire définitive car cette atteinte, à l’inverse des colites et des hépatites, semble pouvoir persister. Pancréatites Elles ont été rapportées dans 1 % à 3 % des cas avec des élévations des enzymes amylase et lipase. Atteintes oculaires À type d’uvéite ou d’épisclérite, elles ont été rapportées chez moins de 2 % des patients recevant de l’ipilimumab, et elles régressent en général sous traitement symptomatique [ 16, 17]. Complications neurologiques À type de neuropathies sensitives ou motrices, elles ont été rapportées dans 1 % des cas. Quelques rares cas isolés de myasthénie, de syndromes de type polyradiculonévrites, d’encéphalopathies ont été publiés également [ 26]. Ont aussi été publiés de façon anecdotique des cas de thrombopénies et des glomérulopathies de type autoimmun [21]. La prise en charge de toutes ces toxicités repose essentiellement sur la corticothérapie à forte dose, qui, semble t-il, n’a pas de retentissement sur la réponse tumorale y compris à long terme [
37]. Manifestations auto-immunes et prédiction de la réponse clinique Il semble exister une corrélation entre les réponses cliniques et les manifestations d’auto-immunité [ 16]. Plusieurs études ont recherché une relation directe entre l’effet thérapeutique et la fréquence et l’intensité de ces effets secondaires. Dans une étude portant sur 56 patients où ipilimumab et vaccination étaient associés, des réponses objectives étaient observées chez 36 % des patients présentant des effets secondaires de grade 3/4 et 5 % des patients en l’absence d’effets secondaires sévères [ 16]. Quand on regroupe les résultats de trois essais de phase II portant sur un total de 343 patients traités par ipilimumab, on voit qu’un contrôle de la maladie métastatique (réponses objectives plus stabilisation) est obtenu chez 34 % à 43 % des patients ayant au moins un effet secondaire immunologique de grade 2 et seulement 20 % à 24 % des patients ayant des manifestations plus modérées [ 16, 17, 24, 26]. Ce résultat n’est pas statistiquement significatif, mais il est également en accord avec l’observation d’une tendance à une survie plus prolongée en cas d’effet secondaire de grade supérieur ou égal à 2 pendant les trois premiers mois du traitement : 14,8 mois par rapport à 8,21 mois chez les autres patients. Cette corrélation positive entre la fréquence et l’intensité des effets secondaires d’ordre immunologique et les réponses cliniques est donc probable, même si elle n’est pas encore définitivement prouvée.
Tableau I.
Essais thérapeutiques utilisant le tremelimumab et l’ipilimumab (Ipi) chez des patients atteints de mélanome métastatique. Ipi : ipilimumab RC : réponse complète ; RP : réponse partielle ; OS : survie globale (overall survival) ; SD : stabilité tumorale (stable disease) ; pt : patient ; pts : patients.
| Essai et patients (pts) |
Schéma d’administration |
Résultats |
Toxicités |
Réf |
| Phase II : 246 pts |
Tremelimumab 15 mg/kg tous les 90 jours |
Réponse : 6,6 % (16 RP) ; bénéfice : 21 % (16 RP + 35 SD) |
Grade ≥ 3 : 20,4 % |
[10] |
|
|
Survie globale médiane : 10 mois ; survie à 24 mois : 22 % |
|
|
|
| Phase I : 39 pts dont 34 atteints de mélanome |
Tremelimumab de 0,01 à 15 mg/kg |
Réponse : 10 % (2 RC + 2 RP tous mélanomes) de plus de 24 mois |
Grade ≥ 3 : 35 % uniquement pour dose > 10 mg/kg |
[9] |
|
| Phase I/II : 28 pts phase I ; 89 pts phase II |
Phase I : tremelimumab : 3 ou 6 ou 10 mg/kg |
Pas de dose limitante en phase I |
Grade ≥ 3 : 13 % bras 15 mg/kg/3mois versus 27 % bras 10 mg/kg/mois |
[56] |
|
Phase II : tremelimumab 10 mg/kg/mois ou 15 mg/kg/3mois |
Réponse : 10 % 2 RC + 6 RP identique dans les 2 bras |
|
|
|
| Phase I : 16 pts |
Vaccination cellules dendritiques - MART1 + tremelimumab : 3 ou 6 ou 10 mg/kg/mois ou tremelimumab 10 mg/kg ou 15 mg/kg/3mois |
Réponse : 25 % 2 RC + 2 RP + 1 stabilité |
1 cas de diarrhée grade 3 |
[15] |
|
|
|
1 cas d’hypophysite |
|
|
| MDX010-13 : phase I/II : 36 pts dont 8 prétraités par chimiothérapie |
Ipi 0,1-3 mg/kg + IL2 720000 UI/kg |
22 % (8 pts) de réponse |
14 % (5 pts) grade 3-4 : colite dont 1 pt avec uvéite |
[
20] |
|
|
16 % (6 pts) de survie à 11 à 19 mois |
|
|
|
|
Pas de bénéfice à l’association IL2 + Ipi |
|
|
|
| Phase I : 11 pts prétraités par vaccination 3 mois avant |
Ipi 3 mg/kg/2 mois |
8 réponses dont 3 nécroses tumorales |
Pas de toxicité |
[19] |
|
| Phase II : 14 pts |
Ipi 3 mg/kg + gp100/3 semaines |
Réponse : 21 % (2 RC + 1 RP) dont 1 pt avec métastase cérébrale |
Grade ≥ 3 : 43 % (1 hépatite, 2 colite, 1 hypophysite) |
[22] |
|
| Phase II :75 pts |
Ipi en escalade de dose 3 ou 10 mg/kg/6 ou 8 semaines + vaccination |
Survie sans rechute = 40 mois (médiane) |
10/75 pts colite grade 3 dont 2 perforations côlon |
[
23] |
|
| MDX010-08 : 72 pts |
Ipi 3 mg/kg/4 semaines ± dacarbazine |
Réponse 14,3 % avec dacarbazine versus 5,4 % ipi seul |
Toxicité équivalente dans les 2 bras de traitement |
[
18] |
|
|
Médiane de survie de 14,3 mois avec dacarbazine versus 11,4 mois ipi seul |
|
|
|
| MDX010-05 : phase II randomisée : 56 pts (incluant les 14 précédents) |
2 bras :
- Ipi 3 mg/kg + gp100/3 semaines
- Ipi 3 mg/kg + gp100 puis 1 mg/kg + gp100/3 semaines
|
Réponse : 13 % (2 RC + 5 RP dont 5 de plus de 24 mois dont métastase cérébrale)
Pas de différence selon le schéma d’administration
|
Grade ≥ 3 : 25 %
Toxicité corrélée à la réponse
|
[16] |
|
| CA184-007 : phase II randomisée en double aveugle : 115 pts |
Induction : 4 injections ipi 10 mg/kg/ 3 semaines ± budésonide |
Réponse : 12,1 %(ipi + corticoïdes) versus 15,8 % (ipi) |
Grade ≥ 3 : 24 % versus 23 % |
[25] |
|
|
Survie globale : 17,7 % versus 19,3 % |
Corticoïdes non efficaces en préventif sur la toxicité + non délétères sur la réponse tumorale |
|
|
| MDX010-15 : phase I/II randomisée : 88 pts |
3 bras :
- Ipi de 7,5 à 20 mg/kg × 3 injections
- Ipi 7,5 à 20 mg/kg une seule injection
- Ipi 10 mg/kg/3 semaines 4 injections
|
Réponse : 4,8 % longues > 24 mois |
Grade ≥ 3 : 19 % plus important dans le bras simple dose
Pas d’association toxicité et réponse |
[24] |
|
| Phase II : 139 pts |
2 essais :
- Ipi 3mg/kg + gp100 versus Ipi 1 mg/kg + gp100
- Escalade de dose intra-patient de 3 à 9 mg/kg
|
Réponse : 17 %
13 % sur l’essai 1
19 % sur l’essai 2
|
Grade ≥ 3 : 36 %
Colites : 17 % et hypophysite : 9 % |
[17] |
|
| CA184-008 : phase II : 155 pts prétraités |
Induction : 4 injections Ipi 10 mg/kg/3 semaines |
Survie globale : 10,2 mois; réponse : 5,8 % |
Grade ≥ 3 : 22 % |
[21] |
|
Entretien : 1 injection/3 mois |
Survie à 12 mois : 47,2 %; survie à 24 mois : 32,8 % |
Colite (8,4 %) et hépatite (7,1 %) |
|
|
| CA184-022 : phase II randomisée en double aveugle : 217 pts |
3 bras :
- Ipi : 4 injections ipi à 0,3 mg/kg/3 semaines
- Ipi : 4 injections Ipi 3 mg/kg/3 semaines
- Ipi : 4 injections Ipi 10 mg/kg/3 semaines puis entretien tous les 3 mois
|
Réponse : 0 % vs 4,2 % versus 11,1 %
Survie globale : 8,6 versus 8,7 versus 11,4 mois
Survie à 12 mois : 39,6 % versus 39,3 % versus 48,6 %
Survie à 24 mois : 18,4 % versus 24,2 versus 29,8 %
|
Toxicité dose-dépendante |
[26] |
|
| CA184-020 : phase III randomisée en double aveugle : 676 pts |
3 bras :
- Ipi : 4 injections Ipi 3 mg/kg/3 semaines
- Ipi + gp100
- gp100 : 4 injections/3 semaines
Réinduction à 12 semaines possible
|
Réponse : 28,5 % versus 20,1 % versus 11,1 %
Survie globale : 10,1 % versus 10 % versus 6,4 %
Étude positive en survie globale
Pas d’intérêt à l’adjonction d’une vaccination
|
Grade ≥ 3 : 10-15 % pour Ipi et 3 % pour gp100 |
[27] |
|
| CA184-024 : phase III randomisée en double aveugle : 502 pts |
Dacarbazine 1 g/m²/3 semaines ± induction : 4 injections Ipi 10 mg/kg/3 semaines Entretien : 1 inj/3 mois |
Gain en survie globale : 11,2 mois versus 9,1 mois |
Toxicité de grade > 3 : 56,3 % dans le bras avec ipilimumab versus 27,5 % avec la dacarbazine seule |
[28] |
|
|
Survie à 12 mois : 47,3 % versus 36,3 % |
|
|
|
|
Survie à 24 mois : 28,5 % versus 17,9 % |
|
|
|
|
Survie à 36 mois : 20,8 % versus 12,2 % |
|
|
|
| Programme compassionnel : 27 pts avec 8 métastases cérébrales |
Ipi 10 mg/kg, 4 injections/3 semaines puis toutes les 12 semaines |
RC + RP + SD = 29 % à W24 et 15 % à W60 OS à 1 et 2 ans = 35 % et 23,5 % |
Hépatite grade 3-4 (1 pt); colite (2 pts); pancytopénie (1 pt) |
[
31] |
|
| Programme compassionnel : 53 pts |
Ipi 10 mg/kg, 4 injections/3 semaines puis toutes les 12 semaines |
RP + RC = 12 % SD = 29 % |
Grade 3 = 29 % |
[45] |
|
|
Survie globale de 7,2 mois |
Prurit (43 %), diarrhée (33 %) |
|
|
Établissement de nouveaux critères d’évaluation Une autre caractéristique fondamentale de ces nouveaux traitements est que les profils de réponses observés sont tout à fait distincts de ceux auxquels on est habitué avec les chimiothérapies classiques. Les réponses cliniques sont souvent observées après des délais plus longs que ceux que l’on observe au cours des traitements classiques, souvent au-delà du 3e ou 4e mois de traitement. Au cours des essais de phase III qui ont démontré une différence de survie entre les patients recevant de l’ipilimumab et les autres patients, on voit que les courbes de survie ne se séparent pas avant le 4e mois de traitement [26, 27]. Chez certains patients, on observe même une progression initiale de la taille des métastases, voire l’apparition de nouvelles métastases au cours des trois premiers mois de traitement [20]. Dans certains cas, il s’agissait d’un faux aspect de progression tumorale [27, 29] lié à une infiltration lymphocytaire péri- et intratumorale. C’est ce qu’on appelle le phénomène de flare qui peut, dans certains cas, entraîner un arrêt prématuré du traitement. Dans ce contexte, de nouveaux critères d’évaluation de l’ipilimumab ont été proposés, appelés immune-related response criteria, qui autorisent l’apparition de nouvelles lésions au début du traitement [
38]. En utilisant ces nouveaux critères, environ 10 % des patients dont la tumeur aurait été considérée comme en progression, sont en fait des répondeurs tardifs à l’immunothérapie. Ces critères modifiés ne sont pas encore utilisés de façon officielle et sont actuellement en cours de validation. Sur le plan mécanistique, ces réponses retardées s’expliquent par le fait qu’il s’agit d’une immunothérapie exerçant sur la tumeur un effet indirect qui a nécessité au préalable une activation du système immunitaire qui, ensuite, s’est attaqué aux cellules tumorales. |
Questions en suspens : critères prédictifs d’efficacité et schéma optimal d’administration Le schéma d’administration optimal de l’ipilimumab reste à définir. Les études de pharmacocinétique ont montré une demi-vie relativement longue de 12,5 jours, avec des concentrations sériques thérapeutiques persistant pendant trois à quatre semaines après une injection de 3 mg/kg [
39]. L’essai de phase II qui a comparé trois doses : 0,3, 3 ou 10 mg/kg était plutôt en faveur de la dose la plus élevée [26], mais l’essai de phase III utilisant 3 mg/kg était concluant [27] et a conduit à une AMM avec cette dose en deuxième ligne de traitement. Le deuxième essai de phase III, positif également, a utilisé 10 mg/kg en association avec la dacarbazine, en première ligne thérapeutique. Dans le premier essai, des réinductions par un nouveau cycle de quatre injections séparées de trois semaines étaient effectuées chez les patients dont la maladie avait progressé après un bénéfice initial du traitement. Dans le deuxième essai, on proposait des injections de consolidation (10 mg/kg tous les trois mois) tant qu’un bénéfice était détectable chez les patients. Il n’en reste pas moins qu’on ne sait pas à l’heure actuelle quelles doses sont optimales ni quelle modalité de traitement d’entretien doit être privilégiée. Nous manquons cruellement de biomarqueurs prédictifs ou précoces d’efficacité car il ne faut pas oublier que les réponses, même si elles sont intéressantes car prolongées, sont rares et ne concernent que 10 % à 20 % des patients. La recherche de paramètres biologiques permettant une sélection préalable au traitement ou même accessible précocement après le début du traitement serait donc extrêmement utile. Des biopsies tumorales effectuées avant et au cours du traitement par ipilimumab ont suggéré une relation entre le bénéfice clinique et le niveau d’expression de FoxP3, molécule exprimée par les lymphocytes T régulateurs, ainsi que le taux de l’enzyme 2,3 indoleamine dioxygénase qui a un effet pro-apoptotique sur les lymphocytes T. On retrouvait aussi un lien entre la réponse au traitement et l’infiltrat lymphocytaire T intratumoral [27,
40]. Ces études sont intéressantes sur le plan mécanistique mais ne sont pas utiles en pratique clinique quotidienne. On recherche donc des marqueurs périphériques accessibles. Le taux de lymphocytes CD4 circulants exprimant ICOS (inducible costimulator) semble augmenter chez les patients répondant à l’ipilimumab, plus que chez les non-répondeurs [
41]. Plus simple encore, le nombre absolu de lymphocytes après quelques semaines de traitement pourrait être un marqueur prédictif d’efficacité. Un taux de lymphocytes supérieur ou égal à 1000 par mm3 après sept semaines de traitement serait associé à un bénéfice thérapeutique [
42]. Avec le tremelimumab, une analyse rétrospective portant sur les patients inclus dans l’essai de phase III tremelimumab versus chimiothérapie suggérait que le taux bas de CRP pouvait sélectionner des patients susceptibles de répondre au traitement, mais cela n’a pas encore été confirmé au cours d’une étude prospective [13]. Les interactions entre la tumeur et l’hôte restent obscures mais il est aussi possible que la sensibilité d’un patient à l’ipilimumab ne soit pas liée à la tumeur elle-même mais plutôt aux caractéristiques constitutionnelles du patient, comme un polymorphisme du gène codant pour CTLA-4 [
43] ou d’un autre gène intervenant dans la réponse immune. |
Dans le mélanome Les résultats précoces et prometteurs des premières études utilisant les Acm anti-CTLA-4 ont suscité beaucoup d’espoir et des études en situation adjuvante ont débuté alors que les résultats des études de phase III n’étaient pas encore connus. Ainsi, une étude coordonnée par l’EORTC 5 (EORTC-18071) est en cours depuis 2008. Elle évalue l’intérêt de l’ipilimumab versus placebo chez les patients atteints de mélanome de stade III après évidement ganglionnaire. Une autre étude intergroupe américaine explore actuellement l’efficacité du tremelimumab versus placebo en adjuvant dans les stades d’envahissement ganglionnaire et métastatique opérables. Une autre étude va également débuter comparant l’ipilimumab à l’interféron à haute dose dans les mélanomes de stade III opérés. Dans les autres cancers Il n’y a pas de raison pour que l’ipilimumab, qui est une immunothérapie non spécifique, n’ait pas d’efficacité. De fait, cet Acm est actuellement testé dans de nombreuses autres indications, tumeurs solides et hémopathies 6,. Les essais les plus avancés concernent les hémopathies et le cancer de prostate [ 19, 42]. |
Nous avons fait un pas de géant dans la prise en charge du mélanome métastatique avec l’émergence d’une nouvelle immunothérapie entraînant un gain de survie statistiquement significatif alors que ce bénéfice n’avait encore jamais été démontré pour aucun des traitements utilisés dans cette maladie. Les réponses sont peu fréquentes, et surviennent chez moins de 20 % des patients, mais elles sont souvent prolongées. Parallèlement au développement de cette nouvelle immunothérapie, nous devons définir de nouveaux critères d’évaluation afin de ne pas méconnaître des effets bénéfiques mais retardés du traitement. Nous apprenons aussi à prévenir et traiter les effets secondaires d’ordre immunologique qui peuvent survenir. Il nous manque aujourd’hui les marqueurs biologiques permettant d’optimiser les schémas thérapeutiques et de sélectionner les patients répondeurs et ceux qui risquent de développer des effets secondaires graves. Les réponses thérapeutiques rares mais durables de l’ipilimumab s’opposent aux bénéfices rapides mais de plus courte durée des médicaments ciblés comme les anti-BRAF ou les anti-KIT7 et il semble extrêmement logique de combiner ces deux approches thérapeutique et de proposer aux patients atteints de mélanome métastatique l’association d’un médicament ciblé et d’une immunothérapie par ipilimumab. Conflit d’intérêts
C. Robert déclare avoir participé à des interventions ponctuelles pour l’entreprise BMS. C. Mateus déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Luo
J
,
Solimini
NL
,
Elledge
SJ.
Principles of cancer therapy : oncogene and non-oncogene addiction . Cell.
2009; ; 136 : :823.–837. 2.
Waldmann
TA.
Immunotherapy : past, present and future . Nat Med.
2003; ; 9 : :269.–277. 3.
Van Leeuwen
MT
,
Webster
AC
,
McCredie
MRE
, et al.
Effect of reduced immunosuppression after kidney transplant failure on risk of cancer: population based retrospective cohort study . Br Med J .
2010; ; 340 : :c570.. 4.
Lee
CC
,
Faries
MB
,
Wanek
LA
,
Morton
DL.
Improved survival for stage IV melanoma from an unknown primary site . J Clin Oncol.
2009; ; 27 : :3489.–3495. 5.
Krauze
MT
,
Tarhini
A
,
Gogas
H
,
Kirkwood
JM.
Prognostic significance of autoimmunity during treatment of melanoma with interferon . Semin Immunopathol.
2011; ; 33 : :385.–391. 6.
Rosenberg
SA
,
Restifo
NP
,
Yang
JC
, et al.
Adoptive cell transfer: a clinical path to effective cancer immunotherapy . Nat Rev Cancer.
2008; ; 8 : :299.–308. 7.
Rosenberg
SA
,
Yang
JC
,
Restifo
NP.
Cancer immunotherapy: moving beyond current vaccines . Nat Med.
2004; ; 10 : :909.–915. 8.
Leach
DR
,
Krummel
MF
,
Allison
JP.
Enhancement of antitumor immunity by CTLA-4 blockade . Science.
1996; ; 271 : :1734.–1736. 9.
Ribas
A
,
Camacho
LH
,
Lopez-Berestein
G
, et al.
Antitumor activity in melanoma and anti-self responses in a phase I trial with the anti-cytotoxic T lymphocyte-associated antigen 4 monoclonal antibody CP-675, 206 . J Clin Oncol.
2005; ; 23 : :8968.–8977. 10.
Kirkwood
JM
,
Lorigan
P
,
Hersey
P
, et al.
Phase II trial of tremelimumab (CP-675, 206) in patients with advanced refractory or relapsed melanoma . Clin Cancer Res.
2010; ; 16 : :1042.–1048. 11.
Ribas
A.
Clinical development of the anti-CTLA-4 antibody tremelimumab . Semin Oncol.
2010; ; 37 : :450.–454. 12.
Ribas
A
,
Hauschild
A
,
Kefford
R.
Phase III, open-label, randomized, comparative study of tremelimumab(CP-675, 206) and chemotherapy (temozolomide or dacarbazine) in patients with advanced melanoma . J Clin Oncol.
2008; ; 26 : :15S.
(LBA9011 abstract).. 13.
Marshall
MA
,
Ribas
A
,
Huang
B.
Evaluation of baselineserum C-reactive protein and benefit from tremelimumabcompared to chemotherapy in first-line melanoma . J Clin Oncol.
2010; ; 28 : :15S.
(2609 abstract).. 14.
Ménard
C
,
Ghiringhelli
F
,
Roux
S
, et al.
Ctla-4 blockade confers lymphocyte resistance to regulatory T-cells in advanced melanoma : surrogate marker of efficacy of tremelimumab?
Clin Cancer Res.
2008; ; 14 : :5242.–5249. 15.
Ribas
A
,
Comin-Anduix
B
,
Chmielowski
B
, et al.
Dendritic cell vaccination combined with CTLA4 blockade in patients with metastatic melanoma . Clin Cancer Res.
2009; ; 15 : :6267.–6276. 16.
Attia
P
,
Phan
GQ
,
Maker
AV
, et al.
Autoimmunity correlates with tumor regression in patients with metastatic melanoma treated with anti-cytotoxic T-lymphocyte antigen-4 . J Clin Oncol.
2005; ; 23 : :6043.–6053. 17.
Downey
SG
,
Klapper
JA
,
Smith
FO
, et al.
Prognostic factors related to clinical response in patients with metastatic melanoma treated by CTL-associated antigen-4 blockade . Clin Cancer Res.
2007; ; 13 : :6681.–6688. 18.
Hersh
EM
,
O’Day
SJ
,
Powderly
J
, et al.
A phase II multicenter study of ipilimumab with or without dacarbazine in chemotherapy-naïve patients with advanced melanoma . Invest New Drugs.
2011; ; 28 : :489.–498. 19.
Hodi
FS
,
Butler
M
,
Oble
DA
, et al.
Immunologic and clinical effects of antibody blockade of cytotoxic T lymphocyte-associated antigen 4 in previously vaccinated cancer patients . Proc Natl Acad Sci USA.
2008; ; 105 : :3005.–3010. 20.
Maker
AV
,
Phan
GQ
,
Attia
P
, et al.
Tumor regression and autoimmunity in patients treated with cytotoxic T lymphocyte-associated antigen 4 blockade and interleukin 2: a phase I/II study . Ann Surg Oncol.
2005; ; 12 : :1005.–1016. 21.
O’Day
SJ
,
Maio
M
,
Chiarion-Sileni
V
, et al.
Efficacy and safety of ipilimumab monotherapy in patients with pretreated advanced melanoma : a multicenter single-arm phase II study . Ann Oncol.
2010; ; 21 : :1712.–1717. 22.
Phan
GQ
,
Yang
JC
,
Sherry
RM
, et al.
Cancer regression and autoimmunity induced by cytotoxic T lymphocyte-associated antigen 4 blockade in patients with metastatic melanoma . Proc Natl Acad Sci USA.
2003; ; 100 : :8372.–8377. 23.
Sarnaik
AA
,
Yu
B
,
Yu
D
, et al.
Extended dose ipilimumab with a peptide vaccine : immune correlates associated with clinical benefit in patients with resected high-risk stage IIIc/IV melanoma . Clin Cancer Res.
2011; ; 17 : :896.–906. 24.
Weber
JS
,
O’Day
S
,
Urba
W
, et al.
Phase I/II study of ipilimumab for patients with metastatic melanoma . J Clin Oncol.
2008; ; 26 : :5950.–5956. 25.
Weber
J
,
Thompson
JA
,
Hamid
O
, et al.
A randomized, double-blind, placebo-controlled, phase II study comparing the tolerability and efficacy of ipilimumab administered with or without prophylactic budesonide in patients with unresectable stage III or IV melanoma . Clin Cancer Res.
2009; ; 15 : :5591.–5598. 26.
Wolchok
JD
,
Neyns
B
,
Linette
G
, et al.
Ipilimumab monotherapy in patients with pretreated advanced melanoma : a randomised, double-blind, multicentre, phase 2, dose-ranging study . Lancet Oncol.
2010; ; 11 : :155.–164. 27.
Hodi
FS
,
O’Day
SJ
,
McDermott
DF
, et al.
Improved survival with ipilimumab in patients with metastatic melanoma . N Engl J Med.
2010; ; 363 : :711.–723. 28.
Robert
C
,
Thomas
L
,
Bondarenko
I
, et al.
Ipilimumab plus dacarbazine for previously untreated metastatic melanoma . N Engl J Med.
2011; ; 364 : :2517.–2526. 29.
Hodi
FS
,
Oble
DA
,
Drappatz
J
, et al.
CTLA-4 blockade with ipilimumab induces significant clinical benefit in a female with melanoma metastases to the CNS . Nat Clin Pract Oncol.
2008; ; 5 : :557.–561. 30.
Schartz
NEC
,
Farges
C
,
Madelaine
I
, et al.
Complete regression of a previously untreated melanoma brain metastasis with ipilimumab . Melanoma Res.
2010; ; 20 : :247.–250. 31.
Di Giacomo
AM
,
Danielli
R
,
Calabrò
L
, et al.
Ipilimumab experience in heavily pretreated patients with melanoma in an expanded access program at the University Hospital of Siena (Italy) . Cancer Immunol Immunother.
2011; ; 60 : :467.–477. 32.
Waterhouse
P
,
Penninger
JM
,
Timms
E
, et al.
Lymphoproliferative disorders with early lethality in mice deficient in Ctla-4 . Science.
1995; ; 270 : :985.–988. 33.
Sanderson
K
,
Scotland
R
,
Lee
P
, et al.
Autoimmunity in a phase I trial of a fully human anti-cytotoxic T-lymphocyte antigen-4 monoclonal antibody with multiple melanoma peptides and Montanide ISA 51 for patients with resected stages III and IV melanoma . J Clin Oncol.
2005; ; 23 : :741.–750. 34.
Beck
KE
,
Blansfield
JA
,
Tran
KQ
, et al.
Enterocolitis in patients with cancer after antibody blockade of cytotoxic T-lymphocyte-associated antigen 4 . J Clin Oncol.
2006; ; 24 : :2283.–2289. 35.
Smith
FO
,
Goff
SL
,
Klapper
JA
, et al.
Risk of bowel perforation in patients receiving interleukin-2 after therapy with anti-CTLA 4 monoclonal antibody . J Immunother.
2007; ; 30 : :130.. 36.
Berman
D
,
Parker
SM
,
Siegel
J
, et al., Blockade of cytotoxic T-lymphocyte antigen-4 by ipilimumab results in dysregulation of gastrointestinal immunity in patients with advanced melanoma . Cancer Immun.
2010; ; 10 : :11.. 37.
Harmankaya
K
,
Erasim
C
,
Koelblinger
C
, et al.
Continuous systemic corticosteroids do not affect the ongoing regression of metastatic melanoma for more than two years following ipilimumab therapy . Med Oncol.
2010 ; 1er juillet (online).. 38.
Wolchok
JD
,
Hoos
A
,
O’Day
S
, et al.
Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria . Clin Cancer Res.
2009; ; 15 : :7412.–7420. 39.
Small
EJ
,
Tchekmedyian
NS
,
Rini
BI
, et al.
A pilot trial of CTLA-4 blockade with human anti-CTLA-4 in patients with hormone-refractory prostate cancer . Clin Cancer Res.
2007; ; 13 : :1810.–1815. 40.
Hamid
O
,
Chasalow
SD
,
Tsuchihashi
Z
, et al.
Association of baseline and on-study tumor biopsy markers with clinical activity in patients wih advanced melanoma treated with ipilimumab . J Clin Oncol.
2009; ; 27 : :15S.
(9008 abstract).. 41.
Liakou
CI
,
Kamat
A
,
Tang
DN
, et al.
CTLA-4 blockade increases IFNgamma-producing CD4+ICOShi cells to shift the ratio of effector to regulatory T cells in cancer patients . Proc Natl Acad Sci USA.
2008; ; 105 : :14987.–14992. 42.
Ku
GY
,
Yuan
J
,
Page
DB
, et al.
Single-institution experience with ipilimumab in advanced melanoma patients in the compassionate use setting : lymphocyte count after 2 doses correlates with survival . Cancer.
2010; ; 116 : :1767.–1775. 43.
Breunis
WB
,
Tarazona-Santos
E
,
Chen
R
, et al.
Influence of cytotoxic T lymphocyte-associated antigen 4 (CTLA4) common polymorphisms on outcome in treatment of melanoma patients with CTLA-4 blockade . J Immunother.
2008; ; 31 : :586.–590. 44.
Camacho
LH
,
Antonia
S
,
Sosman
J
, et al.
Phase I/II trial of tremelimumab in patients with metastatic melanoma . J Clin Oncol.
2009; ; 27 : :1075.–1081. 45.
Dumaz
N
,
Bagot
M
,
Bensussan
A.
Quand CRAF remplace BRAF dans le mélanome . Med Sci (Paris).
2011; ; 27 : :817.–819. 46.
Olive
D
,
Le Thi
S
,
Xerri
L
, et al.
Rôle de CTLA-4 dans la cosignalisation négative du système immunitaire . Med Sci (Paris).
2011; ; 27 : :842.–849. 47.
Rousseaux
S
,
Reynoird
N
,
Gaucher
J
,
Khochbin
S.
L’intrusion des régulateurs de l’épigénome mâle dans les cellules somatiques cancéreuses . Med Sci (Paris).
2008; ; 24 : :735.–741. 48.
Tartour
E
,
Sandoval
F
,
Bonnefoy
JY
,
Fridman
WH.
Immunothérapie des cancers : succès récents et perspectives . Med Sci (Paris).
2011; ; 27 : :833.–841. 49.
Anticorps monoclonaux en thérapeutique . Med Sci (Paris).
2009; ; 25 : :995.–1196. |