| |
| Med Sci (Paris). 2011 November; 27(11): 929–931. Published online 2011 November 30. doi: 10.1051/medsci/20112711005.Sésame, ouvre-toi Régulation de l’entrée du virus de l’hépatite C dans les hépatocytes Marine Turek,1,2 Joachim Lupberger,1,2 Thomas F. Baumert,1,2,3* and Mirjam B. Zeisel1,2** 1Inserm, U748, 67000Strasbourg, France 2Université de Strasbourg, France 3Pôle hépato-digestif, Hôpitaux universitaires de Strasbourg, France MeSH keywords: Antiviraux, classification, usage thérapeutique, Repositionnement des médicaments, Hepacivirus, physiologie, Hépatocytes, virologie, Humains, Modèles biologiques, Inhibiteurs de protéines kinases, Protein kinases, métabolisme, Pénétration virale, Esprit et humour comme sujet |
L’infection par le virus de l’hépatite C (VHC) touche environ 170 millions de personnes dans le monde et représente donc un problème majeur de santé publique. L’hépatite C est une maladie progressive : la phase aiguë évolue le plus souvent vers une hépatite chronique, qui peut conduire dans 20 % des cas vers une cirrhose, puis vers un carcinome hépatocellulaire. La cirrhose et le carcinome hépatocellulaire associés au VHC sont les indications majeures de transplantation hépatique [
1]. Il n’existe à ce jour pas de vaccin et les options thérapeutiques actuelles ne permettent pas d’éradiquer le virus chez tous les patients. Le VHC est un virus enveloppé à ARN simple brin de polarité positive. Son tropisme est essentiellement restreint aux hépatocytes [
2]. L’entrée virale, qui fait intervenir les glycoprotéines d’enveloppe du virus et plusieurs facteurs de l’hôte, est nécessaire à l’initiation, la dissémination et la pérennisation de l’infection. Cette étape du cycle viral représente ainsi une cible prometteuse pour le développement de nouvelles stratégies antivirales [
3]. |
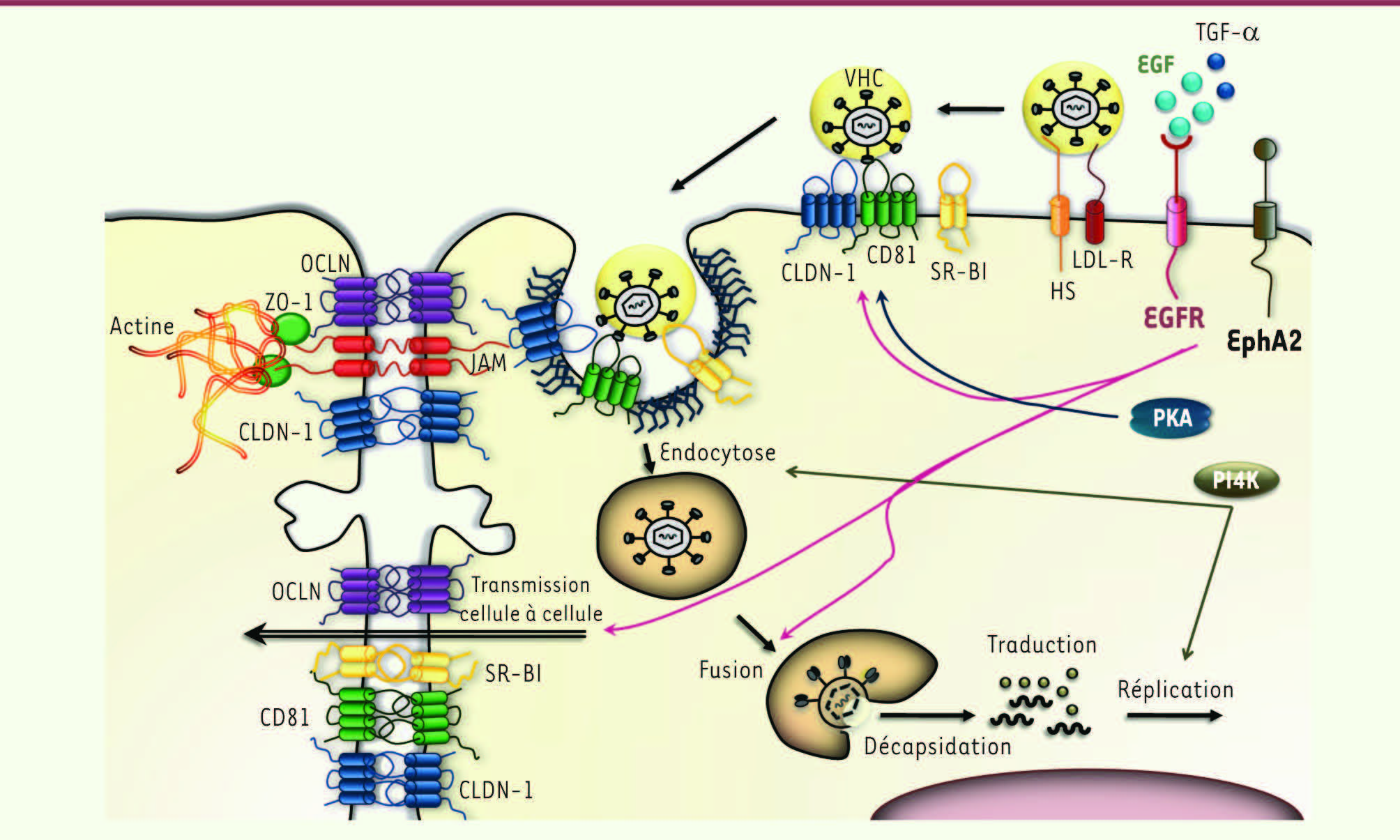
L’entrée du VHC dans les hépatocytes : régulation par les protéine kinases Au cours des dernières années, de nombreux facteurs de l’hôte impliqués dans l’entrée du VHC ont été découverts : les héparanes sulfates, le récepteur des LDL (low density lipoproteins), la tétraspanine CD81, le récepteur scavenger BI (SR-BI) et les protéines de jonction claudine-1 (CLDN-1) et occludine (OCLN) [3,
4]. L’entrée du virus dans l’hépatocyte est un processus complexe et multifactoriel. Les données expérimentales suggèrent que le VHC, associé aux lipoprotéines, s’attache dans un premier temps aux héparanes sulfates et au récepteur des LDL, permettant ainsi de concentrer le virus à la surface des hépatocytes, avant d’interagir de manière directe ou indirecte avec les facteurs d’entrée tels que SR-BI, CD81, CLDN-1 et OCLN. Ce processus fait intervenir l’association entre CD81 et CLDN-1 [
5,
6] et résulte en l’internalisation du virus par un processus d’endocytose dépendant de la clathrine [
7]. Cependant la séquence exacte des événements conduisant à l’internalisation du virus et les mécanismes régulant le fonctionnement de ses facteurs d’entrée ne sont pas encore élucidés. Différents groupes ont ainsi commencé à étudier l’implication de protéines kinases dans le processus d’entrée du VHC. En effet, les protéines kinases sont des protéines-clés de la régulation de nombreux processus cellulaires qui peuvent également contribuer à l’internalisation de différents virus [
8]. La protéine kinase A (PKA) fut la première protéine kinase dont l’implication dans l’entrée du VHC a été identifiée [
9]. L’utilisation d’un inhibiteur de PKA a permis de montrer que l’inhibition de l’activité kinase de la PKA conduit à une localisation intracellulaire de la CLDN-1 et une diminution concomitante de l’entrée du VHC. En effet, cet inhibiteur réduit l’association entre CD81 et CLDN-1 qui est essentielle à l’entrée virale, suggérant que la PKA favorise l’association entre ces deux corécepteurs. Cependant, ceci ne semble pas faire intervenir une phosphorylation directe de ces récepteurs par la PKA. Outre le rôle de la PKA dans l’entrée du VHC, il a été montré que l’infection par le VHC conduit à une augmentation de l’activité de cette kinase, ce qui pourrait favoriser la dissémination du virus [9]. Le développement de criblages fonctionnels basés sur l’ARN interférence a représenté une avancée considérable dans la découverte de nouvelles interactions entre des virus et leurs cellules hôtes [8]. Au cours de ces dernières années, de tels criblages ont été effectués afin de découvrir des facteurs fonctionnels de l’hôte indispensables pour l’entrée du VHC et pouvant constituer de nouvelles cibles pour de futurs antiviraux [
10,
11]. Ces criblages ont permis d’identifier plusieurs autres protéine kinases impliquées dans l’entrée du VHC. Une première étude qui s’est concentrée sur les processus de remodelage et trafic membranaires a montré que les phosphatidylinositol 4-kinases de type III alpha (PI4KIIIα) et bêta (PI4KIIIβ) semblent intervenir dans l’entrée de certains génotypes du VHC [10]. De plus, la PI4KIIIα joue également un rôle dans la réplication du VHC via son activité kinase et l’interaction avec la protéine non structurale 5A du VHC [10,
12]. Cependant, les étapes de l’entrée virale faisant intervenir ces kinases et les mécanismes moléculaires sous-jacents restent à élucider. Notre propre étude, focalisée sur les protéines kinases, a permis d’identifier 58 de ces molécules qui sont impliquées dans l’entrée du VHC et de préciser le rôle de deux récepteurs à activité tyrosine kinase : le récepteur du facteur de croissance épidermique (EGFR) et l’éphrine A2 (EphA2). Tous deux sont des récepteurs membranaires à activité tyrosine kinase fortement exprimés dans le foie [11]. Ces kinases semblent jouer un rôle au cours de différentes étapes de l’entrée du VHC. Bien qu’exprimés au niveau membranaire, l’EGFR et l’EphA2 semblent ne pas intervenir directement dans la liaison du VHC à sa cellule hôte mais plutôt dans des étapes suivant l’attachement du virus. En effet, nous avons montré que l’activité kinase de ces deux protéines favorise l’association CD81-CLDN-1 indispensable à l’internalisation du virus. De plus, l’EGFR et l’EphA2 jouent un rôle lors de l’étape de fusion membranaire faisant intervenir les glycoprotéines d’enveloppe du VHC. Enfin, ces deux protéines kinases interviennent dans la transmission du virus de cellule à cellule indiquant qu’elles favorisent la dissémination du virus [11]. L’ensemble de ces études suggère que plusieurs protéines kinases interviennent à différentes étapes de l’entrée du VHC dans les hépatocytes et plus particulièrement lors de l’association du complexe CD81-CLDN-1, la fusion membranaire et la transmission du virus de cellule à cellule (Figure 1).
 | Figure 1
Étapes de l’infection cellulaire par le VHC. L’entrée et la dissémination du VHC dans les hépatocytes sont schématisées. Le VHC interagit dans un premier temps avec les héparanes sulfates et le récepteur des LDL afin de permettre la concentration du virus à la surface des hépatocytes. Par la suite, l’interaction avec d’autres facteurs de l’hôte tels que SR-BI, CD81, CLDN-1 et OCLN entraîne l’internalisation du virus par endocytose clathrine-dépendante. À la suite de l’étape de fusion membranaire entre le virus et l’endosome, le génome viral est libéré dans le cytosol. Après traduction et réplication, les particules virales sont assemblées et sécrétées hors de la cellule hôte. Cette dissémination du virus pourra se faire par transmission de cellule à cellule. Des protéine kinases, telles que l’EGFR, l’EphA2, la PKA et la PI4 K, interviennent à différentes étapes de l’entrée du VHC dans les hépatocytes, en particulier lors de l’association du complexe CD81-CLDN-1, au cours de la fusion membranaire et de la transmission cellule à cellule. EGFR : récepteur du facteur de croissance épidermique; EphA2 : éphrine A2; CLDN-1 : claudine 1; CD81 : cluster de différenciation 81; OCLN : occludine; SR-BI : récepteur scavenger BI; VHC : virus de l’hépatite C; HS : héparane sulfate; JAM : molécule d’adhésion associée à la jonction; LDL-R : récepteur des LDL; PI4 K : phosphatidylinositol 4-kinase; PKA : protéine kinase A; ZO-1 : protéine de jonction serrée ( zonula occludens) (adapté de [ 3,
13]). |
|
Les inhibiteurs de protéine kinases : vers une nouvelle classe d’antiviraux ? Outre leur effet sur l’infection par le VHC in vitro, des inhibiteurs de la PKA, de l’EGFR et de l’EphA2 pourraient avoir un potentiel dans la prévention de l’infection par le VHC in vivo. Différents inhibiteurs de protéines kinases sont actuellement administrés dans le traitement de certains cancers mais leur utilisation dans d’autres indications serait envisageable. Ainsi, il est intéressant de noter que l’erlotinib, inhibiteur de l’EGFR utilisé dans le traitement du cancer du poumon, permet de ralentir et de diminuer l’infection de souris par le VHC [9]. Ceci suggère que des protéines kinases pourraient constituer des cibles antivirales intéressantes dans la prévention et/ou le traitement de l’infection par le VHC. Une meilleure caractérisation des interactions entre le VHC et les protéines kinases permettra peut-être de développer de nouvelles stratégies antivirales, par exemple de nouveaux anticorps monoclonaux ou de petites molécules inhibitrices, pour prévenir et traiter l’infection par le VHC à l’avenir. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient l’Union Européenne (ERC-2008-AdG-233130-HEPCENT et INTERREG-IV-2009-FEDER-Hepato-Regio-Net), l’ANRS (2011/132), l’Inserm, l’Université de Strasbourg et les Hôpitaux universitaires de Strasbourg pour leur soutien.
|
1.
Duclos-Vallée
JC
,
Teicher
E
,
Vittecoq
D
,
Samuel
D
. La transplantation hépatique chez les patients co-infectés VIH/VHC et VIH/VHB . Med Sci (Paris).
2007; ; 23 : :723.–728. 2.
Lindenbach
BD
,
Thiel
HJ
,
Rice
CM
. Flaviviridae. , the viruses and their replication . Philadelphia: : Lippincott-Raven; , 2007 : :1101.–1152. 3.
Zeisel
MB
,
Fofana
I
,
Fafi-Kremer
S
, et al.
Hepatitis C virus entry into hepatocytes: molecular mechanisms and targets for antiviral therapies . J Hepatol.
2011; ; 54 : :566.–576. 4.
Tews
BA
,
Cocquerel
L
. Occludine, une clé de plus pour l’entrée du virus de l’hépatite C . Med Sci (Paris).
2009; ; 25 : :549.–551. 5.
Harris
HJ
,
Farquhar
MJ
,
Mee
CJ
, et al.
CD81 and claudin 1 coreceptor association: role in hepatitis C virus entry . J Virol.
2008; ; 82 : :5007.–5020. 6.
Krieger
SE
,
Zeisel
MB
,
Davis
C
, et al.
Inhibition of hepatitis C virus infection by anti-claudin-1 antibodies is mediated by neutralization of E2-CD81-claudin-1 associations . Hepatology.
2010; ; 51 : :1144.–1157. 7.
Blanchard
E
,
Belouzard
S
,
Goueslain
L
, et al.
Hepatitis C virus entry depends on clathrin-mediated endocytosis . J Virol.
2006; ; 80 : :6964.–6972. 8.
Pelkmans
L
,
Fava
E
,
Grabner
H
, et al.
Genome-wide analysis of human kinases in clathrin- and caveolae/raft-mediated endocytosis . Nature.
2005; ; 436 : :78.–86. 9.
Farquhar
MJ
,
Harris
HJ
,
Diskar
M
, et al.
Protein kinase A-dependent step(s) in hepatitis C virus entry and infectivity . J Virol.
2008; ; 82 : :8797.–8811. 10.
Trotard
M
,
Lepère-Douard
C
,
Régeard
M
, et al.
Kinases required in hepatitis C virus entry and replication highlighted by small interference RNA screening . FASEB J.
2009; ; 23 : :3780.–3789. 11.
Lupberger
J
,
Zeisel
MB
,
Xiao
F
, et al.
EGFR and EphA2 are host factors for hepatitis C virus entry and possible targets for antiviral therapy . Nat Med.
2011; ; 17 : :589.–595. 12.
Reiss
S
,
Rebhan
I
,
Backes
P
, et al.
Recruitment and activation of a lipid kinase by hepatitis C virus NS5A is essential for integrity of the membranous replication compartment . Cell Host Microbe.
2011; ; 9 : :32.–45. 13.
Gerold
G
,
Rice
CM
. Locking out hepatitis C . Nat Med.
2011; ; 17 : :542.–544. |