| |
| Med Sci (Paris). 2011 December; 27(12): 1045–1047. Published online 2011 December 23. doi: 10.1051/medsci/20112712002.Un mécanisme original de perception d’un ion minéral (le nitrate) Histoire de la découverte chez les plantes et perspectives Gabriel Krouk1* and Alain Gojon1 1Biochimie et physiologie moléculaire des plantes, UMR 5004 CNRS/INRA/SupAgro/UM2, Institut de biologie intégrative des plantes-Claude Grignon, place Viala, 34060Montpellier Cedex 1, France |
On sait depuis près de 20 ans que cette réponse adaptative met en jeu des systèmes de perception spécifiques des différents ions, permettant aux plantes de les détecter et les localiser dans le milieu. Cependant, les mécanismes moléculaires associés à ces systèmes de perception et impliqués dans les réponses de développement restaient largement inconnus. Notre travail a permis de mettre en évidence le rôle essentiel de la protéine NRT1.1 (un transporteur membranaire de  dans le contrôle de la croissance de la plante en fonction de la disponibilité externe en dans le contrôle de la croissance de la plante en fonction de la disponibilité externe en  . De manière originale, le mécanisme de perception du . De manière originale, le mécanisme de perception du  par NRT1.1 met en jeu une particularité fonctionnelle de cette protéine tout à fait inattendue. par NRT1.1 met en jeu une particularité fonctionnelle de cette protéine tout à fait inattendue.
 | Figure 1
Illustration de la croissance adaptative des racines des plantes. Quand les racines de plantes rencontrent une zone du sol riche en  , elles ont la capacité de modifier leur développement pour la coloniser préférentiellement. Le mécanisme décrit dans cet article, mettant en jeu le transporteur de  NRT1.1, explique les mécanismes moléculaires de cette réponse adaptative. |
|
NRT1.1, un transporteur de (NO 3
−) pas comme les autres |
L’hypothèse : NRT1.1 contrôle le transport d’une hormone végétale, l’auxine En plus des phénotypes inexpliqués des mutants chl1, deux éléments d’information ont permis de diriger les recherches pour élucider le mécanisme de signalisation dépendant de NRT1.1. Premièrement, NRT1.1 appartient à une famille de transporteurs (nommée PTR pour peptide transporter), dont la spécificité de substrat n’est pas stricte. Par exemple, les plus proches homologues caractérisés de NRT1.1 sont : (1) une protéine du colza (Brassica napus), BnNRT1.2, capable de transporter aussi bien des acides aminés comme l’histidine ou la lysine que du  ; (2) une protéine de l’aulne glutineux1 (Alnus glutinosa), capable de transporter différents acides organiques comme le malate ou le succinate. Ceci suggérait que NRT1.1 puisse également transporter d’autres solutés que du ; (2) une protéine de l’aulne glutineux1 (Alnus glutinosa), capable de transporter différents acides organiques comme le malate ou le succinate. Ceci suggérait que NRT1.1 puisse également transporter d’autres solutés que du  , notamment des acides organiques ou aminés. , notamment des acides organiques ou aminés. Deuxièmement, un acide organique particulier, structurellement proche de l’acide aminé tryptophane, est l’acide indole acétique (AIA), hormone végétale connue sous le nom d’auxine. L’auxine est un puissant morphogène qui joue un rôle central dans le contrôle du développement et de la différenciation cellulaire, notamment au niveau des racines latérales. En effet, le développement des primordia de racines latérales nécessite l’établissement et le maintien d’un gradient de concentration d’auxine (avec un maximum à l’apex des primordia) [
6]. Dans les racines, comme dans les feuilles, ce gradient local dépend de l’activité de transporteurs spécifiques, qui canalisent l’hormone vers l’apex du primordium, ou au contraire l’en éloignent [6]. Ces considérations, et la constatation que NRT1.1 contrôle la croissance des racines latérales en réponse au  [5], nous ont tout naturellement conduit à suggérer que NRT1.1 pourrait être un transporteur d’auxine. Cette hypothèse a été testée en système hétérologue (ovocytes de xénope, levure) ainsi que dans la plante. Dans tous les cas, nous avons montré que NRT1.1 facilite effectivement le transport de l’auxine. Mais cela ne suffisait pas à expliquer le lien avec le rôle de perception du [5], nous ont tout naturellement conduit à suggérer que NRT1.1 pourrait être un transporteur d’auxine. Cette hypothèse a été testée en système hétérologue (ovocytes de xénope, levure) ainsi que dans la plante. Dans tous les cas, nous avons montré que NRT1.1 facilite effectivement le transport de l’auxine. Mais cela ne suffisait pas à expliquer le lien avec le rôle de perception du  joué par cette protéine. Ce n’est que lors des mesures de transport d’auxine en présence de joué par cette protéine. Ce n’est que lors des mesures de transport d’auxine en présence de  (les deux substrats connus de NRT1.1) que nous avons observé que le (les deux substrats connus de NRT1.1) que nous avons observé que le  inhibe le transport d’auxine assuré par NRT1.1 (Figure 2A). inhibe le transport d’auxine assuré par NRT1.1 (Figure 2A).
 | Figure 2
Rôle de la protéine NRT1.1 dans le contrôle de l’homéostasie de l’auxine et de la croissance des racines latérales. A. Au niveau cellulaire, NRT1.1 facilite le transport de l’auxine. Ce transport est inhibé par les fortes concentrations de  dans le milieu. B. Au niveau tissulaire, NRT1.1 est impliquée dans le reflux de l’auxine hors de la jeune racine latérale vers la racine principale. Le transport d’auxine dépendant de NRT1.1 est inhibé par le  , ce qui a pour conséquence de bloquer l’auxine à l’apex de la racine et par conséquent de promouvoir sa croissance. Chez les plantes mutantes pour NRT1.1, l’auxine (visualisée par un gène rapporteur de son accumulation dans les tissus : coloration bleue ci-dessus) reste bloquée dans les racines latérales même en l’absence de  . |
Nous avons donc proposé le schéma suivant : NRT1.1 contrôle la croissance racinaire en réponse au  parce que son activité de transport d’auxine module l’homéostasie de l’hormone en fonction de la concentration externe en parce que son activité de transport d’auxine module l’homéostasie de l’hormone en fonction de la concentration externe en  . Ce modèle été validé in planta, par la double analyse : (1) de la localisation tissulaire de NRT1.1, qui a permis de montrer que ce transporteur est spécifiquement exprimé dans les territoires cellulaires assurant le reflux de l’auxine hors de la racine latérale vers la racine primaire (
Figure 2B
, flèches jaunes), et (2) des gradients locaux d’auxine dans les racines latérales chez les plantes sauvages et les mutants chl1. L’analyse de ces derniers a en effet révélé que la faible croissance racinaire en l’absence de . Ce modèle été validé in planta, par la double analyse : (1) de la localisation tissulaire de NRT1.1, qui a permis de montrer que ce transporteur est spécifiquement exprimé dans les territoires cellulaires assurant le reflux de l’auxine hors de la racine latérale vers la racine primaire (
Figure 2B
, flèches jaunes), et (2) des gradients locaux d’auxine dans les racines latérales chez les plantes sauvages et les mutants chl1. L’analyse de ces derniers a en effet révélé que la faible croissance racinaire en l’absence de  s’accompagne d’un défaut d’accumulation de l’hormone à l’apex des racines, et que ce défaut d’accumulation est dû à l’absence de NRT1.1 (l’auxine s’accumule fortement en l’absence de s’accompagne d’un défaut d’accumulation de l’hormone à l’apex des racines, et que ce défaut d’accumulation est dû à l’absence de NRT1.1 (l’auxine s’accumule fortement en l’absence de  chez les mutants chl1). chez les mutants chl1). |
Le modèle de perception du (NO 3
−) et du contrôle de la croissance de la racine latérale |
Ce mécanisme d’interaction entre les transports membranaires d’une hormone et d’un nutriment minéral est à notre connaissance le premier décrit. Il ouvre des perspectives en agriculture car la gestion optimisée de la croissance et de l’architecture du système racinaire des plantes cultivées est un objectif essentiel, encore peu pris en compte pour l’amélioration variétale [
9]. Par ailleurs, des protéines homologues à NRT1.1 ont été identifiées chez d’autres organismes, et chez les animaux en particulier. Du fait des proximités structurales et fonctionnelles de l’auxine et de la sérotonine [
10], il n’est donc pas impossible que la découverte de ce mécanisme puisse être transposée au domaine animal, et ait à long terme des conséquences en médecine. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Krouk
G
,
Crawford
NM
,
Coruzzi
GM
,
Tsay
YF
. Nitrate signaling: adaptation to fluctuating environments . Curr Opin Plant Biol.
2010; ; 13 : :266.–273. 2.
Drew
MC
. Comparison of the effects of a localized supply of phosphate, nitrate, ammonium and potassium on the growth of the seminal root system, and the shoot, in barley . New Phytol.
1975; ; 75 : :479.–490. 3.
Tsay
YF
,
Schroeder
JI
,
Feldmann
KA
,
Crawford
NM
. The herbicide sensitivity gene CHL1 of Arabidopsis encodes a nitrate-inducible nitrate transporter . Cell.
1993; ; 72 : :705.–713. 4.
Gojon
A
,
Krouk
G
,
Perrine-Walker
F
,
Laugier
E
. Nitrate transceptor(s) in plants . J Exp Bot.
2011; ; 62 : :2299.–2308. 5.
Remans
T
,
Nacry
P
,
Pervent
M
, et al.
The Arabidopsis NRT1.1 transporter participates in the signaling pathway triggering root colonization of nitrate-rich patches . Proc Natl Acad Sci USA.
2006; ; 103 : :19206.–19211. 6.
Benkova
E
,
Michniewicz
M
,
Sauer
M
, et al.
Local, efflux-dependent auxin gradients as a common module for plant organ formation . Cell.
2003; ; 115 : :591.–602. 7.
Hachiya
T
,
Mizokami
Y
,
Miyata
K
, et al.
Evidence for a nitrate-independent function of the nitrate sensor NRT1.1 in Arabidopsis thaliana.
J Plant Res .
2011; ; 124 : :425.–430. 8.
Krouk
G
,
Lacombe
B
,
Bielach
A
, et al.
Nitrate-regulated auxin transport by NRT1.1 defines a mechanism for nutrient sensing in plants . Dev Cell.
2010; ; 18 : :927.–937. 9.
Herder
GD
,
Van Isterdael
G
,
Beeckman
T
,
De Smet
I
. The roots of a new green revolution . Trends Plant Sci.
2010; ; 15 : :600.–607. 10.
Pelagio-Flores
R
,
Ortiz-Castro
R
,
Mendez-Bravo
A
, et al.
Serotonin, a tryptophan-derived signal conserved in plants and animals, regulates root system architecture probably acting as a natural auxin inhibitor in Arabidopsis thaliana . Plant Cell Physiol.
2011; ; 52 : :490.–508. |
 dans le contrôle de la croissance de la plante en fonction de la disponibilité externe en
dans le contrôle de la croissance de la plante en fonction de la disponibilité externe en  . De manière originale, le mécanisme de perception du
. De manière originale, le mécanisme de perception du  par NRT1.1 met en jeu une particularité fonctionnelle de cette protéine tout à fait inattendue.
par NRT1.1 met en jeu une particularité fonctionnelle de cette protéine tout à fait inattendue.
 , elles ont la capacité de modifier leur développement pour la coloniser préférentiellement. Le mécanisme décrit dans cet article, mettant en jeu le transporteur de
, elles ont la capacité de modifier leur développement pour la coloniser préférentiellement. Le mécanisme décrit dans cet article, mettant en jeu le transporteur de  NRT1.1, explique les mécanismes moléculaires de cette réponse adaptative.
NRT1.1, explique les mécanismes moléculaires de cette réponse adaptative.
 ) est un analogue toxique du
) est un analogue toxique du  utilisé comme herbicide. Les cribles génétiques chez la plante modèle Arabidopsis thaliana ont permis d’isoler des plantes mutantes résistantes, capables de survivre sur des milieux contenant du
utilisé comme herbicide. Les cribles génétiques chez la plante modèle Arabidopsis thaliana ont permis d’isoler des plantes mutantes résistantes, capables de survivre sur des milieux contenant du  . Certaines de ces plantes se sont avéré être des mutants pour NRT1.1 (appelés mutants chl1) : elles sont donc résistantes au
. Certaines de ces plantes se sont avéré être des mutants pour NRT1.1 (appelés mutants chl1) : elles sont donc résistantes au  car leurs racines ont un défaut d’absorption de
car leurs racines ont un défaut d’absorption de  .
. de NRT1.1 a été clairement établie par la suite, il est récemment apparu évident que la perte de cette seule fonction de transport de
de NRT1.1 a été clairement établie par la suite, il est récemment apparu évident que la perte de cette seule fonction de transport de  ne pouvait expliquer un certain nombre de désordres physiologiques ou développementaux affectant les mutants chl1 [
ne pouvait expliquer un certain nombre de désordres physiologiques ou développementaux affectant les mutants chl1 [
 , notamment celle correspondant à la croissance racinaire préférentielle dans les zones du milieu riches en cet ion (
, notamment celle correspondant à la croissance racinaire préférentielle dans les zones du milieu riches en cet ion ( (voir [
(voir [ ; (2) une protéine de l’aulne glutineux
; (2) une protéine de l’aulne glutineux , notamment des acides organiques ou aminés.
, notamment des acides organiques ou aminés. [
[ joué par cette protéine. Ce n’est que lors des mesures de transport d’auxine en présence de
joué par cette protéine. Ce n’est que lors des mesures de transport d’auxine en présence de  (les deux substrats connus de NRT1.1) que nous avons observé que le
(les deux substrats connus de NRT1.1) que nous avons observé que le  inhibe le transport d’auxine assuré par NRT1.1 (
inhibe le transport d’auxine assuré par NRT1.1 (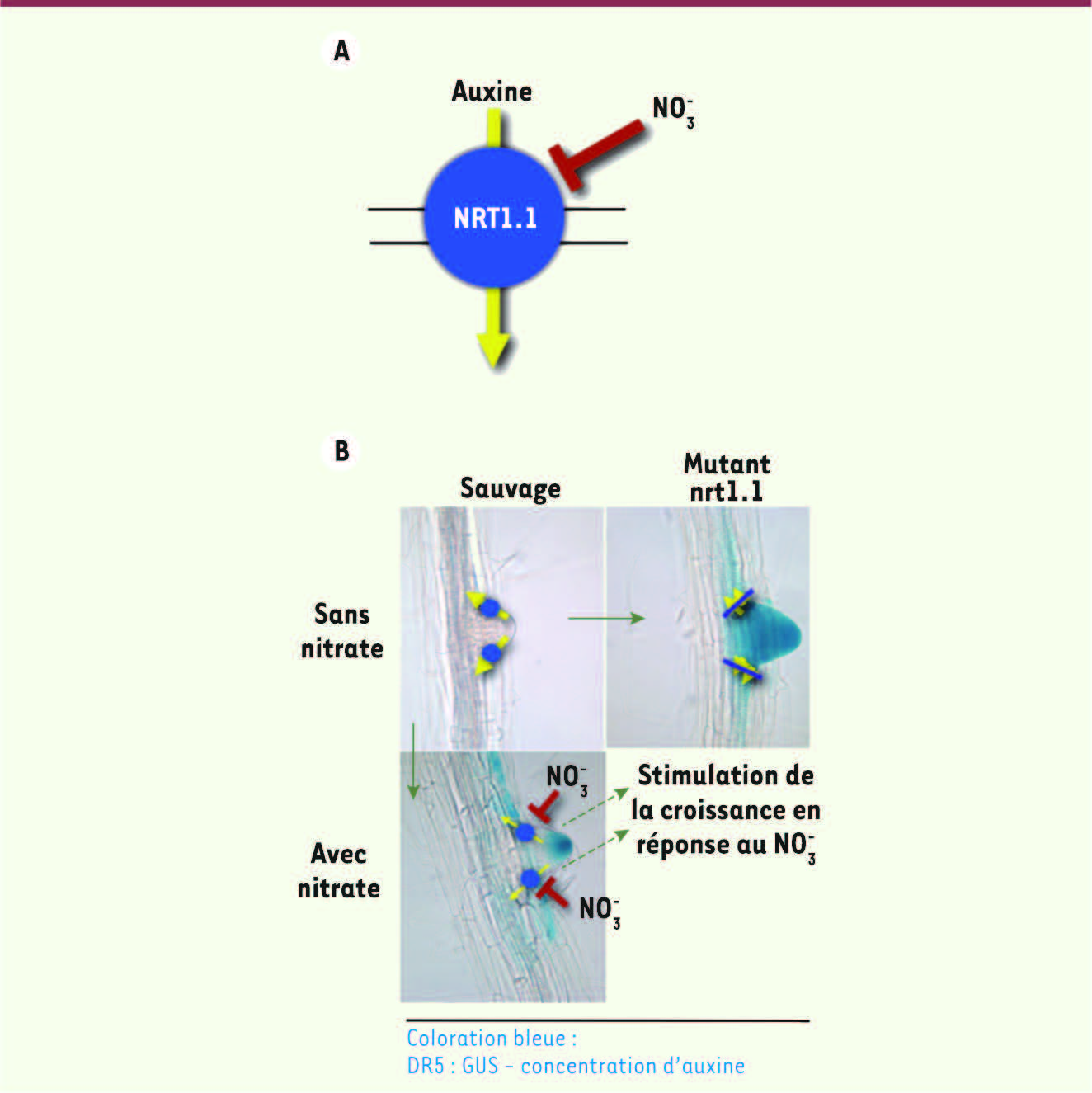
 dans le milieu. B. Au niveau tissulaire, NRT1.1 est impliquée dans le reflux de l’auxine hors de la jeune racine latérale vers la racine principale. Le transport d’auxine dépendant de NRT1.1 est inhibé par le
dans le milieu. B. Au niveau tissulaire, NRT1.1 est impliquée dans le reflux de l’auxine hors de la jeune racine latérale vers la racine principale. Le transport d’auxine dépendant de NRT1.1 est inhibé par le  , ce qui a pour conséquence de bloquer l’auxine à l’apex de la racine et par conséquent de promouvoir sa croissance. Chez les plantes mutantes pour NRT1.1, l’auxine (visualisée par un gène rapporteur de son accumulation dans les tissus : coloration bleue ci-dessus) reste bloquée dans les racines latérales même en l’absence de
, ce qui a pour conséquence de bloquer l’auxine à l’apex de la racine et par conséquent de promouvoir sa croissance. Chez les plantes mutantes pour NRT1.1, l’auxine (visualisée par un gène rapporteur de son accumulation dans les tissus : coloration bleue ci-dessus) reste bloquée dans les racines latérales même en l’absence de  .
. parce que son activité de transport d’auxine module l’homéostasie de l’hormone en fonction de la concentration externe en
parce que son activité de transport d’auxine module l’homéostasie de l’hormone en fonction de la concentration externe en  . Ce modèle été validé in planta, par la double analyse : (1) de la localisation tissulaire de NRT1.1, qui a permis de montrer que ce transporteur est spécifiquement exprimé dans les territoires cellulaires assurant le reflux de l’auxine hors de la racine latérale vers la racine primaire (
. Ce modèle été validé in planta, par la double analyse : (1) de la localisation tissulaire de NRT1.1, qui a permis de montrer que ce transporteur est spécifiquement exprimé dans les territoires cellulaires assurant le reflux de l’auxine hors de la racine latérale vers la racine primaire ( s’accompagne d’un défaut d’accumulation de l’hormone à l’apex des racines, et que ce défaut d’accumulation est dû à l’absence de NRT1.1 (l’auxine s’accumule fortement en l’absence de
s’accompagne d’un défaut d’accumulation de l’hormone à l’apex des racines, et que ce défaut d’accumulation est dû à l’absence de NRT1.1 (l’auxine s’accumule fortement en l’absence de  chez les mutants chl1).
chez les mutants chl1). . En d’autres termes, NRT1.1 transforme les variations de disponibilité externe en
. En d’autres termes, NRT1.1 transforme les variations de disponibilité externe en  en une modification des flux d’auxine au sein de l’organe.
en une modification des flux d’auxine au sein de l’organe. , NRT1.1 se comporte comme un transporteur d’auxine qui exporte l’hormone hors de la racine latérale, empêchant ainsi son accumulation à l’apex (
, NRT1.1 se comporte comme un transporteur d’auxine qui exporte l’hormone hors de la racine latérale, empêchant ainsi son accumulation à l’apex ( est localement abondant, il réprime le transport d’auxine médié par NRT1.1, ce qui a pour conséquence de favoriser l’accumulation d’auxine dans les racines latérales, et donc de stimuler la croissance de ces racines dans les milieux riches en
est localement abondant, il réprime le transport d’auxine médié par NRT1.1, ce qui a pour conséquence de favoriser l’accumulation d’auxine dans les racines latérales, et donc de stimuler la croissance de ces racines dans les milieux riches en  (
(