| |
| Med Sci (Paris). 2011 December; 27(12): 1072–1074. Published online 2011 December 23. doi: 10.1051/medsci/20112712012.La couleur du métal Brève introduction à la cytométrie de masse Antonio Cosma1,2* and Roger Le Grand1,2** 1CEA, service d’immuno-virologie, institut des maladies émergentes et thérapies innovantes (iMETI), DSV, 92260 Fontenay-aux-Roses, France 2Université Paris-Sud, UMR E1, 91400 Orsay, France MeSH keywords: Couleur, Cytométrie en flux, méthodes, Colorants fluorescents, composition chimique, pharmacologie, Humains, Métaux, Modèles biologiques, Masse moléculaire |
La réponse immune résulte de l’action concertée de partenaires cellulaires et moléculaires multiples. Le but ultime de ces interactions complexes est de défendre l’organisme vis-à-vis d’une intrusion par des pathogènes ou d’un développement tumoral. Diverses approches sont à la disposition des immunologistes pour appréhender l’extraordinaire complexité du système immunitaire. D’une manière générale, les technologies permettant la caractérisation des molécules associées à une cellule, ou produites par celle-ci, se répartissent en deux catégories : celles qui analysent un ensemble (bulk) de cellules et celles qui analysent les cellules individuellement. L’analyse en bulk n’offre qu’une valeur moyenne du paramètre mesuré pour la population cellulaire étudiée, même lorsque cette dernière est hétérogène. Les caractéristiques individuelles de chaque cellule sont ainsi perdues. Ces méthodes ont cependant l’avantage d’une meilleure sensibilité puisque la molécule d’intérêt est produite par de nombreuses cellules et donc présente en plus grande quantité dans le milieu analysé. Cependant, « lorsque l’on mesure une moyenne de différentes cellules, on n’obtient qu’une réponse moyenne » selon le chimiste Renato Zenobi de l’Institut fédéral suisse de technologie à Zurich [
1]. Autrement dit, seule l’analyse du contenu de chaque cellule prise individuellement permet d’établir le lien formel entre le produit et le type cellulaire étudié. Le niveau de résolution de l’information acquise est ainsi bien meilleur et permet d’appréhender les interactions au sein de populations cellulaires hétérogènes et complexes. Une conséquence évidente de ces approches est l’accroissement exponentiel de la quantité de données, qui requiert de puissantes capacités d’analyse. |
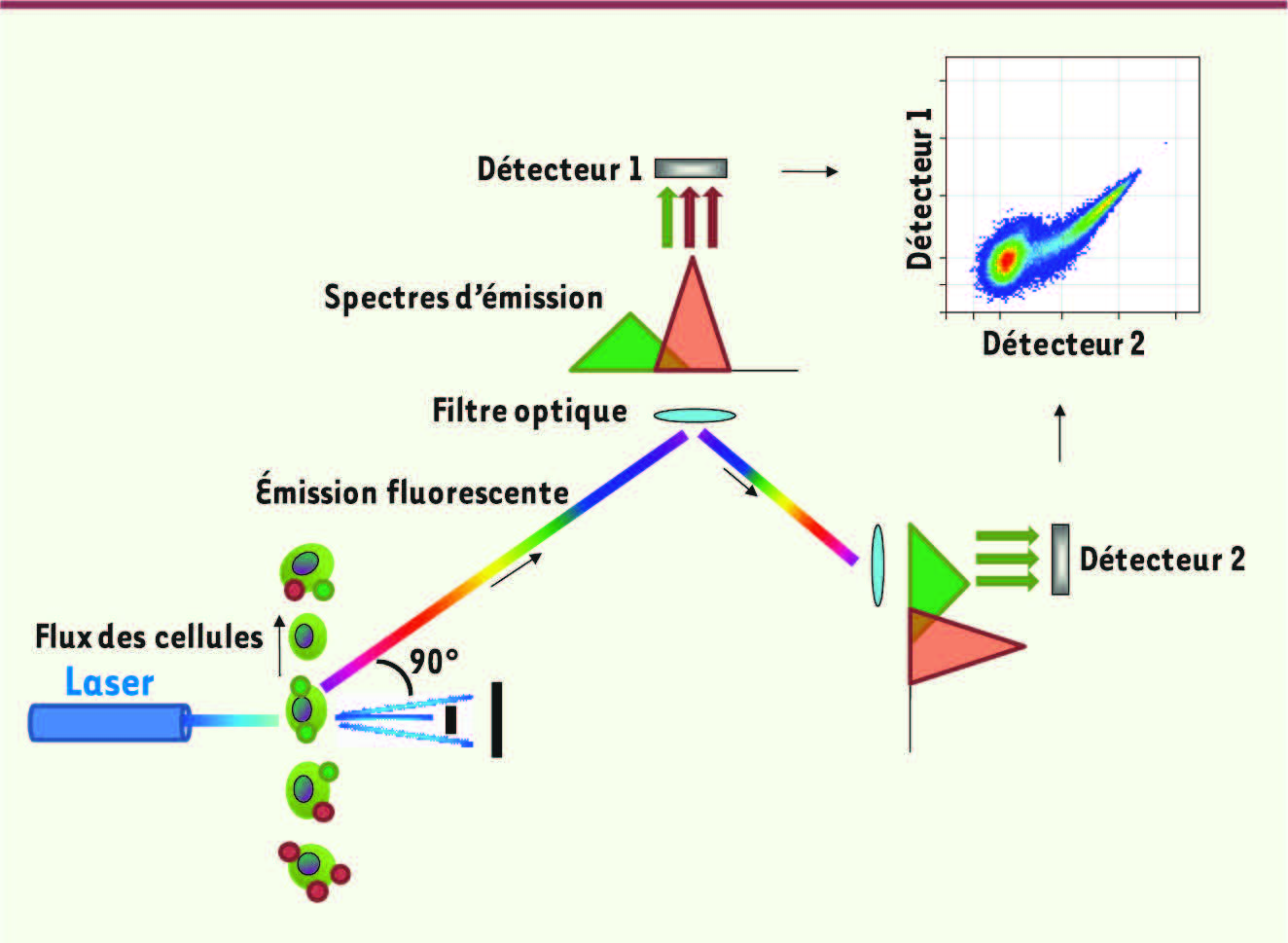
La cytométrie en flux et le décryptage des sous-populations de cellules immunes L’une des méthodes classiques permettant l’analyse de cellules individuelles est la cytométrie en flux (Figure 1). Les cellules, ou d’une manière plus générale, les particules étudiées, se déplacent dans un flux liquidien qui les sépare et qui traverse un rayon laser. Pour chaque cellule/particule, la lumière est diffractée dans différentes directions : la lumière transmise en aval (dite diffraction aux petits angles) est utilisée pour estimer la taille de la cellule; la lumière diffractée à 90° du rayon laser incident permet d’estimer la granulosité de la cellule et l’intensité de sa fluorescence. En effet, les cellules sont, en général, marquées spécifiquement par un fluorochrome couplé à un anticorps ou à tout autre ligand spécifique du facteur étudié. Le fluorochrome est typiquement excité par une longueur d’onde déterminée, la lumière réémise passe au travers de filtres optiques et est captée par des détecteurs spécifiques (Figure 1). Selon les caractéristique de chaque appareil, diverses fluorescences (souvent désignées par des « couleurs ») émises par une seule cellule sont détectables simultanément. La cytométrie en flux permet une analyse à haut débit puisque les appareils les plus modernes peuvent analyser entre 10 000 et 20 000 cellules par seconde.
 | Figure 1
Principe de la cytométrie de flux. À noter que le spectre d’émission du fluorochrome vert « bave » sur le spectre d’émission du fluorochrome rouge. Le détecteur 1 destiné à la détection du fluorochrome rouge détecte partiellement l’émission du fluorochrome vert. |
Ces propriétés expliquent que la cytométrie en flux soit l’une des technologies parmi les plus utilisées en immunologie. Elle a contribué à ce jour à la mise en évidence d’une multitude de cellules du système immunitaire, de leur rôle physiologique ou en pathologie [
2]. En 1969, elle a permis l’isolement des plasmocytes produisant les anticorps [
3] et, en 1982, la caractérisation des cellules exprimant différents types d’immunoglobulines [
4]. La pertinence clinique de cette technologie est illustrée par la quantification en routine des lymphocytes T CD4+ circulants pour le suivi de l’évolution des patients infectés par le VIH (virus de l’immunodéficience humaine) et l’évaluation de l’efficacité des traitements du Sida [
5]. Toujours dans ce domaine, elle a contribué à l’identification de cellules T CD8+ matures spécifiques du VIH définissant le phénotype des patients « asymptomatiques à long terme » ou HIV controllers en l’absence d’un traitement antirétroviral [
6]. Ces mêmes cellules CD8+ matures corrèlent avec la protection de l’infection chez les primates non humains vaccinés par un cytomégalovirus recombinant exprimant les protéines du VIH [
7]. Enfin, dans le domaine de la vaccinologie, la cytométrie en flux remplace progressivement les méthodes classiques d’exploration de la réponse immune induite, comme les ELISpot [
8]. L’intérêt croissant pour la cytométrie en flux est lié à la capacité d’étudier des paramètres multiples sur des millions de cellules analysées individuellement. |
Toute médaille a son revers Cependant, toute technologie a ses limites et l’exploration du système immunitaire dans sa grande complexité nécessite l’étude simultanée d’un nombre croissant de paramètres. L’une des contraintes majeures de la cytométrie en flux basée sur les technologies lasers est le nombre restreint de fluorochromes et le nombre fini de longueurs d’ondes possibles [
9]. De plus, il est nécessaire d’utiliser des longueurs d’ondes d’excitation distinctes pour chaque fluorochrome, ce qui implique d’équiper les instruments de plusieurs lasers fonctionnant simultanément. Par ailleurs, le spectre d’émission de chaque fluorochrome peut être large, ce qui entraîne des recouvrements dans la détection de la lumière émise lorsque plusieurs marqueurs (et donc plusieurs fluorochromes) sont analysés sur une même cellule [
10]. Pour résoudre ce problème, les données brutes mesurées par les détecteurs sont traitées par un algorithme complexe qui corrige le signal obtenu par le détecteur dédié à un fluorochrome donné en soustrayant les détections parasites (compensation) [10]. Le traitement informatique crée des distorsions dans les mesures générées. Cette compensation nécessaire entraîne une diminution importante de la sensibilité de détection et oblige à multiplier le nombre d’échantillons témoins testés [
11]. Les quelques laboratoires équipés des instruments les plus sophistiqués peuvent détecter un maximum de 18 à 20 paramètres par cellule. En règle générale, les machines les plus utilisées aujourd’hui offrent une capacité d’analyse de 6 à 10 paramètres. Enfin, les fluorochromes disponibles sont de composition chimique diverse, ce qui crée une variabilité : des données différentes peuvent être obtenues pour un même paramètre s’il est étudié à l’aide d’un même anticorps spécifique mais couplé à des fluorochromes différents. |
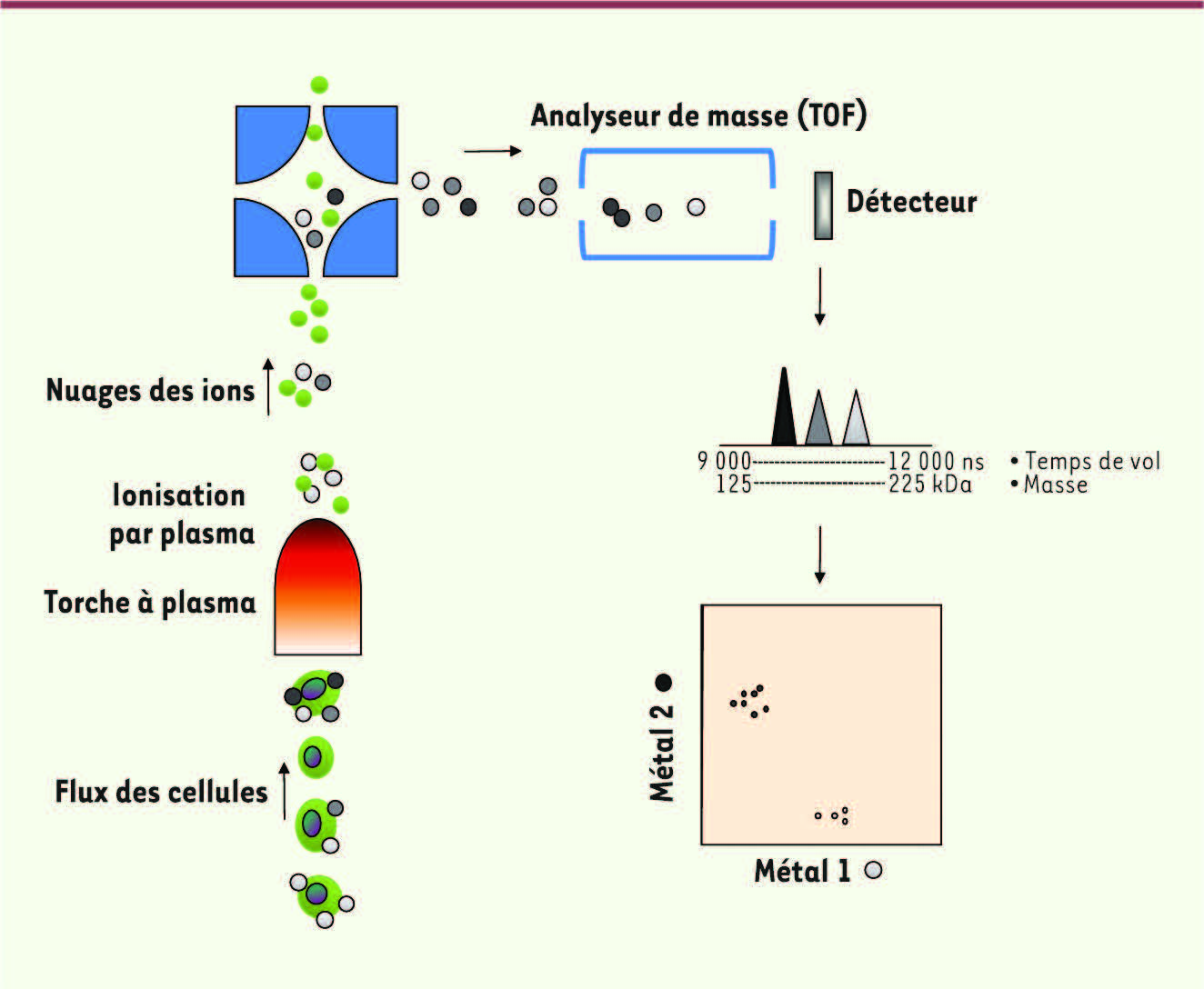
De l’explosion chromatique de la cytométrie en flux au monde en gris de la cytométrie de masse Les nouvelles approches par cytométrie de masse permettent de s’affranchir d’un grand nombre des limites de la cytométrie basée sur l’utilisation des lasers. L’innovation vient de l’utilisation d’un nouveau type de marqueur et de systèmes de détection non optiques basés sur la spectrométrie de masse [
12]. Les anticorps, ou tout autre ligand utilisé pour marquer la cellule, sont couplés à un métal, plus précisément à des isotopes de transition, qui ne sont pas naturellement présents dans les produits biologiques. Ces conjugués sont utilisés comme dans toute autre méthode de cytométrie. Les cellules marquées et individualisées par le flux de liquide dans lequel elles baignent sont vaporisées et introduites une à une dans une chambre à plasma (ICP) ou elles sont atomisées et ionisées (Figure 2). Chaque cellule génère ainsi un nuage d’ions dont le temps de vol (TOF) est analysé par spectrométrie de masse (MS) [
16]. Puisque le métal couplé à chaque anticorps n’est pas un produit naturel de la cellule, la signature de chaque métal est ainsi spécifique du marqueur cellulaire identifié. L’avantage majeur de cette technologie est l’absence de recouvrement des signaux obtenus pour chaque métal dans les différents canaux de détection. En effet, chaque métal produit un signal unique qui est fonction de son poids moléculaire. Il est aujourd’hui possible de détecter des métaux dont le poids moléculaire varie de 125 à 215 kilodaltons. Près de 60 métaux peuvent ainsi être détectés simultanément [
13]. À l’inverse des technologies utilisant les lasers, les propriétés chimiques des différents métaux utilisés sont très proches et n’interfèrent pas avec la qualité du couplage. Enfin, l’utilisation de la spectrométrie de masse permet une quantification directe et absolue, sans traitement intermédiaire des données brutes.
 | Figure 2
Principe de la cytométrie de masse.
|
Récemment, Bendall et al [
14] ont utilisé cette approche de cytométrie de masse pour étudier 34 paramètres à partir de cellules saines isolées de la moelle osseuse humaine. L’analyse combinée de marqueurs membranaires et de facteurs intracellulaires a permis une caractérisation fine des capacités de signalisation des différentes lignées cellulaires. Cette étude, qui intègre l’utilisation de la cytométrie de masse et de nouvelles approches d’analyse des données, démontre la valeur d’une mesure simultanée du niveau d’expression de différentes classes de molécules dans différentes populations cellulaires et offre de nouvelles perspectives à la biologie cellulaire. L’utilisation croissante du nombre de « couleurs » (fluorochromes) dans les approches classiques de cytométrie en flux a été caractérisée « d’explosion chromatique » [
15]. On peut s’attendre aujourd’hui à une nouvelle explosion dans l’analyse de la multitude des « gris » des métaux utilisés en cytométrie de masse. Les « cytométristes » abandonneront-ils alors leur monde coloré pour ne plus parler que de gadolinium (Gd), ytterbium (Yb) et néodynium (Nd) ou attribueront-ils une nouvelle couleur à chaque métal ? |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Leslie
M
. Cell biology. The power of one . Science.
2011; ; 331 : :24.–26. 2.
De Rosa
SC
,
Roederer
M
. Eleven-color flow cytometry. A powerful tool for elucidation of the complex immune system . Clin Lab Med.
2001; ; 21 : :697.–712. 3.
Hulett
HR
,
Bonner
WA
,
Barrett
J
,
Herzenberg
LA
. Cell sorting: automated separation of mammalian cells as a function of intracellular fluorescence . Science.
1969; ; 166 : :747.–749. 4.
Hardy
RR
,
Hayakawa
K
,
Haaijman
J
,
Herzenberg
LA
. B-cell subpopulations identified by two-colour fluorescence analysis . Nature.
1982; ; 297 : :589.–591. 5.
O’Brien
WA
,
Hartigan
PM
,
Daar
ES
,
Simberkoff
MS
,
Hamilton
JD
. Changes in plasma HIV RNA levels and CD4+ lymphocyte counts predict both response to antiretroviral therapy and therapeutic failure. VA cooperative study group on AIDS . Ann Intern Med.
1997; ; 126 : :939.–945. 6.
Addo
MM
,
Draenert
R
,
Rathod
A
, et al. Fully differentiated HIV-1 specific CD8+ T effector cells are more frequently detectable in controlled than in progressive HIV-1 infection . PLoS One.
2007; ; 2 : :e321.. 7.
Hansen
SG
,
Ford
JC
,
Lewis
MS
, et al. Profound early control of highly pathogenic SIV by an effector memory T-cell vaccine . Nature.
2011; ; 473 : :523.–527. 8.
Kutscher
S
,
Dembek
CJ
,
Allgayer
S
, et al. The intracellular detection of MIP-1beta enhances the capacity to detect IFN-gamma mediated HIV-1-specific CD8 T-cell responses in a flow cytometric setting providing a sensitive alternative to the ELISPOT . AIDS Res Ther.
2008; ; 5 : :22.. 9.
Lawrence
WG
,
Varadi
G
,
Entine
G
, et al. Enhanced red and near infrared detection in flow cytometry using avalanche photodiodes . Cytometry A.
2008; ; 73 : :767.–776. 10.
Roederer
M
. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats . Cytometry.
2001; ; 45 : :194.–205. 11.
Mahnke
YD
,
Roederer
M
. Optimizing a multicolor immunophenotyping assay . Clin Lab Med.
2007; ; 27 : :469.–485. 12.
Ornatsky
O
,
Bandura
D
,
Baranov
V
, et al. Highly multiparametric analysis by mass cytometry . J Immunol Methods.
2010; ; 361 : :1.–20. 13.
Bandura
DR
,
Baranov
VI
,
Ornatsky
OI
, et al. Mass cytometry: technique for real time single cell multitarget immunoassay based on inductively coupled plasma time-of-flight mass spectrometry . Anal Chem.
2009; ; 81 : :6813.–6822. 14.
Bendall
SC
,
Simonds
EF
,
Qiu
P
, et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum . Science.
2011; ; 332 : :687.–696. 15.
Chattopadhyay
PK
,
Hogerkorp
CM
,
Roederer
M
. A chromatic explosion: the development and future of multiparameter flow cytometry . Immunology.
2008; ; 125 : :441.–449. 16.
Carbonnelle
E
,
Nassif
X
. Utilisation en routine du MALDI-TOF-MS pour l’identification des pathogènes en microbiologie médicale . Med Sci (Paris).
2011; ; 27 : :882.–888. |