| |
| Med Sci (Paris). 2011 December; 27(12): 1112–1120. Published online 2011 December 23. doi: 10.1051/medsci/20112712018.La migration des phagocytes Tour d’horizon Véronique Le Cabec,1,2 Emeline Van Goethem,1,2 Romain Guiet,1,2 and Isabelle Maridonneau-Parini1,2* 1CNRS, UMR 5089, Institut de pharmacologie et de biologie structurale, 205, route de Narbonne, BP 64182, F-31077Toulouse Cedex 4, France 2Université de Toulouse, Université Paul Sabatier, 118, route de Narbonne, 31062Toulouse Cedex 9, France |
Les phagocytes sont constitués majoritairement par les polynucléaires neutrophiles et les monocytes/macrophages, ils sont capables d’infiltrer les tissus, processus clé de la réponse immunitaire innée [
1]. L’infiltration tissulaire1 des phagocytes représente également un facteur aggravant dans plusieurs pathologies dont les maladies inflammatoires chroniques [
2] ou le cancer [
3]. Les phagocytes peuvent induire des lésions tissulaires du fait de la libération de protéases, de produits bactéricides et de dérivés oxygénés toxiques [2]. La présence des macrophages au sein des tumeurs est associée à un mauvais pronostic puisqu’ils favorisent l’angiogenèse, la croissance tumorale et la formation de métastases [3]. Aussi, le contrôle de l’infiltration tissulaire des phagocytes est-il devenu un enjeu thérapeutique majeur [3]. L’objectif de cette revue consiste à dresser un état des lieux des connaissances sur les différentes étapes de la migration des phagocytes in vivo et sur les modèles d’étude in vitro. |
Les différentes étapes du recrutement tissulaire des phagocytes in vivo
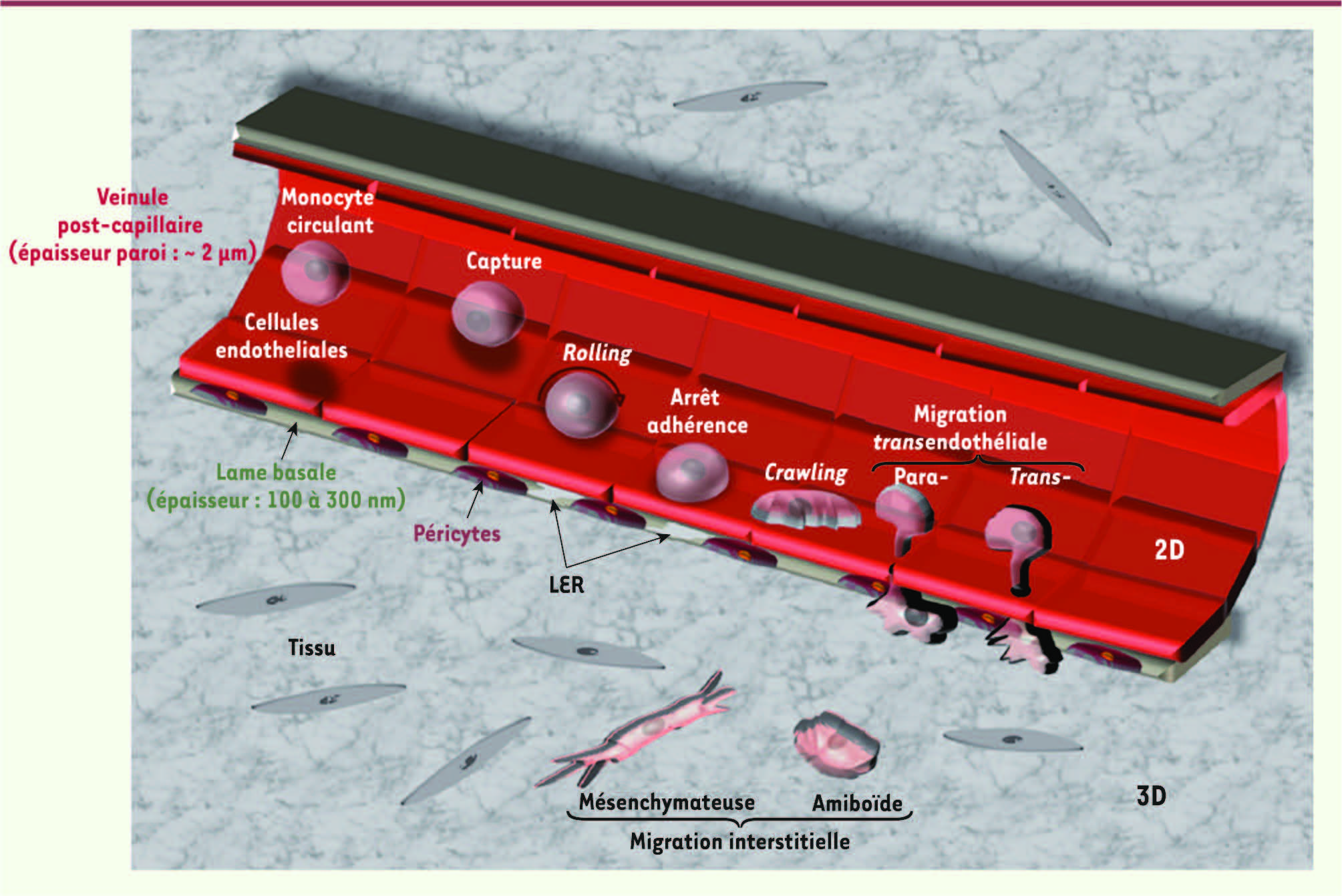
Migration à travers la paroi vasculaire et la lame basale Lors d’une infection, le recrutement des neutrophiles et monocytes s’effectue en réponse à la sécrétion de cytokines pro-inflammatoires [
4]. En réponse à ces cytokines, les cellules endothéliales des vaisseaux sanguins les plus proches du site infectieux expriment des sélectines E et P qui interagissent avec les phagocytes circulants, induisent leur capture et un déplacement sur l’endothélium qui s’apparente à un roulement ( rolling). Les intégrines des phagocytes sont alors activées, elles interagissent avec leurs ligands à la surface des cellules endothéliales, en particulier ICAM ( intercellular adhesion molecule) et VCAM ( vascular cell adhesion molecule) [ 4,
5]. Ceci entraîne l’arrêt ( arrest) du roulement des phagocytes qui adhèrent fermement à l’endothélium et se déplacent par reptation ( crawling) jusqu’à ce qu’ils traversent l’endothélium et la membrane basale sous-jacente par diapédèse (ou extravasation) (Figure 1). Notons que la capacité de reptation est très augmentée dans le cas des monocytes dits « patrouilleurs », une sous-population capable de parcourir les parois des vaisseaux à la recherche de facteurs inflammatoires [
6].
 | Figure 1.
Environnements 2D et 3D de la migration monocytaire. Au cours des différentes étapes du recrutement des monocytes, on peut distinguer deux contextes migratoires différents. (1) Le premier concerne le crawling et la migration transendothéliale. Il répond aux critères de la migration en deux dimensions (2D) puisque, du fait de la faible épaisseur du substrat (par exemple, environ 2 μm pour la paroi d’une veinule post-capillaire et 100 à 300 nm pour la lame basale sous-jacente), la cellule est attachée à son substrat de manière unilatérale pour maintenir un contact. (2) Le second contexte concerne la migration transtissulaire qui, elle, répond aux critères de la migration tridimensionnelle (3D) puisque la cellule se trouve dans un environnement qui impose des contraintes sur toute sa surface. LER : low expression regions, zones de la lame basale plus pauvres en protéines matricielles qui seraient des lieux de passage privilégiés pour les leucocytes. |
Les mécanismes mis en jeu dans les étapes de rolling, arrest, crawling et lors de la migration transendothéliale ont été décrits dans des revues récentes [5,
7] et ne seront pas détaillés ici. Une fois la paroi endothéliale franchie, les phagocytes traversent la lame basale pour atteindre les tissus. La lame basale sous-tend les endothéliums et assure leur cohésion mécanique. Il est essentiel qu’elle conserve son intégrité après le passage des millions de leucocytes qui migrent chaque jour vers les tissus dans le cadre de la surveillance immunitaire [
8]. La lame basale est constituée d’une fine couche de matrice extracellulaire (MEC) de 100 à 300 nm d’épaisseur composée de macromolécules - par exemple les laminines et le collagène de type IV -, interconnectées par des glycoprotéines comme le perlecan et les nidogènes, dans laquelle s’insèrent les péricytes, cellules impliquées dans la stabilisation de la paroi endothéliale et dans le contrôle du débit circulatoire et de la perméabilité des capillaires [8,
9]. Des zones plus pauvres en certaines protéines matricielles alignées avec les espaces entre les péricytes adjacents [9] pourraient représenter des lieux de passage privilégiés. Toutefois, la porosité de la lame basale n’excède pas les 50 nm et les cellules sont incapables de s’infiltrer dans des pores de taille inférieure à 2 µm [8] suggérant une action enzymatique. In vivo, l’intervention de l’élastase dans le passage des neutrophiles est controversée [
10,
11] et, in vitro, l’élastase n’est pas nécessaire au démantèlement réversible de la membrane basale lors de l’infiltration des neutrophiles [
12]. Concernant les monocytes, peu de données sont disponibles. Ils s’étalent in vivo au niveau de la lame basale et envoient des protrusions vers le tissu sous-jacent afin de faciliter leur passage sans qu’une activité protéolytique soit impliquée [11]. En revanche, dans le cas du franchissement par les monocytes/macrophages de la lame basale particulière du cerveau qui participe au maintien de la barrière hémato-encéphalique, des métalloprotéinases matricielles (MMP) sont nécessaires [
13]. Ainsi, il est probable que des mécanismes protéolytiques et non protéolytiques soient impliqués au cours de ce processus et que leur mise en œuvre dépende de la nature de la lame basale et du phagocyte concerné [8]. La migration dans les tissus interstitiels Dans les tissus interstitiels, les phagocytes passent d’un environnement en deux dimensions (2D) à un environnement en trois dimensions (3D) (Figure 1). Des travaux réalisés essentiellement sur des cellules tumorales montrent que les mécanismes mis en jeu au cours de la migration 3D diffèrent de ceux intervenant au cours de la migration 2D [
14]. Deux modes migratoires différents ont été définis en 3D dans des modèles de MEC reconstituées in vitro: le mode mésenchymateux et le mode amiboïde. En utilisant le mode mésenchymateux, la cellule se crée activement un passage dans son microenvironnement en le dégradant par protéolyse [
15]. Dans ce cas, la cellule adopte un phénotype protrusif et émet des pseudopodes qui lui permettent de « scanner » l’environnement et d’y trouver un point d’ancrage et de traction sur la matrice [ 15]. L’engagement des intégrines avec leurs ligands de la MEC active des protéines responsables du turn-over des adhérences (Rac, Src, etc.) et recrute des protéases cellulaires qui entraînent une rupture des adhérences, mais aussi un remodelage de la matrice environnante [ 15,
16]. Le mode amiboïde tire son nom du mode migratoire adopté par le protozoaire Amoeba proteus. Les cellules ont une morphologie arrondie et forment des extensions membranaires arrondies ( bleb) et de courtes protrusions qui pénètrent dans les trous naturels de la matrice [
17]. Ce déplacement ne nécessite pas de protéolyse de la MEC et il est indépendant des intégrines [ 15, 17]. Il est caractérisé par des contorsions cellulaires qui permettent à la cellule de se faufiler entre les fibres de la matrice sans s’attacher au substrat. Le confinement de l’environnement est suffisant pour fournir le contact nécessaire à la génération de forces de traction [
18]. Les processus contractiles via Rho/ROCK ( Rho- associated protein kinase) et la myosine II produiraient la force de propulsion nécessaire pour permettre le passage du noyau, l’élément le plus rigide de la cellule [
19]. Pour remplir leur fonction immunitaire, les phagocytes sont capables de migrer dans tous les tissus de l’organisme. Or, ces derniers diffèrent par leur organisation et leurs propriétés biophysiques, notamment leur rigidité et la taille des pores de la MEC qui peut varier de 3 à 6 µm (régions fibrillaires lâches) à moins de 1 µm (tissu conjonctif dense) [
20,
21]. Peu d’études visant à déterminer le mode migratoire des phagocytes in vivo dans les tissus sont disponibles. Sur la base d’observations faites sur des lymphocytes, il est couramment admis que les leucocytes, dans leur ensemble, migrent selon le mode amiboïde au sein des tissus interstitiels [21,
22]. In vivo, les monocytes et les neutrophiles migrent à une vitesse de 20 à 25 µm/min dans le tissu interstitiel à proximité d’une veinule ; la migration est sous la dépendance de ROCK [
23], ce qui est en faveur d’un mode migratoire amiboïde. La migration interstitielle in vivo des cellules dendritiques matures est indépendante des intégrines [22], mais semble dépendante de la MMP-9 [
24,
25]. Pour les macrophages, l’implication de protéases lysosomales et de MMP dans la migration a été décrite mais, dans la plupart des études, il n’est pas clairement établi si ces protéases sont libérées par les macrophages eux-mêmes. L’hypothèse selon laquelle le mode mésenchymateux pourrait être utilisé in vivo par certains phagocytes est étayée par l’observation que la tyrosine kinase Hck [
26], qui joue un rôle clé dans la migration mésenchymateuse in vitro, régule la migration in vivo des macrophages au sein des tissus interstitiels [26]. Hck, une kinase de la famille Src, est exprimée spécifiquement dans les phagocytes, ce qui en fait une cible pharmacologique potentielle. Ainsi, bien que quelques études soient en faveur de l’utilisation du mode mésenchymateux in vivo, des travaux complémentaires sont nécessaires pour démontrer avec certitude l’utilisation in vivo de ce mode migratoire par les macrophages. La microscopie intravitale, dont le niveau de résolution et l’accessibilité à des tissus profonds sont en constant progrès, permettra probablement de répondre prochainement à cette question. En résumé, au cours des différentes étapes du recrutement des phagocytes sur un site inflammatoire, on peut distinguer deux contextes migratoires différents. Le premier concerne le crawling et la migration transendothéliale. Il répond aux critères de la migration en 2D [15, 21] puisque la cellule n’est attachée à son substrat que par une de ses « faces ». Le second contexte concerne la migration transtissulaire qui, elle, répond aux critères de la migration 3D puisque la cellule est insérée dans un environnement qui impose des contraintes sur toute sa surface. Puisque les migrations en 2D et 3D font appel à des mécanismes différents [14], des modèles expérimentaux pour l’étude de la migration 3D des phagocytes commencent à émerger et à compléter les modèles 2D qui ont été mis en place par le passé. |
La migration in vitro des phagocytes Les mécanismes de la migration en 2D des phagocytes Généralement, les expériences de migration en 2D sont réalisées avec des phagocytes déposés sur des lamelles de verre recouvertes ou non de fines couches de substrats (fibronectine, fibrinogène, etc.). Le modèle de wound healing (cicatrisation d’une blessure), qui consiste à réaliser une blessure dans une monocouche de phagocytes adhérents à l’aide d’une pointe de pipette, permet de suivre la recolonisation par les phagocytes de l’espace ainsi libéré [
27]. Alors que ces deux premiers modèles sont utilisés pour suivre la migration non orientée, le modèle des chambres de migration permet de mesurer la migration vers un facteur attractant (chimiokines, cytokines, médiateurs lipidiques, produits de dégradation de la MEC, produits bactériens, etc.). On parle alors de chimiotactisme ou d’haptotactisme selon que le facteur est soluble ou non [ 26]. D’un point de vue mécanistique, au cours de la migration en 2D, la cellule se polarise en formant un front de migration (leading edge) à l’avant et un uropode (lagging ou trailing edge) à l’arrière. La composition moléculaire et ionique de ces deux régions cellulaires est très différente [
28]. Les podosomes, structures constitutives des monocytes/macrophages et cellules dérivées impliquées dans l’adhérence et la dégradation de la MEC, sont concentrés au niveau du front de migration [
29,
30]. La migration cellulaire est basée sur des cycles successifs d’extensions membranaires, d’adhérence, de traction du corps cellulaire et de rétraction de l’arrière de la cellule. Elle implique une balance entre forces d’adhérence (dépendantes des intégrines) et forces de traction. Les petites protéines G de la famille Rho, incluant Rho, Rac et Cdc42, jouent un rôle clé dans le remaniement du cytosquelette d’actine associé aux différentes étapes de ce processus. La protrusion du front de migration (leading edge), dépendante de Rac et Cdc42, est contrebalancée par la rétraction de l’uropode, dépendante de la voie Rho/ROCK/myosine IIa et de la synaptotagmine VII, cette dernière contrôlant l’exocytose des lysosomes [
31]. Une balance cyclique entre ces deux régions opposées de la cellule est nécessaire pour entraîner la migration (boucles de rétrocontrôle) et maintenir la polarité [
32]. Rac2 est impliquée dans la formation du lamellipode et est essentielle à la migration des neutrophiles murins [
33] tandis que Rac1 et Cdc42 sont nécessaires à l’extension des dendrites et l’étalement des cellules dendritiques [
34]. Cependant, la déplétion de Rac 1 et 2 modifie la morphologie de macrophages murins mais n’altère pas leur migration [
35]. Ainsi, dans les macrophages, la formation du lamellipode pourrait dépendre davantage de Cdc42. D’autre part, Rho permet le détachement des cellules dendritiques [34]. Dans les neutrophiles adhérant sur gel de polyacrylamide, substrat d’élasticité calibré, la force de traction nécessaire au déplacement se localise à l’arrière de la cellule [
36], là où se situe la myosine II [
37]. Dans tous ces modèles, la limite majeure tient au fait que la rigidité des supports est très supérieure à celle de l’endothélium vasculaire ou des épithéliums sur lesquels les phagocytes se déplacent en 2D in vivo. Or, il est maintenant clairement établi que ce paramètre est intégré par les cellules et modifie leur comportement. Par exemple, les macrophages s’étalent de plus en plus à mesure que le substrat se rigidifie et, en retour, ces cellules rigidifient leur cytosquelette d’actine [
38]. De plus, les macrophages déposés sur des surfaces rigides forment des podosomes, structures d’adhérence riches en actine filamenteuse (F-actine) capables de protéolyser la matrice extracellulaire [
39,
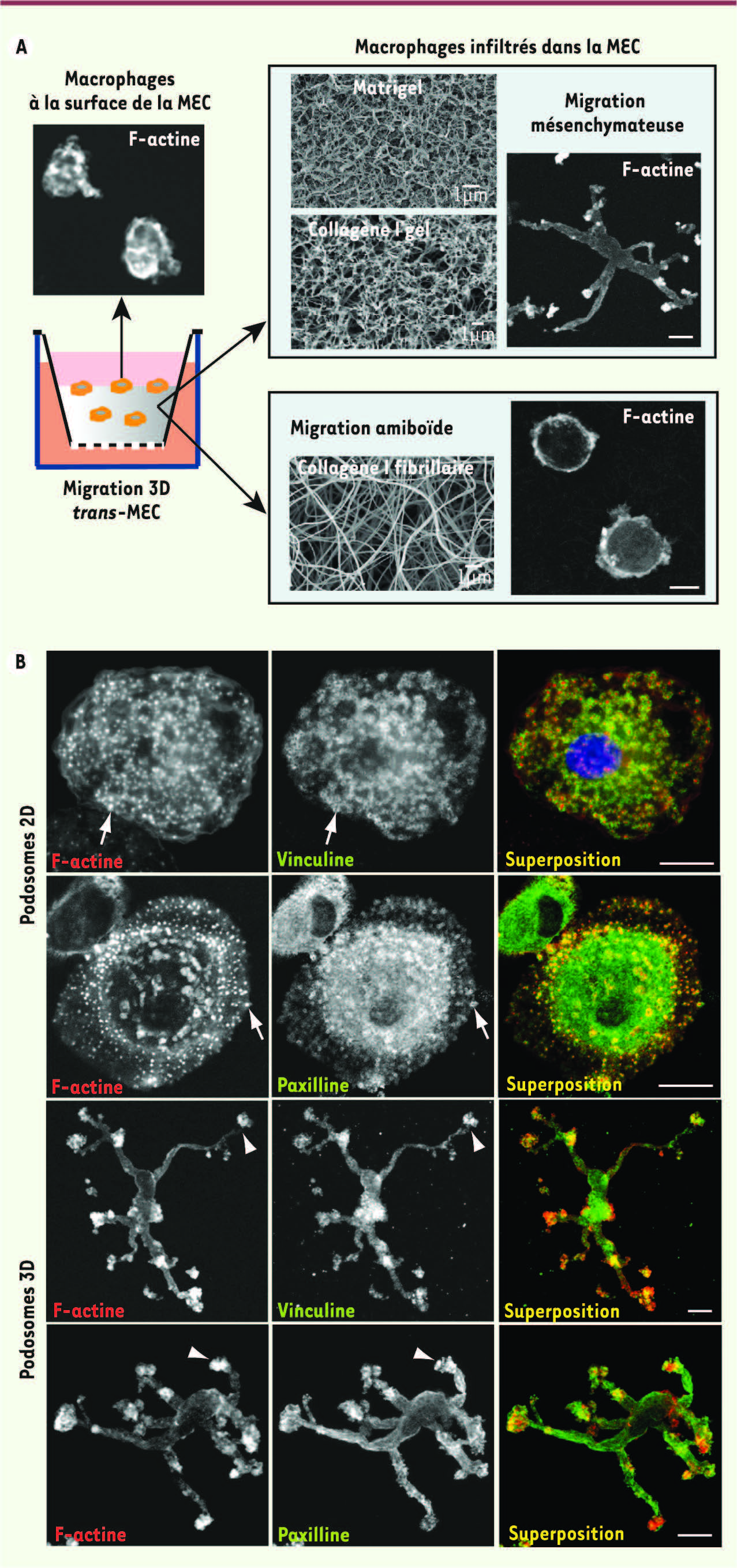
40] alors que sur des surfaces molles, les macrophages ne forment pas de podosomes ([38] (Figure 2).
 | Figure 2.
Différents types de migration macrophagique en 3D. A. La migration 3D mésenchymateuse et amiboïde des macrophages humains est influencée par l’architecture des MEC. Les MEC indiquées sont polymérisées en couche épaisse (environ 1 mm) dans le compartiment supérieur des chambres de migration séparé par une membrane poreuse de 8 µm d’un compartiment inférieur dans lequel est placé un chimioattractant, le plus souvent du sérum. Les macrophages sont déposés à la surface des matrices. Des images en microscopie électronique à balayage montrent la structure des MEC et des images de microscopie confocale montrent des macrophages à la surface ou infiltrés dans la MEC, puis marqués avec de la phalloïdine-Texas Red dans les MEC sont montrées. On notera que la F-actine s’accumule à l’extrémité de protrusions cellulaires lors de la migration mésenchymateusee qui sont absentes lors de la migration amiboïde. B. Des macrophages d’un même donneur sont déposés sur des lamelles de verre recouvertes de collagène I (2D) et à la surface d’une matrice de collagène gel qu’ils ont infiltrée pour comparaison des podosomes 2D (flèches) et des podosomes 3D (têtes de flèche). La F-actine est marquée avec la phalloïdine, et la vinculine et la paxilline, deux protéines qui s’accumulent aux podosomes, sont révélées par immunofluorescence avec un anticorps secondaire couplé au FITC (fluorescéine isothyocyanate). Barre d’échelle : 10 µm. |
Des modèles de monocouches de cellules endothéliales adhérant sur du verre ou du plastique ont été utilisés pour l’identification des mécanismes moléculaires et cellulaires impliqués dans les routes paracellulaires ou transcellulaires empruntées par les phagocytes pour traverser l’endothélium [7]. Des modèles de monocouches de cellules endothéliales reposant sur de la matrice extracellulaire, qu’il s’agisse de collagène I ou de Matrigel™ dont la composition est proche de celle de la lame basale, ont également été mis en place depuis de nombreuses années et sont plus proches de l’environnement in vivo que les modèles précédents [12]. Ils permettent potentiellement d’étudier l’enchaînement des processus de migration dans les environnements 2D et 3D, lorsque les cellules pénètrent dans la matrice après avoir traversé la couche de cellules endothéliales. En conclusion, l’utilisation de modèles in vitro plus complexes utilisant des supports de rigidité contrôlée proche des valeurs mesurées in vivo sont à considérer dans le cadre de l’étude de la migration 2D des phagocytes comme cela a été réalisé pour d’autres types cellulaires [30]. Les mécanismes de la migration en 3D des phagocytes La migration 3D est le résultat d’une équation multiparamétrique dans laquelle le phagocyte (sa taille, sa capacité à se déformer, à dégrader, etc.), les paramètres physiques (rigidité, architecture, etc.) et les paramètres biochimiques environnementaux (composition de la MEC, présence de cellules) sont à considérer [
41]. In vivo, il est impossible de maîtriser chacun de ces paramètres individuellement. Aussi, des modèles d’étude in vitro plus simples commencent à être utilisés afin de décortiquer les mécanismes cellulaires et moléculaires mis en jeu au cours de la migration 3D des phagocytes. Le modèle le plus répandu est celui qui consiste à utiliser des MEC (Matrigel™, matrice issue de tumeurs dont la composition est proche de celle de la membrane basale ; collagène de type I natif ou dénaturé) (Tableau I) polymérisées dans des puits ou des chambres de migration (Figure 2A).
Tableau I.
| MEC |
Collagène fibreux |
Collagène gel |
Matrigel |
|
Composition biochimique
|
Collagène I |
Collagène I |
Collagène IV (~ 31 %), laminine (~ 60 %), entactine (~ 7 %), autres (~ 2 %) (facteurs de croissance, etc.) |
|
Concentration (mg/ml)
|
2 |
5 |
10 |
|
Diamètre moyen des pores (µm)
|
~ 2 |
~ 0,5 |
~ 0,5 |
|
Élasticité (Pa)
|
20 |
103 |
105 |
|
Mode migratoire des macrophages
|
Amiboïde |
Mésenchymateux |
Mésenchymateux |
Tableau récapitulatif des caractéristiques principales des matrices extracellulaires utilisées dans les études in vitro de la revue. Le diamètre des pores de chaque matrice est estimé d’après des mesures effectuées sur des photographies de microscopie électronique à balayage [
45]. |
Les neutrophiles humains migrent indépendamment des protéases par extension de pseudopodes dans les trous d’une matrice 3D et par constriction du corps cellulaire [
42]. Dans une matrice de collagène fibreux, la migration des monocytes humains est indépendante des MMP [
43]. Alors que l’utilisation de protéases au cours de la migration des cellules dendritiques est encore controversée [
44], la dégradation des MEC de faible porosité comme le Matrigel™ ou le collagène I polymérisé sous forme de gel a été clairement établie pour les macrophages qui utilisent alors le mode mésenchymateux, une migration lente de l’ordre de 10 µm/h [40, 45]. En revanche, dans des MEC à larges pores (collagène I fibreux), les macrophages utilisent le mode migratoire amiboïde [26, 45], ce qui permet une migration plus rapide (40 µm/h). Ainsi, les macrophages adaptent leur mode migratoire à l’architecture de leur environnement (Figure 2A). À ce jour, le mode migratoire des macrophages n’a pas été évalué dans des matrices 3D de collagène natif. Or, la présence ou non de ponts covalents dans une matrice de collagène de type I influence grandement le mode migratoire de cellules tumorales en 3D in vitro, les faisant passer d’un mode indépendant de la métalloprotéase MT1-MMP dans du collagène de type I dénaturé à un mode dépendant de cette protéase dans le cas du collagène I natif [43]. La migration mésenchymateuse des macrophages s’accompagne de la formation de protrusions membranaires. À leur extrémité s’organisent des structures riches en F-actine et en protéines associées aux podosomes 2D, douées d’activité protéolytique de la MEC, que nous avons définies comme des podosomes 3D (Figure 2B), et qui sont la signature de la migration mésenchymateusee des macrophages [40, 45]. Ces podosomes 3D pourraient être le lieu du déversement des protéases comme cela a déjà été proposé en 2D [
46,
47]. Les podosomes 3D ne sont pas formés au cours de la migration amiboïde. Lorsque la formation des podosomes est affectée dans les macrophages, la migration mésenchymateuse est inhibée alors que la migration amiboïde est maintenue [26,
48]. Les invadopodes, structures voisines des podosomes, présents dans les cellules tumorales, ont une fonction de mécanosenseur : la rigidité de la matrice augmente leur activité protéolytique [
49]. Il est probable que les podosomes jouent un rôle similaire. Par exemple, lorsque les macrophages sont déposés sur un support de rigidité élevée, tel que des lamelles de verre recouvertes ou non d’une fine couche de MEC, ils forment des podosomes 2D (Figure 2B). En revanche, lorsqu’ils sont déposés à la surface de matrices épaisses dont la rigidité est moindre, ils ne forment pas de podosomes 2D [38] mais des podosomes 3D lorsqu’ils pénètrent dans la matrice (Figure 2A).
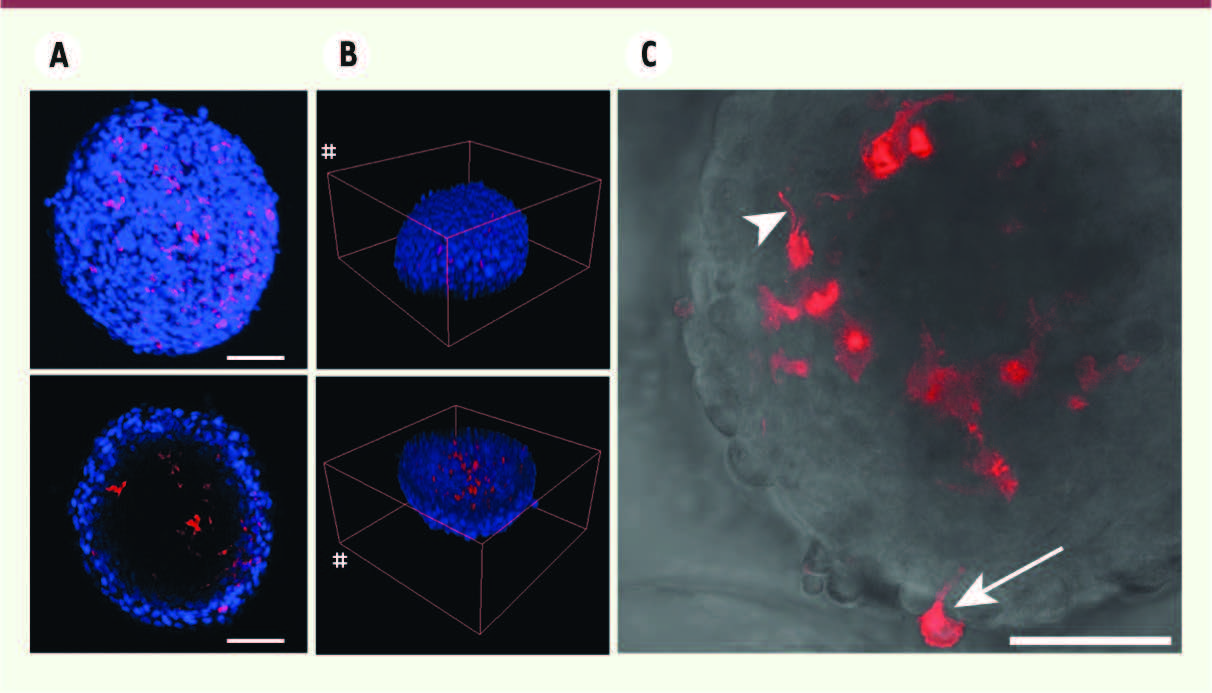
La migration mésenchymateuse des macrophages requiert différentes protéases selon l’environnement rencontré. Ainsi dans des MEC, la migration des macrophages est sous la dépendance de protéases en partie d’origine lysosomale [45]. D’ailleurs, la tyrosine kinase Hck, qui régule le trafic des lysosomes [46], contrôle la migration mésenchymateuse des macrophages dans ces MEC [26]. En plus de sa dégradation, les macrophages exercent un remaniement important de la MEC en l’ingérant et en la compactant. Ils forment ainsi des tunnels dans lesquels d’autres cellules peuvent s’infiltrer [40]. Un modèle de sphéroïdes de cellules tumorales mimant un tissu a récemment été utilisé. Ces sphéroïdes, d’un diamètre d’environ 400 µm, sont composés de cellules et de matrice (Figure 3). Leur structure est hétérogène comparée aux MEC utilisées jusqu’alors, avec des espaces intercellulaires plus ou moins larges, comblés ou non par de la MEC [48]. L’infiltration de macrophages humains dans cet environnement s’effectue en utilisant les deux modes migratoires suggérant que, dans les zones à forte porosité, les macrophages migrent selon le mode amiboïde et, dans des zones plus compactes, selon le mode mésenchymateux [48]. De fait, nous avons superposé des matrices d’architecture variable, et nous avons observé qu’un même macrophage est capable de passer d’un mode migratoire amiboïde à un mode mésenchymateux et vice versa (résultats non publiés).
 | Figure 3.
Infiltration de macrophages humains dans des sphéroïdes de cellules tumorales. Des macrophages humains marqués au CellTracker (A, B) ou exprimant LifeAct-Cherry pour marquer l’actine-F (C).sont incubés pendant 3 jours avec des sphéroïdes de cellules de carcinome du sein (SUM159PT) d’un diamètre d’environ 400 µm. A, B. Les sphéroïdes infiltrés sont fixés et marqués au DAPI, examinés avec un microscope multiphotons et des acquisitions en Z sont réalisées (pas : 1,2 µm). La somme de toutes les images (A image du haut) et une section (A, image du bas) sont montrées. B. Reconstructions 3D. C. la somme d’images confocales sur 40 µm d’épaisseur montre le sphéroïde en lumière blanche avec une superposition de la fluorescence rouge des macrophages-LifeAct. Des macrophages infiltrés et un macrophage en surface en train de s’infiltrer dans le sphéroïde (flèche) sont montrés. On note la présence de protrusions caractéristiques du mode mésenchymateux de migration (tête de flèche) (échelle : 50 µm). |
Lorsque les macrophages infiltrent des sphéroïdes, il est remarquable de noter que, dans cet environnement, la migration mésenchymateuse se déroule sans avoir recours aux protéases d’origine lysosomale et qu’elle nécessite exclusivement les MMP (manuscrit soumis pour publication). Ainsi, au cours de la migration mésenchymateuse, les macrophages utilisent différentes familles de protéases, reflet probable de la capacité de ces cellules à percevoir leur environnement [
51]. Toutefois, nous ne savons pas si les macrophages sont capables de délivrer sélectivement les protéases nécessaires ou s’ils libèrent l’ensemble des protéases sans discernement. |
Nous avons vu que l’architecture et la rigidité de l’environnement jouent un rôle important dans la migration des macrophages. D’autres paramètres sont aussi à prendre en compte et notamment la composition des matrices. Outre le Matrigel™, les modèles de MEC 3D les plus couramment utilisés sont composés uniquement de collagène de type I. Or, in vivo, la composition des MEC est variable et complexe, de multiples molécules sont présentes (élastine, fibronectine, protéoglycanes, etc.) et susceptibles d’interagir avec différents récepteurs d’adhérence des phagocytes. Par exemple, en 2D les podosomes de macrophages humains se forment préférentiellement en réponse au fibrinogène qui sollicite avant tout l’intégrine αMβ2 [
50]. D’autre part, les tissus interstitiels ne sont pas uniquement composés de matrice. La présence de cellules modifie très probablement le comportement migratoire des phagocytes. À cela, il faut ajouter la présence de facteurs chimioattractants et inflammatoires qui, en modifiant le phénotype et la polarisation des macrophages, peuvent potentiellement influencer leur capacité migratoire. Les résultats que nous venons d’exposer démontrent clairement la complexité des réponses cellulaires face à leur environnement et mettent en lumière la nécessité de concevoir des modèles d’études in vitro de complexité croissante afin de progresser dans l’identification des mécanismes moléculaires et cellulaires impliqués dans la migration des cellules phagocytaires. L’utilisation d’explants tissulaires constituera un niveau de complexification supérieur. L’imagerie en microscopie intravitale et l’utilisation d’outils pour cartographier les modes migratoires des phagocytes dans les différents tissus et détecter l’activité de protéases in situ devraient aboutir à terme à une caractérisation plus précise des modes migratoires. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Cette étude a été financée en partie par l’association pour la recherche sur le cancer (ARC SSFI #2010-120-1733 et ARC équipement # 8505), l’agence nationale de la recherche (ANR 2010 Midi 01301-Migreflam), la fondation pour la recherche médicale (Equipe FRM, DEQ2011 0421312) et l’agence nationale de la recherche sur le sida (ANRS 2010 061). RG était financé par la fondation pour la recherche médicale, et EVG par la ligue contre le cancer.
|
Footnotes |
1.
Kantari
C
,
Pederzoli-Ribeil
M
,
Witko-Sarsat
V
. The role of neutrophils and monocytes in innate immunity . Contrib Microbiol.
2008; ; 15 : :118.–146. 2.
Ma
Y
,
Pope
RM
. The role of macrophages in rheumatoid arthritis . Curr Pharm Des.
2005; ; 11 : :569.–580. 3.
Qualls
JE
,
Murray
PJ
. A double agent in cancer: stopping macrophages wounds tumors . Nat Med.
2010; ; 16 : :863.–864. 4.
Soehnlein
O
,
Lindbom
L
. Phagocyte partnership during the onset and resolution of inflammation . Nat Rev Immunol.
2010; ; 10 : :427.–439. 5.
Petri
B
,
Phillipson
M
,
Kubes
P
. The physiology of leukocyte recruitment: an in vivo perspective . J Immunol.
2008; ; 180 : :6439.–6446. 6.
Auffray
C
,
Fogg
D
,
Garfa
M
, et al.
Monitoring of blood vessels and tissues by a population of monocytes with patrolling behavior . Science.
2007; ; 317 : :666.–70. 7.
Carman
CV
. Mechanisms for transcellular diapedesis: probing and pathfinding by invadosome-like protrusions . J Cell Sci.
2009; ; 122 : :3025.–3035. 8.
Rowe
RG
,
Weiss
SJ
. Breaching the basement membrane: who, when and how?
Trends Cell Biol.
2008; ; 18 : :560.–574. 9.
Nourshargh
S
,
Hordijk
PL
,
Sixt
M
. Breaching multiple barriers: leukocyte motility through venular walls and the interstitium . Nat Rev Mol Cell Biol.
2010; ; 11 : :366.–378. 10.
Hirche
TO
,
Atkinson
JJ
,
Bahr
S
,
Belaaouaj
A
. Deficiency in neutrophil elastase does not impair neutrophil recruitment to inflamed sites . Am J Respir Cell Mol Biol.
2004; ; 30 : :576.–584. 11.
Voisin
MB
,
Woodfin
A
,
Nourshargh
S
. Monocytes and neutrophils exhibit both distinct and common mechanisms in penetrating the vascular basement membrane in vivo
. Arterioscler Thromb Vasc Biol.
2009; ; 29 : :1193.–1199. 12.
Huber
AR
,
Weiss
SJ
. Disruption of the subendothelial basement membrane during neutrophil diapedesis in an in vitro construct of a blood vessel wall . J Clin Invest.
1989; ; 83 : :1122.–1136. 13.
Agrawal
S
,
Anderson
P
,
Durbeej
M
, et al.
Dystroglycan is selectively cleaved at the parenchymal basement membrane at sites of leukocyte extravasation in experimental autoimmune encephalomyelitis . J Exp Med.
2006; ; 203 : :1007.–1019. 14.
Sahai
E
,
Marshall
CJ
. Differing modes of tumour cell invasion have distinct requirements for Rho/ROCK signalling and extracellular proteolysis . Nat Cell Biol.
2003; ; 5 : :711.–719. 15.
Friedl
P
,
Zanker
KS
,
Brocker
EB
. Cell migration strategies in 3-D extracellular matrix: differences in morphology, cell matrix interactions, and integrin function . Microsc Res Tech.
1998; ; 43 : :369.–378. 16.
Larsen
M
,
Artym
VV
,
Green
JA
,
Yamada
KM
. The matrix reorganized: extracellular matrix remodeling and integrin signaling . Curr Opin Cell Biol.
2006; ; 18 : :463.–471. 17.
Charras
G
,
Paluch
E
. Blebs lead the way: how to migrate without lamellipodia . Nat Rev Mol Cell Biol.
2008; ; 9 : :730.–736. 18.
Renkawitz
J
,
Sixt
M
. Mechanisms of force generation and force transmission during interstitial leukocyte migration . EMBO Rep.
2010; ; 11 : :744.–750. 19.
Wyckoff
JB
,
Pinner
SE
,
Gschmeissner
S
, et al.
ROCK- and myosin-dependent matrix deformation enables protease-independent tumor-cell invasion in vivo
. Curr Biol.
2006; ; 16 : :1515.–1523. 20.
Wolf
K
,
Alexander
S
,
Schacht
V
, et al.
Collagen-based cell migration models in vitro and in vivo
. Semin Cell Dev Biol.
2009; ; 20 : :931.–941. 21.
Friedl
P
,
Weigelin
B
. Interstitial leukocyte migration and immune function . Nat Immunol.
2008; ; 9 : :960.–969. 22.
Lammermann
T
,
Bader
BL
,
Monkley
SJ
, et al.
Rapid leukocyte migration by integrin-independent flowing and squeezing . Nature.
2008; ; 453 : :51.–55. 23.
Khandoga
AG
,
Khandoga
A
,
Reichel
CA
, et al.
In vivo imaging, quantitative analysis of leukocyte directional migration, polarization in inflamed tissue . PLoS One.
2009; ; 4 : :e4693.. 24.
Ichiyasu
H
,
McCormack
JM
,
McCarthy
KM
, et al.
Matrix metalloproteinase-9-deficient dendritic cells have impaired migration through tracheal epithelial tight junctions . Am J Respir Cell Mol Biol.
2004; ; 30 : :761.–770. 25.
Yen
JH
,
Khayrullina
T
,
Ganea
D
. PGE2-induced metalloproteinase-9 is essential for dendritic cell migration . Blood.
2008; ; 111 : :260.–270. 26.
Cougoule
C
,
Le Cabec
V
,
Poincloux
R
, et al.
Three-dimensional migration of macrophages requires Hck for podosome organization and extracellular matrix proteolysis . Blood.
2010; ; 115 : :1444.–1452. 27.
Moutasim
KA
,
Nystrom
ML
,
Thomas
GJ
. Cell migration and invasion assays . Methods Mol Biol.
2011; ; 731 : :333.–343. 28.
Stock
C
,
Schwab
A
. Protons make tumor cells move like clockwork . Pflug Arch Eur J Physiol.
2009; ; 458 : :981.–992. 29.
Genot
E
. Les podosomes endothéliaux . Med Sci (Paris).
2009; ; 25 : :168.–174. 30.
Kobayashi
T
,
Sokabe
M
. Sensing substrate rigidity by mechanosensitive ion channels with stress fibers and focal adhesions . Curr Opin Cell Biol.
2010; ; 22 : :669.–676. 31.
Colvin
RA
,
Means
TK
,
Diefenbach
TJ
, et al.
Synaptotagmin-mediated vesicle fusion regulates cell migration . Nat Immunol.
2010; ; 11 : :495.–502. 32.
Ridley
AJ
,
Schwartz
MA
,
Burridge
K
, et al.
Cell migration: integrating signals from front to back . Science.
2003; ; 302 : :1704.–1709. 33.
Roberts
AW
,
Kim
C
,
Zhen
L
, et al.
Deficiency of the hematopoietic cell-specific Rho family GTPase Rac2 is characterized by abnormalities in neutrophil function and host defense . Immunity.
1999; ; 10 : :183.–196. 34.
Swetman
CA
,
Leverrier
Y
,
Garg
R
, et al.
Extension, retraction and contraction in the formation of a dendritic cell dendrite: distinct roles for Rho GTPases . Eur J Immunol.
2002; ; 32 : :2074.–2083. 35.
Wheeler
AP
,
Wells
CM
,
Smith
SD
, et al.
Rac1 and Rac2 regulate macrophage morphology but are not essential for migration . J Cell Sci.
2006; ; 119 : :2749.–2757. 36.
Oakes
PW
,
Patel
DC
,
Morin
NA
, et al.
Neutrophil morphology and migration are affected by substrate elasticity . Blood.
2009; ; 114 : :1387.–1395. 37.
Wilson
CA
,
Tsuchida
MA
,
Allen
GM
, et al.
Myosin II contributes to cell-scale actin network treadmilling through network disassembly . Nature.
2010; ; 465 : :373.–377. 38.
Fereol
S
,
Fodil
R
,
Laurent
VM
, et al.
Mechanical and structural assessment of cortical and deep cytoskeleton reveals substrate-dependent alveolar macrophage remodeling . Biomed Mater Eng.
2008; ; 18 : :S105.–S118. 39.
Linder
S
. Invadosomes at a glance . J Cell Sci.
2009; ; 122 : :3009.–3013. 40.
Van Goethem
E
,
Guiet
R
,
Balor
S
, et al.
Macrophage podosomes go 3D . Eur J Cell Biol.
2011; ; 90 : :224.–236. 41.
Friedl
P
,
Wolf
K
. Plasticity of cell migration: a multiscale tuning model . J Cell Biol.
2009; ; 188 : :11.–19. 42.
Mandeville
JT
,
Lawson
MA
,
Maxfield
FR
. Dynamic imaging of neutrophil migration in three dimensions: mechanical interactions between cells and matrix . J Leukoc Biol.
1997; ; 61 : :188.–200. 43.
Sabeh
F
,
Shimizu-Hirota
R
,
Weiss
SJ
. Protease-dependent versus independent cancer cell invasion programs: three-dimensional amoeboid movement revisited . J Cell Biol.
2009; ; 185 : :11.–19. 44.
Wolf
K
,
Muller
R
,
Borgmann
S
, et al.
Amoeboid shape change and contact guidance: T-lymphocyte crawling through fibrillar collagen is independent of matrix remodeling by MMPs and other proteases . Blood.
2003; ; 102 : :3262.–3269. 45.
Van Goethem
E
,
Poincloux
R
,
Gauffre
F
, et al.
Matrix architecture dictates three-dimensional migration modes of human macrophages: differential involvement of proteases and podosome-like structures . J Immunol.
2010; ; 184 : :1049.–1061. 46.
Cougoule
C
,
Carreno
S
,
Castandet
J
, et al.
Activation of the lysosome-associated p61Hck isoform triggers the biogenesis of podosomes . Traffic.
2005; ; 6 : :682.–694. 47.
Wiesner
C
,
Faix
J
,
Himmel
M
, et al.
KIF5B and KIF3A/KIF3B kinesins drive MT1-MMP surface exposure, CD44 shedding, and extracellular matrix degradation in primary macrophages . Blood.
2010; ; 116 : :1559.–1569. 48.
Guiet
R
,
Van Goethem
E
,
Cougoule
C
, et al.
The process of macrophage migration promotes matrix metalloproteinase-independent invasion by tumour cells . J Immunol.
2011; ; 187 : :3806.–3814. 49.
Destaing
O
,
Block
MR
,
Planus
E
,
Albiges-Rizo
C
. Invadosome regulation by adhesion signaling . Curr Opin Cell Biol.
2011; ; 23 : :597.–606. 50.
Labernadie
A
,
Thibault
C
,
Vieu
C
, et al.
Dynamics of podosome stiffness revealed by atomic force microscopy . Proc Natl Acad Sci USA.
2010; ; 107 : :21016.–21021. 51.
Vérollet
C
,
Charrière
GM
,
Labrousse
A
,
Cougoule
C
,
Le Cabec
V
,
Maridonneau-Parini
I
. Extracellular proteolysis in macrophage migration: losing grip for a breakthrough . Eur J Immunol.
2011; ; 41 : :2805.–2813. |