| |
| Med Sci (Paris). 2011 August; 27(8-9): 709–712. Published online 2011 August 31. doi: 10.1051/medsci/2011278012.La révolution 3D des cellules souches : fabrication d’une rétine in vitro
Muriel Perron1* 1UPR 3294 CNRS neurobiologie et développement, Université Paris-Sud, Orsay, France MeSH keywords: Animaux, Techniques de culture cellulaire, Cellules souches embryonnaires, cytologie, Humains, Souris, Morphogenèse, Techniques de culture d'organes, Cellules souches pluripotentes, Médecine régénérative, méthodes, Rétine, Dégénérescence de la rétine, thérapie, Ingénierie tissulaire, Xenopus laevis |
Depuis plus d’un demi-siècle les biologistes ont recours à la culture cellulaire dite conventionnelle pour maintenir, en dehors d’un organisme, des cellules qui ne sont pas organisées en un tissu mais qui sont capables de se diviser et/ou de se différencier in vitro. Pour relever le défi de fabriquer ex vivo des tissus, voire des organes, des cultures cellulaires tridimensionnelles ont récemment été mises au point. Ce type d’approche vient de permettre à des chercheurs de l’Institut Riken au Japon de fabriquer pour la première fois une rétine en culture. Ces chercheurs ont montré que des cellules souches embryonnaires (CSE) pluripotentes sont capables de s’auto-organiser in vitro pour former une structure tridimensionnelle respectant la forme, la polarité, la composition et l’agencement des différents types cellulaires d’une rétine telle qu’observée in vivo. Il semblerait donc que la morphogenèse rétinienne soit dictée par un programme intrinsèque au tissu et ne dépende pas, comme nous l’imaginions, d’inductions en cascades entre différents territoires embryonnaires. Cette découverte pourrait trouver des applications dans le domaine de la thérapie cellulaire pour soigner des patients atteints de dégénérescence rétinienne pour lesquels l’absence actuelle de traitement conduit à une perte de vision. Grâce à une telle avancée technologique, du tissu rétinien pourrait en effet être fabriqué en boîte et à la carte, pour une application de greffe aux malades. |
Comment se forme un œil ? La formation de l’œil des vertébrés a depuis longtemps fasciné les embryologistes et son étude fut à l’origine de la découverte de concepts fondamentaux en biologie du développement, comme les phénomènes d’induction ou de compétence. L’organogenèse de l’œil commence en fin de neurulation par l’évagination des vésicules optiques dans la région antérieure du tube neural [
1] (Figure 1). L’épiderme contre lequel ces vésicules entrent en contact va alors s’épaissir puis s’invaginer en vésicules cristalliniennes pour donner les cristallins. Les vésicules optiques vont, elles aussi, subir un processus d’invagination et former les cupules optiques. Au sein de ces cupules, des phénomènes de spécification (patterning) vont alors gouverner la mise en place d’identités régionales distinctes. Deux régions, distale et proximale, vont notamment s’individualiser : la rétine neurale et l’épithélium pigmenté rétinien respectivement. Ces événements morphogénétiques dépendent clairement d’interactions coordonnées entre la rétine, l’épiderme de surface et le mésenchyme extra-oculaire. Cependant, la complexité des remaniements morphogénétiques et la multiplicité des signaux mis en jeu n’ont pas permis de déterminer sans ambiguïté l’implication de chaque tissu. En particulier, le rôle de l’épiderme de surface et du cristallin dans l’invagination de la vésicule optique reste l’objet de controverses [
2]. Une fois la cupule optique formée, les progéniteurs rétiniens entament leur processus de différenciation qui donne naissance aux différents types cellulaires spécialisés qui composeront la rétine fonctionnelle, dont les photorécepteurs, neurones capables de capter la lumière et de la transformer en influx nerveux.
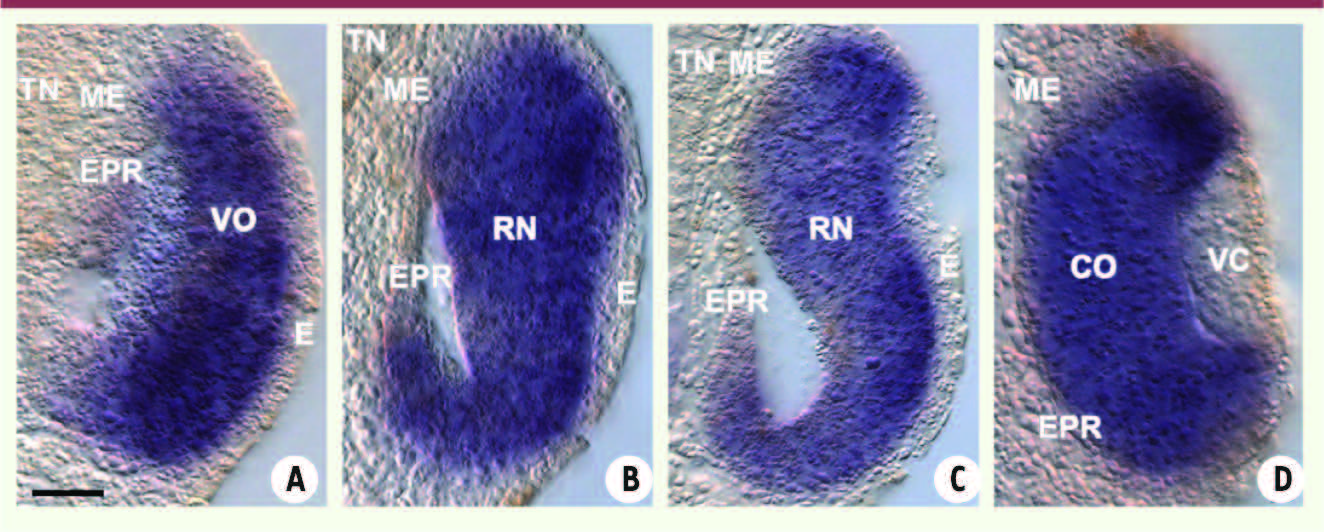
 | Figure 1
Développement in vivo d’une rétine de vertébré. Les photos illustrent les étapes de développement du stade vésicule optique au stade cupule optique. Il s’agit de coupes transversales de rétines en formation à différents stades de développement du xénope (espèce de grenouille). L’hybridation in situ révèle en bleu l’expression du gène Rx, marqueur de la rétine neurale en formation. Evaginée à partir du tube neural, la vésicule optique (A) s’invagine progressivement (B, C) pour former la cupule optique (D). CO : cupule optique; E : épiderme; EPR : épithélium pigmenté rétinien présomptif; ME : mésenchyme extraoculaire; RN : rétine neurale ; TN : tube neural ; VC : vésicule cristallinienne ; VO : vésicule optique. Barre d’échelle : 50 μm (photos : Morgane Locker). |
|
De la cellule souche aux cellules rétiniennes Ces dernières années, de nombreuses équipes ont cherché à produire des photorécepteurs in vitro à partir de CSE. Le défi était de déterminer la combinaison de facteurs la plus appropriée [
3,
4]. L’équipe de Yoshiki Sasai a mis au point un protocole séquentiel de culture pour diriger des CSE murines vers un destin rétinien [
5]. Bien que ces travaux montrent qu’il est possible d’induire in vitro des neurones de rétine, les conditions n’étaient pas réunies pour forcer ces cellules à s’organiser en une structure épithéliale. En revanche, des progéniteurs rétiniens issus de la différenciation de CSE puis réimplantés dans un embryon de grenouille, sur ses flancs par exemple, s’agencent spontanément pour former des rétines ectopiques [
6]. Une étape était franchie, mais d’autres défis restaient à relever pour réaliser le rêve de certains de former de toute pièce un œil ex vivo. |
De la cellule souche à une rétine 3D C’est à nouveau l’équipe de recherche de Yoshiki Sasai, de l’Institut Riken au Japon, qui vient de réussir l’exploit de fabriquer des rétines à partir de CSE de souris, et ce, exclusivement en culture. Son équipe eut l’idée de cultiver les cellules non plus en deux dimensions sur le fond d’une boîte de Pétri mais en 3D sur du matrigel [
7]. Le matrigel est une mixture gélatineuse protéique, dont la composition, la structure et les propriétés physiques constituent pour les cellules un substrat similaire aux matrices extracellulaires rencontrées dans leur milieu naturel. En associant des conditions de culture promouvant le destin neural à ce support matrigel, l’équipe japonaise a réussi à créer l’environnement adéquat pour que s’opèrent in vitro des mouvements morphogénétiques conduisant à la formation d’une rétine en 3D. Après six jours de culture dans ces conditions, les agrégats de CSE forment des sphères constituées d’un neuroépithélium polarisé (côté apical à l’intérieur, côté basal à l’extérieur). Au sein de ces sphères, on distingue différentes populations cellulaires exprimant ou non des facteurs rétiniens, dont le marqueur Rx. Deux jours plus tard, les régions exprimant Rx se mettent à bourgeonner pour former des structures étonnamment similaires aux vésicules optiques d’un embryon de souris. Selon les sphères, il peut y avoir de une à quatre vésicules optiques en protrusion. Chaque vésicule va alors se subdiviser, comme elle le ferait in vivo, en une portion distale qui exprime des marqueurs de rétine neurale, et une portion proximale qui exprime des marqueurs d’épithélium pigmenté rétinien. Se produisent ensuite spontanément des phénomènes d’invagination qui conduisent à la formation d’une cupule optique. Les cellules ont donc réussi dans ce support 3D à s’auto-organiser spatialement et à conduire leur morphogenèse indépendamment du reste de l’embryon. En outre, ces observations démontrent que la formation de la cupule optique peut s’effectuer en l’absence de cristallin et de tissu épidermique sus-jacent. Les auteurs ont modélisé cette morphogenèse spontanée en quatre phases successives, analogues à celles décrites in vivo (
Figure 2
) et se sont penchés sur les mécanismes moléculaires et biophysiques qui la gouvernent. Pour chacun des domaines mis en place, différents paramètres ont été examinés : (1) les propriétés du cytosquelette connues pour façonner la forme de divers épithéliums ; (2) la rigidité tissulaire à l’aide d’un microscope à force atomique ; (3) le niveau de compression entre cellules via des expériences d’ablations cellulaires ciblées à l’aide d’un faisceau laser d’excitation multiphotonique ; (4) l’expression génique différentielle. L’ensemble de leurs résultats démontre qu’au cours de la morphogenèse in vitro de l’épithélium rétinien, différentes régions acquièrent spontanément et séquentiellement des propriétés biochimiques, moléculaires et mécaniques distinctes.
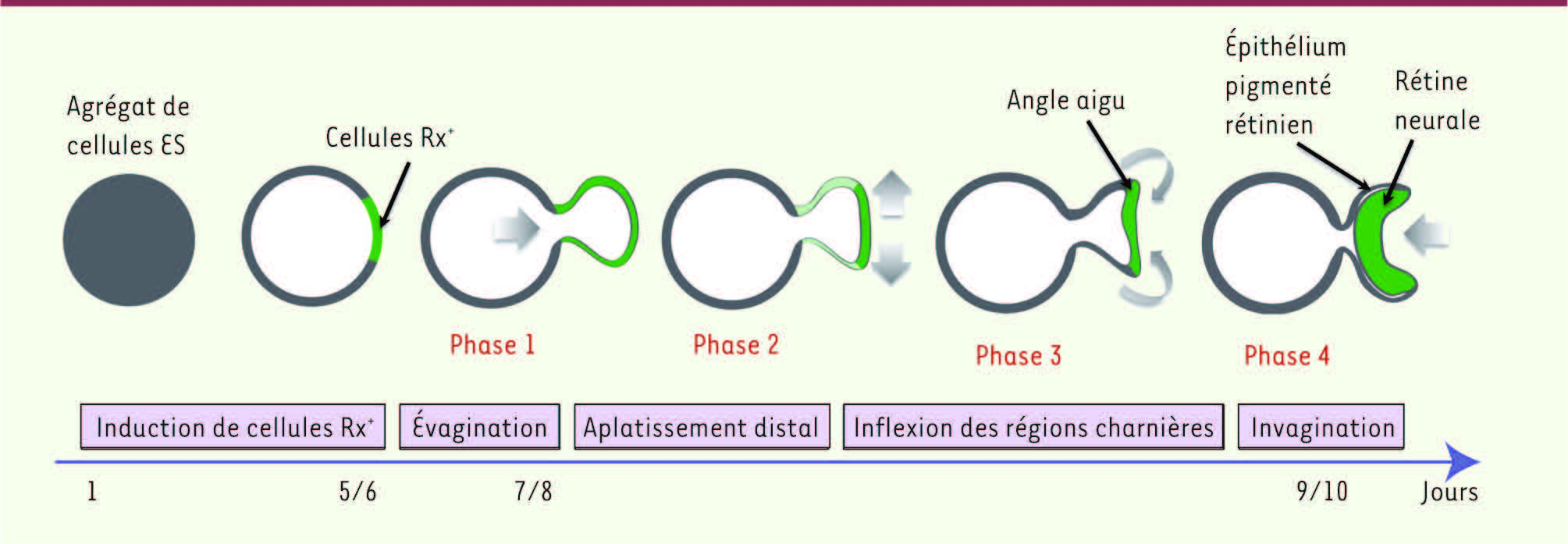
 | Figure 2
Les différentes étapes de formation in vitro d’une rétine en 3D à partir de CSE de souris. Cultivés en agrégats dans du matrigel, les CSE forment un épithélium. Certaines portions, exprimant le facteur rétinien Rx (en vert), vont s’évaginer. Des mouvements cellulaires d’aplatissement, d’inflexion et d’invagination vont ensuite se produire spontanément dans ces régions (flèches). Ainsi voit-on se développer progressivement une cupule optique. Quatre phases peuvent être distinguées dans ce processus : au cours de la phase 1, la vésicule optique a une forme hémisphérique ; en phase 2, l’expression de Rx diminue dans la partie proximale (vert clair) pour se restreindre uniquement à la partie distale qui s’aplatit ; la phase 3 conduit à une réduction des angles de jonction entre les domaines de la rétine neurale et de l’épithélium pigmenté présomptif (à ce stade seule la rétine neurale exprime Rx, vert) ; lors de la phase 4, l’épithélium de la rétine neurale s’invagine pour former une cupule optique. |
La cupule optique va ensuite grossir grâce aux divisions cellulaires. Pendant cette étape, des migrations complexes des noyaux interviennent selon l’axe apicobasal (elles sont classiquement observées dans les neuroépithéliums et sont appelées mouvements nucléaires interkinétiques). Dix à 14 jours plus tard, une stratification s’opère, signe de différenciation cellulaire. Tous les types majeurs rétiniens ont pu être détectés : les photorécepteurs, les cellules ganglionnaires, horizontales, bipolaires, amacrines, et les cellules gliales de Müller. Il est remarquable de constater que ces différents types cellulaires naissent dans le même ordre qu’in vivo indiquant que leur histogenèse naturelle est conservée in vitro. Ainsi, ces travaux montrent qu’une véritable architecture rétinienne est capable de s’autoformer in vitro à partir de CSE et qu’elle respecte le programme spatiotemporel observé au cours de l’embryogenèse. Il s’agit du tissu le plus complexe jamais créé in vitro, une véritable prouesse technologique, qui ouvre de nombreuses pistes de recherche pour la formation d’organes en culture. |
Applications en médecine régénérative Si un tel système est un modèle révolutionnaire pour étudier en contexte simplifié la morphogenèse de l’œil, il n’en constitue pas moins une avancée notable en recherche appliquée dans le domaine médical ophtalmologique. La dégénérescence des photorécepteurs dans des maladies telles que la rétinite pigmentaire ou la dégénérescence maculaire liée à l’âge conduit progressivement à la cécité. On estime à 30 000 le nombre de patients atteints de rétinopathies pigmentaires en France et environ 12 % de la population âgée de 65 à 75 ans présente une dégénérescence maculaire. La médecine régénérative est un espoir pour le traitement de ces pathologies oculaires [3,
8]. Des rétines synthétiques humaines pourraient constituer une source de cellules transplantables chez les patients. Par ailleurs, elles pourraient servir de modèles in vitro de maladies de la rétine ou être utilisées pour explorer l’intérêt de thérapies géniques ou pour cribler des composés à la recherche de nouveaux médicaments. Au préalable et dans une perspective de recherche translationnelle, la prochaine étape sera d’adapter le protocole de Y. Sasai et collaborateurs aux CSE humaines. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
L’auteur remercie Morgane Locker pour sa relecture et pour les photos de rétines de la Figure 1.
|
1.
Fuhrmann
S
. Eye morphogenesis and patterning of the optic vesicle . Curr Top Dev Biol.
2010; ; 93 : :61.-84. 2.
Okada
TS
. From embryonic induction to cell lineages: revisiting old problems for modern study . Int J Dev Biol.
2004; ; 48 : :739.-742. 3.
Lamba
DA
,
Karl
MO
,
Reh
TA
. Strategies for retinal repair: cell replacement and regeneration . Prog Brain Res.
2009; ; 175 : :23.-31. 4.
Comyn
O
,
Lee
E
,
MacLaren
RE
. Induced pluripotent stem cell therapies for retinal disease . Curr Opin Neurol.
2010; ; 23 : :4.-9. 5.
Ikeda
H
,
Osakada
F
,
Watanabe
K
, et al.
Generation of Rx+/Pax6+ neural retinal precursors from embryonic stem cells . Proc Natl Acad Sci USA.
2005; ; 102 : :11331.-11336. 6.
Viczian
AS
,
Solessio
EC
,
Lyou
Y
,
Zuber
ME
. Generation of functional eyes from pluripotent cells . PLoS Biol.
2009; ; 7 : :e1000174.. 7.
Eiraku
M
,
Takata
N
,
Ishibashi
H
, et al.
Self-organizing optic-cup morphogenesis in three-dimensional culture . Nature.
2011; ; 472 : :51.-56. 8.
West
EL
,
Pearson
RA
,
MacLaren
RE
,
Sowden
JC
,
Ali
RR
. Cell transplantation strategies for retinal repair . Prog Brain Res.
2009; ; 175 : :3.-21. |