| |
| Med Sci (Paris). 2011 August; 27(8-9): 725–732. Published online 2011 August 31. doi: 10.1051/medsci/2011278014.Histone méthyltransférases Une nouvelle classe de cibles thérapeutiques dans le traitement du cancer ? Hassiba Chaib,1,2 Thomas Prébet,1,2 Norbert Vey,1,2 and Yves Collette1,2* 1Inserm U891, Centre de recherche en cancérologie de Marseille, 27, boulevard Leï Roure, F-13009, Marseille, France 2Université Méditerranée, F-13007, Marseille, France |
Les histones sont la cible d’un grand nombre de modifications post-traductionnelles, telles que l’acétylation et la méthylation, dont la combinatoire définirait un code, appelé « code histone », permettant d’associer à divers jeux de modifications post-traductionnelles un état particulier de la chromatine et d’en modifier les fonctions essentielles comme la transcription [
1,
2]. Bien que les enzymes régulant ces modifications, telles que les acétyltransférases et les histones déacétylases (HDAC), modulent des fonctions-clés de la cellule (apoptose, différenciation, etc.), leur implication dans le contrôle de l’expression de gènes suppresseurs de tumeur et la pathogenèse des cancers a rapidement suscité le développement d’approches pharmacologiques ciblant ces réactions (pour revue, voir [
3]). Près d’une vingtaine d’inhibiteurs d’HDAC sont en cours d’évaluation clinique, et deux composés de synthèse, le vorinostat (Zolinza®)puis la romidepsin (Istodax®), ont reçu une autorisation de mise sur le marché pour le traitement du lymphome T cutané [
4]. Si la combinaison de ces agents avec des chimiothérapies conventionnelles semble prometteuse, leur efficacité en monothérapie reste cependant modeste dans la plupart des indications testées, probablement en raison de l’absence d’une part de données moléculaires permettant de stratifier et de mieux cibler les patients, et d’autre part de biomarqueurs permettant d’en attester l’action. L’optimisation de ces nouveaux traitements devrait également bénéficier de l’exploration d’approches combinées ciblant diverses activités enzymatiques intervenant dans la régulation épigénétique. Dans cette optique, la méthylation des histones semble être une cible de choix : ce mécanisme est dérégulé dans de nombreux cancers et un nombre croissant d’histone méthyltransférases (HMT) sont associées à la carcinogenèse [
5]. Nous faisons le point dans cette revue sur l’implication des HMT dans le cancer et sur les inhibiteurs de HMT actuellement disponibles. |
La méthylation des histones : une marque épigénétique complexe Les histones sont les cibles privilégiées de plusieurs modifications post-traductionnelles réversibles, capables d’influencer la structure chromatinienne et, en conséquence, l’activité transcriptionnelle des gènes sous-jacents (Figure 1) [1, 2]. La méthylation des histones représente une modification post-traductionnelle complexe, contribuant aux mécanismes de régulation épigénétique, qui n’a été décrite que récemment et reste imparfaitement comprise. Cette modification intervient sur les résidus lysine (Lys, K), qui peuvent être mono-, di- ou tri-méthylés par des KMT ou lysine méthyltransférases, et sur les résidus arginine (Arg, R), mono- ou di-méthylés par des RMT, arginine méthyltransférases. Au moins 52 KMT et entre 10 et 50 RMT ont été identifiées, dont les structures, les fonctions biologiques et les implications pathologiques sont distinctes. Ces enzymes utilisent toutes cependant le S-adénosylméthionine (SAM) comme cosubstrat pour le transfert du groupement méthyle sur le résidu aminé. Contrairement à l’acétylation et à la phosphorylation, la méthylation des histones n’a pas d’impact significatif sur les interactions électrostatiques des histones avec l’ADN. En revanche, elle constitue un motif d’interaction reconnu par des protéines à domaines chromo (chromatin modification organizer), tudor, MBT (malignant brain tumor) et PHD (plant homeo domain) ou empêche les interactions avec d’autres protéines, non-histones (pour revue, voir [2]). Les conséquences fonctionnelles de ces diverses méthylations restent difficiles à définir en raison de leur variabilité. Elles varient notamment en fonction de leur contexte (par exemple selon qu’elles interviennent au niveau des régions codantes ou de régulation transcriptionnelle). Cependant, les méthylations sur les résidus lysine 4, 36 et 79 de l’histone H3 (H3K4, H3K36 et H3K79) sont plutôt associées à un contexte d’activation transcriptionnelle, alors que les méthylations sur les résidus 9, 27 et 20 (H3K9, H3K27 et H4K20) sont généralement associées à une répression transcriptionnelle [2,
6].
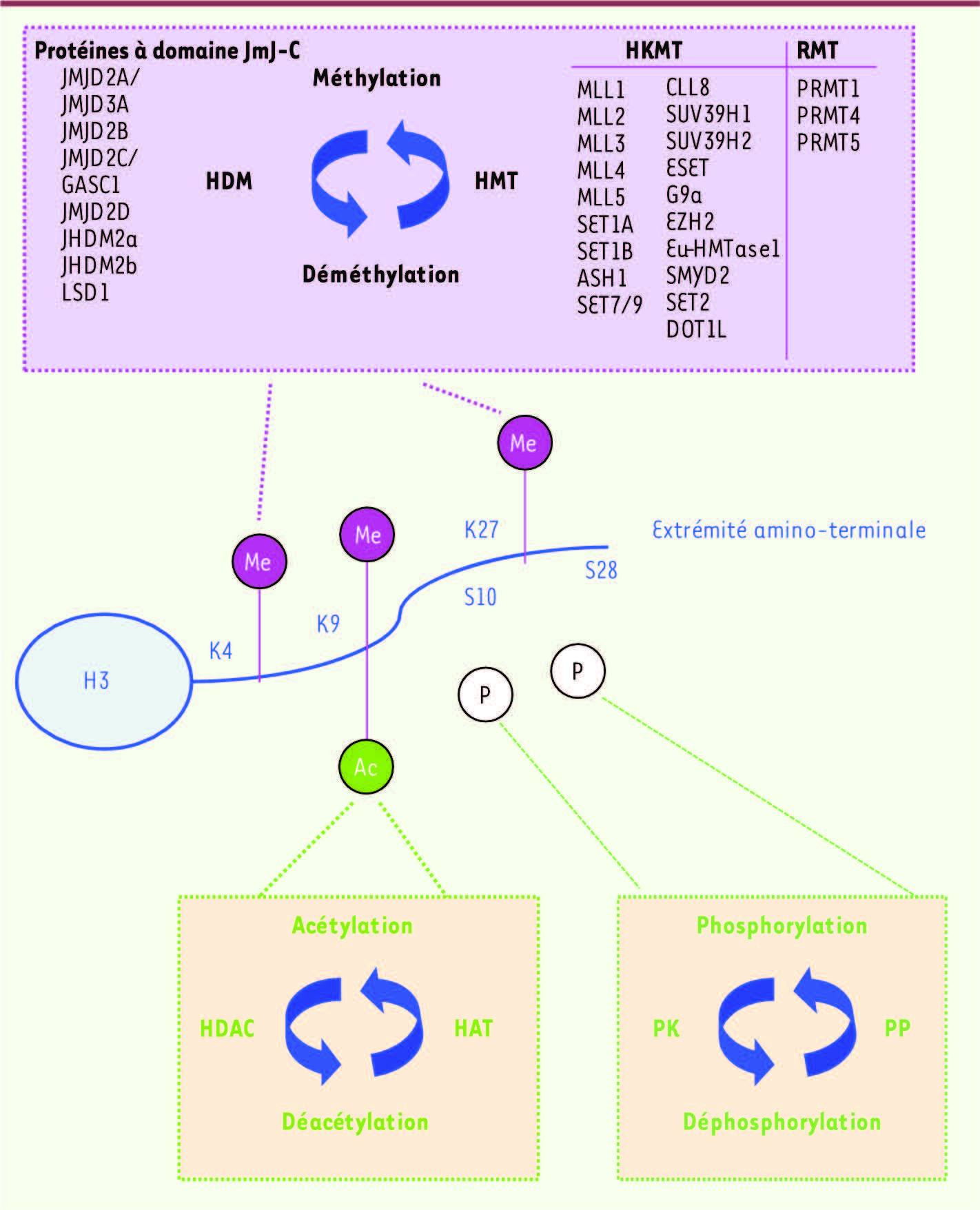
 | Figure 1.
Méthylations amino-terminale de l’histone H3. La méthylation de l’histone H3 sur les résidus lysine (K)4, K9 et K27 est assurée par des lysine méthyltransférases (HKMT) et la méthylation sur les résidus arginine est réalisée par les arginine méthyltransférases (RMT). La déméthylation est catalysée par amine oxydation (LSD1, lysine specific demethylase 1) ou par hydroxylation par une protéine à domaine Jumonji (JmJ)-C des histone déméthylases (HDM). La phosphorylation sur résidus sérine (S) et l’acétylation de résidus lysine sont respectivement contrôlées par des protéine kinases (PK) et des protéine phosphatases (PP), ou par des histone déacétylases (HDAC) et des histone acétyltransférases (HAT). D’autres modifications post-traductionnelles interviennent dans la région carboxy-terminale des histones (non montrées) et l’ensemble de ces marques forme un « code histone » déterminant les interactions entre les facteurs de transcription et la chromatine et régulant la transcription. |
|
Lysine méthyltransférases (KMT) et cancer KMT à domaine SET : un rôle ambigu dans l’oncogenèse Presque toutes les KMT sont constituées d’un domaine SET ( su(var)3-9, enhancer-of-zest, trithorax) conservé. Ce domaine n’est cependant pas suffisant pour rendre compte de l’activité catalytique de l’enzyme : deux régions adjacentes riches en résidus cystéine, appelées pré-SET et post-SET, sont nécessaires. Plusieurs études impliquent néanmoins le domaine SET dans l’oncogenèse et notamment la leucémogenése
(Tableau I)
[
7]. SUV39h1 est la première KMT caractérisée possédant un domaine SET. Elle est impliquée dans la modulation de l’architecture chromatinienne et dans la répression de l’hétérochromatine. Ses fonctions sont controversées dans le cancer, la sous-expression comme la surexpression de la molécule ayant été associées à un phénotype tumoral in vitro et chez la souris. La double invalidation de Suv39h1 et de son homologue Suv39h2 chez la souris génère une instabilité du génome associée à une prédisposition au développement d’un lymphome B avec une pénétrance de 33 % [
8].
Tableau 1.
| Enzymes/structures |
Substrats |
Liens au cancer |
| SUV39H1/2
|
H3K9 |
Surexpression de SUV39H1 transgénique chez la souris altère la différenciation des cellules érythroïdes |
| Développement chez des souris SUV39H1/2 d’un lymphome des cellules B matures |
| G9a
|
H3K9 |
Contribution de G9a à la diméthylation de H3K9 qui est impliquée dans la répression des gènes suppresseurs de tumeurs L’invalidation de G9a inhibe la croissance de cellules tumorales |
| Eu-HMTase
|
H3K9 |
Surexpression de Eu-HMTase dans les glandes tumorales |
| SETDB/ESET
|
H3K9 |
Coopération au niveau tumoral de ESET avec les ADN méthyltransférases dans la répression des promoteurs |
| MLL1 (KMT2A) |
H3K4 |
Mutations et réarrangements impliqués dans la leucémogenèse |
| MLL3 (HALR)
|
H3K4 |
Aberrations chromosomiques détectées dans les néoplasies hématologiques |
| SMYD3
|
H3K4 |
Surexpression de SMYD3 retrouvée dans les carcinomes colorectaux et hépatocellulaires |
| Augmente la prolifération cellulaire des cellules tumorales |
| DOT1L (KMT4) HKMT sans domaine SET |
H3K79 |
Implication de DOT1L dans la leucémogenèse |
| EZH2 (KMT6)
|
H3K27 |
Association de EZH2 avec l’agressivité de la croissance tumorale dans plusieurs types de tumeurs |
| Marqueur de l’état précancéreux dans la carcinogenèse mammaire |
| Marqueur de l’agressivité du cancer du sein |
| Promeut la prolifération et la capacité invasive des cellules tumorales prostatiques |
| Biomarqueur des tumeurs prostatiques de mauvais pronostic |
Lysine méthyltransférases (HKMT) et cancer. |
Dans des modèles de souris transgéniques, la surexpression de SUV39h1 dans le compartiment érythroïde altère la différenciation et la prolifération des érythroblastes, favorisant leur immortalisation [
9]. Les cellules qui surexpriment le transgène Suv39h1 sont bloquées dans la phase S du cycle cellulaire, ce qui a été corrélé à un taux réduit de l’inhibiteur du cycle cellulaire p21 et à une activation accrue de la protéine du rétinoblastome (RB). En effet, l’action de SUV39h1 sur le cycle cellulaire ferait intervenir son interaction avec RB [
10]. Cette interaction est requise pour la régulation du gène codant pour la cycline E responsable de la transition de la phase G1 à S du cycle cellulaire et dont la dérégulation pourrait avoir des conséquences sur la prolifération cellulaire. Dans de nombreux cancers, une mutation de RB altère sa liaison à SUV39h1 et son recrutement au niveau du gène de la cycline E. Ceci indique que l’interaction de RB avec Suv39h1 est importante dans la carcinogenèse [
11]. D’autre part, dans un contexte leucémique, SUV39h1 peut être recrutée par différentes oncoprotéines avec pour conséquence la répression transcriptionnelle de gènes impliqués dans la différenciation hématopoïétique. En effet, la protéine de fusion PML-RAR (promyelocytic leukemia-retinoic acid receptor), responsable de la leucémie promyélocytaire aiguë, et la protéine à domaine SET EVI-1 (ecotropic viral integration site 1) agissent comme des facteurs de transcription capables de recruter SUV39h1 de façon aberrante et de former une structure mimant l’hétérochromatine, hautement répressive pour la transcription des gènes cibles [
12,
13]. De plus, l’invalidation de SUV39h1 dans des progéniteurs hématopoïétiques de la moelle osseuse transduits par EVI-1 inhibe leur immortalisation [
14]. En conséquence, il semblerait que la leucémogenèse induite par l’oncoprotéine EVI-1 nécessite le recrutement de SUV39h1. SUV39h1 assure donc des fonctions importantes, ambiguës dans un contexte tumoral, se comportant parfois comme un gène suppresseur de tumeur, mais pouvant également participer à la progression du processus de leucémogenèse. Réarrangements chromosomiques impliquant les KMT dans les leucémies D’autres KMT sont également impliquées dans la leucémogenèse. Au cours des leucémies aiguës, la région chromosomique 11q23 est fréquemment la cible de réarrangements qui affectent le gène codant pour l’histone méthyltransférase MLL1 ( mixed-lineage leukemia). MLL est l’homologue humain de trithorax (Trx) chez la drosophile, une protéine impliquée dans le maintien de l’expression de gènes hox durant le développement embryonnaire. Approximativement 50 transcrits de fusion distincts impliquant cette région ont été décrits [
15]. Les translocations chromosomiques de MLL1 se produisent dans environ 80 % des leucémies infantiles de différents sous-types. Les partenaires de fusion sont variés et semblent associés aux sous-types de leucémies. De manière intéressante, une très grande majorité des protéines de fusion contiennent la partie amino-terminale de MLL1, affectant le domaine SET et l’activité enzymatique. La perte du domaine SET de MLL1 empêcherait la régulation transcriptionnelle de ses gènes cibles et participerait à la transformation néoplasique [
16]. Par exemple, le gène HOXA9 est le gène cible de MLL le plus étudié. Il est surexprimé dans les leucémies aiguës myéloïdes (LAM) et son potentiel leucémogène a été directement démontré in vivo. En effet, des souris qui ont reçu une transplantation de cellules de moelle surexprimant HOXA9 ont développé une LAM. De plus, de récentes études indiquent que les protéines de fusion MLL requièrent les protéines HOXA9 et HOXA7 pour transformer les progéniteurs myéloïdes [
17]. Plusieurs mécanismes ont été proposés pour comprendre comment les protéines de fusion MLL pouvaient déréguler l’expression des gènes, incluant le recrutement anormal de protéines modifiant les histones. Par exemple, dans certaines leucémies, un partenaire de fusion de MLL, AF10, peut interagir avec DOT1L (disruptor of telomeric silencing 1-like). DOT1L est une KMT sans domaine SET, responsable de la méthylation de la lysine 79 de l’histone H3 (H3K79) au niveau de la région promotrice du gène HOXA9. Le recrutement de DOT1L par MLL-AF10 peut induire une transformation leucémique dépendante de l’activité de DOT1L. En effet, un mutant de DOT1L dont l’activité enzymatique est altérée n’est plus capable de promouvoir la croissance de cellules transformées par MLL-AF10. La transformation de cellules progénitrices de la moelle par MLL-AF10 résulte de la sur-régulation du gène HOXA9 que créée l’hyperméthylation de H3K79. La perte d’expression de DOT1L inhibe la prolifération cellulaire, suggérant pour la première fois que la dérégulation d’un mécanisme épigénétique participe à l’initiation du processus oncogénique [
18]. La triméthylation au niveau de H3K27 est également impliquée dans la régulation de l’expression des gènes HOX. Ce processus intervient dans la mécanistique des protéines du groupe polycomb (PcG). L’histone méthyltransférase EZH2 (enhancer of zeste homologue 2) est une protéine PcG qui fait partie du complexe répresseur polycomb 2 (PRC2) et dont le substrat spécifique est H3K27. EZH2 est requise pour la prolifération cellulaire. En combinaison avec RB posphorylée, EZH2 réprime l’expression du suppresseur de tumeur p16/INK4 et induit la prolifération cellulaire et la transformation dans les myélomes multiples, indépendamment des facteurs de croissance [
19]. L’expression d’EZH2 est élevée dans le tissu tumoral en comparaison avec le tissu normal correspondant. Cette signature est corrélée chez les patients à un état avancé de la maladie et à un mauvais pronostic [
20]. Récemment, l’analyse du profil d’expression génique dans les cancers du sein et de la prostate a montré qu’un panel contenant 14 gènes cibles réprimés par EZH2 était significativement associé au pronostic. |
Arginine méthyltransférases (RMT) et cancer Les histones ne sont pas les seuls substrats des RMT, ce qui les distingue des KMT. Les RMT peuvent en effet catalyser la méthylation de nombreuses protéines impliquées dans la transduction du signal, la prolifération cellulaire, la réparation de l’ADN et la maturation des ARN [
21]. Par exemple, la méthylation de l’arginine de l’histone acétyltransférase CBP par la transférase CARM1 (coactivator associated arginine methyl-transferase 1) contribue à ses effets coactivateurs. À l’inverse des KMT, les RMT ne sont pas mutées dans les cellules tumorales. Néanmoins, leur implication a bien été décrite dans de nombreux cancers
(Tableau II)
. Par exemple, des expériences d’invalidation de gènes ont démontré le rôle nécessaire de PRMT1 (protein arginine N-methyltransferase 1) dans la transformation oncogénique induite par le complexe MLL [
22]. PRMT1 n’est pas importante pour la viabilité mais semble essentielle pour l’établissement d’une différenciation appropriée durant l’embryogenèse. Les souris invalidées pour l’expression de PRMT1 décèdent à un stade embryonnaire précoce. CARM1/PRMT4 est une RMT surexprimée dans les tumeurs du sein agressives et les tumeurs de la prostate hormonodépendantes [
23]. De plus, la signalisation en aval des récepteurs aux androgènes dans les cellules de prostate invalidées pour CARM1 est altérée, un paramètre qui peut intervenir dans le contexte des cancers de la prostate. En raison de leur fonction de coactivateur, PRMT1, PRMT2 et CARM1/PRMT4 pourraient être considérées comme des cibles thérapeutiques originales dans le traitement de tumeurs hormonodépendantes. Enfin, l’activité de PRMT5 réprime l’activation de gènes suppresseurs de tumeurs dans les fibroblastes et participe au maintien de l’état oncogénique.
Tableau 2.
| Enzymes/structures |
Substrats |
Liens au cancer |
| PRMT1
|
STAT1, H4, hnRNP, Npl3 |
Composant essentiel du complexe transcriptionnel oncogénique MLL |
| Coactivateur de récepteurs hormonaux dans les cellules hormonodépendantes |
| PRMT4 / CARM1
|
H3, CBP, PABP1 |
Essentiel à la progression du cycle cellulaire induit par les œstrogènes dans les cellules tumorales mammaires |
| Expression aberrante de PRMT4 dans les tumeurs prostatiques |
| L’invalidation du gène CARM1 bloque la signalisation des récepteurs des androgènes |
| PRMT5/7
|
H4, H2B, myéline |
Réprime l’expression de gènes suppresseurs de tumeurs dans les fibroblastes |
| Altère la sensibilité des cellules cancéreuses au traitement par la camptothécine |
Arginine méthyltransférases (PRMT) et cancer. |
|
Les inhibiteurs d’histone méthyltransférases La diversité structurale et fonctionnelle des KMT et RMT, ainsi que l’ensemble des données présentées ci-dessus font des HMT des cibles thérapeutiques attractives dans le traitement du cancer (voir Encadré). L’implication d’un cofacteur (S-adénosyl méthionine ou SAM) constitue une particularité susceptible de faciliter le développement d’inhibiteurs pharmacologiques, sur le modèle des inhibiteurs de kinases dérivés de l’ATP. Inhibiteurs de KMT L’utilisation d’analogues de SAM comme inhibiteurs tels que la méthylthio-adénosine, la S-adénosyl-homocystéine (SAH) ou la sinéfungine a été suggérée dans des travaux relativement anciens. Cependant ces molécules ne ciblent pas seulement les HMT mais également d’autres enzymes qui utilisent le SAM telles que les ADN méthyltransférases, ce qui les rend difficilement compatibles avec un développement clinique. Plus récemment, plusieurs inhibiteurs d’HMT plus spécifiques ont été découverts et peuvent servir comme composés modèles dans les études biochimiques in vitro et, secondairement, dans le développement de drogues anticancéreuses. En ce qui concerne les KMT, trois inhibiteurs spécifiques ont été décrits (Figure 2). Parmi 3 000 composés naturels qui ont été criblés, la chaétocine a été retenue. Elle inhibe SUV39H1 avec une IC 50 de 0,8 µM [
24]. Ce composé inhibe plus faiblement (IC 50de 2,5 µM) d’autres HMT apparentées possédant un domaine post-SET comme G9a et DIM5, alors qu’il n’exerce pas d’action significative sur les HMT dépourvues de domaine post-SET telles que EZH2 et SET7/9 (IC 50de 90 µM). Bien qu’elle ait été considérée comme un inhibiteur compétitif de SAM, la chaétocine semble donc agir sélectivement sur les HMT à domaine post-SET. Des études structurales de cristallographie devraient permettre de mieux comprendre son mode d’action. D’autre part, les HMT ne semblent pas constituer la seule cible cellulaire de la chaétocine. Une étude récente [
25] montre que cette molécule est capable, via un mécanisme d’éjection du zinc, d’altérer l’interaction protéique entre p300 et des facteurs de transcription oncogéniques tels que HIF1α ( hypoxia induced factor 1α). La chaétocine exerce également des propriétés antitumorales dans le myélome multiple [
26], via l’induction d’un stress oxydatif. Dans ce contexte, il semble que l’inhibition de la thioredoxine réductase (TxR) par la chaétocine induise la libération d’espèces réactives de l’oxygène (ROS) et l’induction de la mort des cellules myélomateuses. Cependant, le rôle de SUV39h1 dans le mécanisme de mort induit par la chaétocine n’a pas encore été étudié.
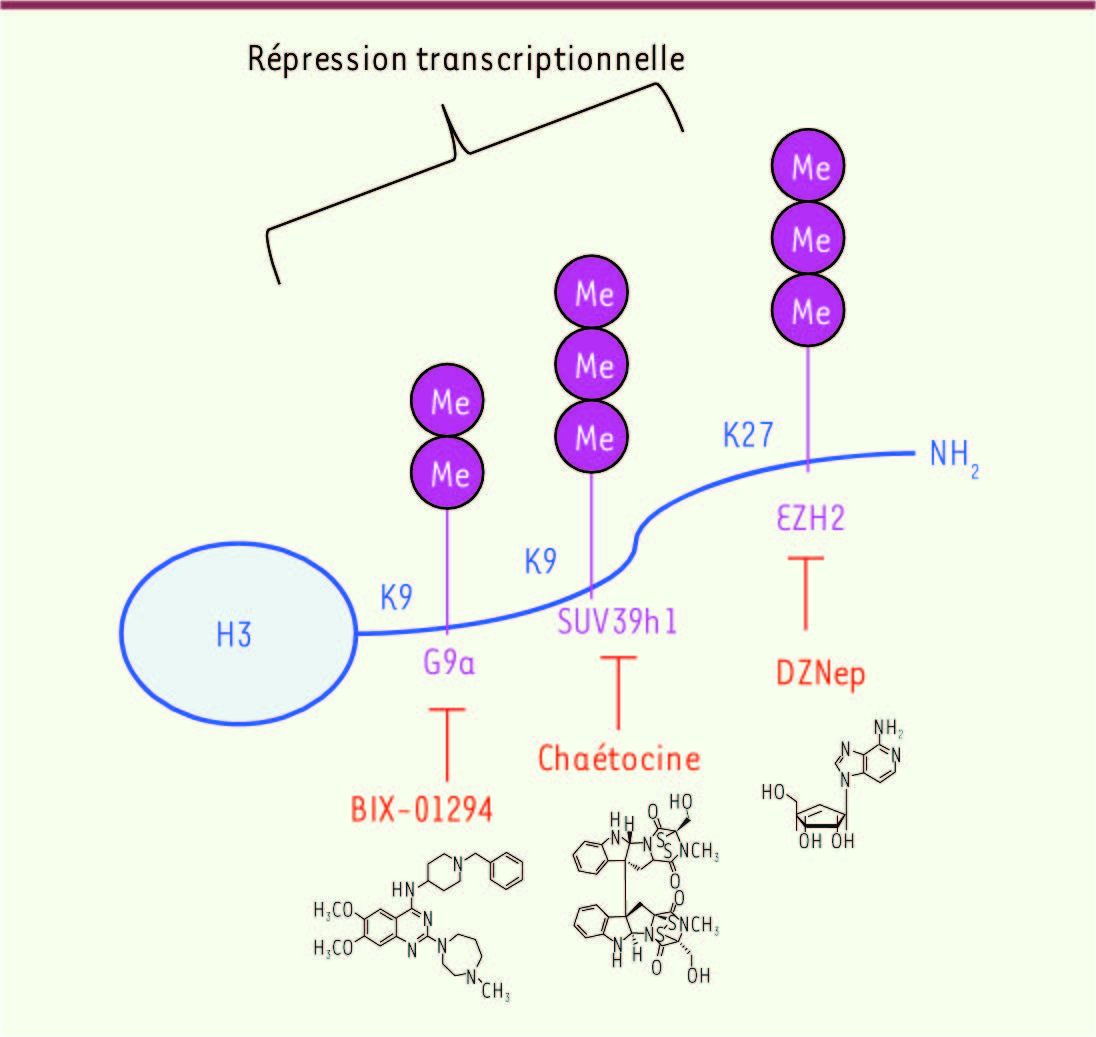
 | Figure 2.
Inhibition pharmacologique de la méthylation amino-terminale de l’histone H3. Le composé antiviral 3-deazaneplanocin (DZNep) est un inhibiteur de l’hydrolase de la S-adénosylhomocystéine (SAH), le cofacteur donneur de méthyl des méthyltransférases, conduisant à l’accumulation du taux de SAH intracellulaire et à l’inhibition peu spécifique de la méthylation des histones, incluant la triméthylation de la lysine 27 par EZH2 (Enhancer of zeste homolog 2 du groupe polycomb). Des inhibiteurs plus sélectifs ont été isolés, notamment la chaétocine, métabolite naturel fongique, inhibiteur sélectif de SUV39H1 (IC50 = 0,8 µM) et BIX-01294, inhibiteur sélectif de G9a/EHMT2 (IC50 = 1,7 µM). |
D’autres inhibiteurs sont disponibles : DZNep (S-adenosylhomocysteine hydrolase inhibitor 3-deazaneplanocin A) est un nouvel inhibiteur de la triméthylation de la lysine 27 de l’histone H3 (H3K27) [
27]. Cette molécule est décrite comme induisant sélectivement l’apoptose des cellules tumorales et non des cellules normales. À l’inverse de la chaétocine, DZNep n’inhibe pas directement l’activité enzymatique d’EZH2 mais réprime son expression ainsi que l’expression d’autres membres du complexe PRC2. Cette nouvelle drogue est également capable de restaurer, dans les cellules de cancer mammaire, l’expression d’un groupe de gènes particulièrement réprimés par le complexe PRC2. De plus, la surexpression d’EZH2 dans des cellules tumorales mammaires dans lesquelles le gène BRCA1 est muté sensibiliserait ces cellules à la mort induite par DZNep. DZNep serait donc potentiellement intéressant en thérapeutique dans les cas de cancers où EZH2 est surexprimé, notamment le cancer de la prostate où la surexpression d’EZH2 est un marqueur de très mauvais pronostic. Cependant, aucune donnée in vivo n’est actuellement disponible qui démontre l’efficacité de ce composé dans des modèles précliniques. Enfin, d’autres cibles semblent émerger. Bien que l’HMT G9a ne soit pas impliquée directement dans l’oncogenèse, la diméthylation de H3K9 médiée par G9a est impliquée dans la répression transcriptionnelle de gènes suppresseurs de tumeurs, et la délétion de G9a inhibe la croissance de cellules tumorales prostatiques. En conséquence, le développement d’inhibiteurs spécifiques de G9a trouverait, dans le futur, une application dans le traitement du cancer. Après un criblage de 125 000 molécules, un composé, BIX-01294, a été découvert, qui inhibe sélectivement G9a (IC50de 1,7 µM) in vitro et in vivo, sans compétition avec le cofacteur SAM [
28]. BIX-01294 inhibe spécifiquement le diméthylation de H3K9 médiée par G9a sans altérer la mono- ni la triméthylation. Malheureusement, ce composé sélectif ne semble pas présenter d’activité antitumorale in vitro bien que des effets cytotoxiques aient été décrits. Inhibiteurs de RMT À travers le criblage in silico d’une librairie de 9 000 composés [
29], AMI-1 a été identifié qui inhibe sélectivement PRMT1 (IC 50de 1,6 µM). Des études structurales ont proposé que cette molécule se fixe à PRMT1 au niveau de la poche de liaison au cofacteur SAM. AMI-1 est décrit comme bloquant la transactivation transcriptionnelle générée par la signalisation des récepteurs des androgènes ou des œstrogènes. En conséquence, l’identification d’AMI-1 comme le premier inhibiteur de PRMT est une étape importante dans le développement de drogues antinéoplasiques. Des modifications de ce composé primaire devront être faites de façon notamment à lui conférer la capacité d’inhiber l’action de PRMT4/CARM1 qui suscite particulièrement l’intérêt de la communauté médicale en raison de ses fonctions de coactivateur des récepteurs hormonaux. Par des approches de cribles virtuels, d’autres inhibiteurs de PRMT1 ont été développés tels que le RM65 et l’allantodapsone [
30]. Ces inhibiteurs sont plus sélectifs car plus affins pour le site de liaison au substrat arginine que pour la poche de liaison au cofacteur SAM. Ces molécules sont capables d’entraîner une forte diminution de la méthylation et d’inhiber l’activation de récepteurs aux hormones. D’autres molécules ont été développées par criblage virtuel dans le but de favoriser l’inhibition de l’interaction protéine-protéine entre une PRMT et les récepteurs nucléaires mais aucune n’exerce d’activité antitumorale in vitro. |
Les inhibiteurs d’HDAC ciblant des régions hétérochromatiniennes aberrantes aident à réactiver la transcription de gènes suppresseurs de tumeurs qui sont cruciaux pour le fonctionnement normal des cellules. La réactivation de l’expression de gènes suppresseurs de tumeurs et la restauration des voies de réparation de l’ADN par les drogues qui agissent au niveau épigénétique rendent les cellules tumorales plus sensibles à d’autres thérapies dont la chimiothérapie, l’immunothérapie ou la radiothérapie. La preuve du concept de l’intérêt des thérapies épigénétiques, à l’image des résultats obtenus pour les agents déméthylants de l’ADN dans les myélodysplasies, ou des inhibiteurs d’HDAC dans les CTCL (cutaneous T cell lymphoma), a suscité la recherche de nouvelles cibles et donc de nouveaux inhibiteurs ciblant les mécanismes de régulation épigénétique. Les histones méthyltransférases ont depuis longtemps été impliquées dans le cancer et surtout dans les leucémies, mais ce n’est que récemment que des inhibiteurs spécifiques sont apparus. Comparativement aux connaissances accumulées dans le domaine de la méthylation de l’ADN ou l’acétylation des histones, notre compréhension des mécanismes de méthylation des histones et des conséquences de leur inhibition reste encore limitée. La recherche de nouveaux inhibiteurs n’en est encore qu’à ses débuts et seule une poignée d’inhibiteurs est actuellement disponible. Plusieurs de ces molécules présentent une activité antitumorale mais leur optimisation et leur développement restent une question cruciale pour envisager leur application en clinique. |
Quelle place pour les inhibiteurs D’HMT dans le traitement du cancer ? Dans la présente revue, nous avons pu voir que le ciblage thérapeutique des histone méthyltransférases pouvait représenter une option intéressante dans le traitement du cancer. Plusieurs questions primordiales restent néanmoins a résoudre avant de pouvoir sauter le pas et entrer en phase d’expérimentation chez l’homme. En premier lieu, il faut évaluer le rapport toxicité/bénéfice attendu du ciblage de ce phénomène biologique et des molécules qui y pourvoiront. De ce point de vue, les données accumulées semblent montrer des différences notables de sensibilité entre cellules tumorales et cellules normales (progéniteurs hématopoïétiques par exemple), mais il faut se garder de conclusions trop rapides, des toxicités non attendues pouvant survenir uniquement chez l’homme. Deuxièmement, il faut envisager la place de ces composés dans l’arsenal thérapeutique pour chaque indication potentielle. Quel cancer cibler ? Pourquoi développer ce type de composé plutôt que d’autres thérapeutiques innovantes ? Les données présentées semblent indiquer les cancers du sein, de la prostate et les leucémies comme des domaines prioritaires pour le développement d’inhibiteurs d’HMT. De nombreux composés sont actuellement en cours de développement pour ces trois indications mais la fréquence et la gravité potentielle (stade métastatique) de ces maladies laissent l’opportunité de développer de nouvelles approches. Le spectre d’action des inhibiteurs d’HMT, à l’image d’autres thérapeutiques ciblées, plaide donc pour une sélection des personnes à traiter non pas sur l’organe d’origine du cancer mais bien sur les mécanismes sous-tendant la genèse et la progression de la maladie. Ce type de programme nécessite une grande collaboration et une grande complémentarité entre les cliniciens et les chercheurs mais offre une des meilleures opportunités de pouvoir proposer aux malades une approche de traitement individualisé, « à la carte », de leur maladie. Concernant la pertinence de développer des inhibiteurs de HMT spécifiquement dans les leucémies aiguës myéloïdes et les myélodysplasies, l’indication parait intéressante puisque les modifications épigénétiques représentent l’un des mécanismes importants dans la genèse et la progression de la maladie. C’est par ailleurs dans cette indication qu’a été faite la preuve de concept de l’efficacité de la modulation de l’épigénétique avec la mise en évidence de l’efficacité des agents de déméthylation de l’ADN.
|
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les travaux de notre équipe sont financés par l’Inserm, l’Institut Paoli-Calmettes, l’Association de recherche contre le cancer (ARC) et la Ligue nationale contre le cancer (bourse de thèse de Hassiba Chaib).
|
1.
Ray-Gallet
D
,
Gérard
A
,
Polo
S
,
Almouzni
G
. Variations sur le thème du « code histone » . Med Sci (Paris).
2005; ; 21 : :384.-389. 2.
Kouzarides
T
. Chromatin modifications and their function . Cell.
2007; ; 128 : :693.-705. 3.
Mottet
D
,
Castronovo
V
. Les histone désacétylases. Nouvelles cibles pour les thérapies anti-cancéreuses . Med Sci (Paris).
2008; ; 24 : :742.-6. 4.
Sowa
Y
. Development of HDAC inhibitors . Gan To Kagaku Ryoho.
2010; ; 37 : :1665.-1668. 5.
Albert
M
,
Helin
K
. Histone methyltransferases in cancer . Sem Cell Dev Biol.
2010; ; 21 : :209.-220. 6.
Kouzarides
T
. Histone methylation in transcriptional control . Curr Opin Genet Dev.
2002; ; 12 : :198.-209. 7.
Schneider
R
,
Bannister
AJ
,
Kouzarides
T
. Unsafe SET: histone lysine methyltransferases and cancer . Trends Biochem Sci.
2002; ; 27 : :396.-402. 8.
Peters
AH
,
O’Carroll
D
,
Scherthan
H
, et al.
Loss of the Suv39h histone methyltransferases impairs mammalian heterochromatin and genome stability . Cell.
2001; ; 107 : :323.-337. 9.
Czvitkovich
S
,
Sauer
S
,
Peters
AH
, et al.
Over-expression of the SUV39H1 histone methyltransferase induces altered proliferation and differentiation in transgenic mice . Mech Dev.
2001; ; 107 : :141.-153. 10.
Nielsen
SJ
,
Schneider
R
,
Bauer
UM
, et al.
Rb targets histone H3 methylation and HP1 to promoters . Nature.
2001; ; 412 : :561.-565. 11.
Owa
T
,
Yoshino
H
,
Yoshimatsu
K
,
Nagasu
T
. Cell cycle regulation in the G1 phase: a promising target for the development of new chemotherapeutic anticancer agents . Curr Med Chem.
2001; ; 8 : :1487.-1503. 12.
Cattaneo
F
,
Nucifora
G
. EVI1 recruits the histone methyltransferase SUV39H1 for transcription repression . J Cell Biochem.
2008; ; 105 : :344.-352. 13.
Carbone
R
,
Botrugno
OA
,
Ronzoni
S
, et al.
Recruitment of the histone methyltransferase SUV39H1 and its role in the oncogenic properties of the leukemia-associated PML-retinoic acid receptor fusion protein . Mol Cell Biol.
2006; ; 26 : :1288.-1296. 14.
Goyama
S
,
Nitta
E
,
Yoshino
T
, et al.
EVI-1 interacts with histone methyltransferases SUV39H1 and G9a for transcriptional repression and bone marrow immortalization . Leukemia.
2010; ; 24 : :81.-88. 15.
Krivtsov
AV
,
Armstrong
SA
. MLL translocations, histone modifications and leukaemia stem-cell development . Nat Rev Cancer.
2007; ; 7 : :823.-833. 16.
Ayton
PM
,
Cleary
ML
. Molecular mechanisms of leukemogenesis mediated by MLL fusion proteins . Oncogene.
2001; ; 20 : :5695.-5707. 17.
Ayton
PM
,
Cleary
ML
. Transformation of myeloid progenitors by MLL oncoproteins is dependent on Hoxa7 and Hoxa9 . Genes Dev.
2003; ; 17 : :2298.-2307. 18.
Okada
Y
,
Feng
Q
,
Lin
Y
, et al.
hDOT1L links histone methylation to leukemogenesis . Cell.
2005; ; 121 : :167.-178. 19.
Bracken
AP
,
Kleine-Kohlbrecher
D
,
Dietrich
N
, et al.
The Polycomb group proteins bind throughout the INK4A-ARF locus and are disassociated in senescent cells . Genes Dev.
2007; ; 21 : :525.-530. 20.
Varambally
S
,
Dhanasekaran
SM
,
Zhou
M
, et al.
The polycomb group protein EZH2 is involved in progression of prostate cancer . Nature.
2002; ; 419 : :624.-629. 21.
Bedford
MT
,
Richard
S
. Arginine methylation an emerging regulator of protein function . Mol Cell.
2005; ; 18 : :263.-272. 22.
Cheung
N
,
Chan
LC
,
Thompson
A
, et al.
Protein arginine-methyltransferase-dependent oncogenesis . Nat Cell Biol.
2007; ; 9 : :1208.-1215. 23.
Majumder
S
,
Liu
Y
,
Ford
OH
, et al.
Involvement of arginine methyltransferase CARM1 in androgen receptor function and prostate cancer cell viability . The Prostate.
2006; ; 66 : :1292.-1301. 24.
Greiner
D
,
Bonaldi
T
,
Eskeland
R
, et al.
Identification of a specific inhibitor of the histone methyltransferase SU(VAR)3-9 . Nat Chem Biol.
2005; ; 1 : :143.-145. 25.
Cook
KM
,
Hilton
ST
,
Mecinovic
J
, et al.
Epidithiodiketopiperazines block the interaction between hypoxia-inducible factor-1alpha (HIF-1alpha) and p300 by a zinc ejection mechanism . J Biol Chem.
2009; ; 284 : :26831.-26838. 26.
Isham
CR
,
Tibodeau
JD
,
Jin
W
, et al.
Chaetocin: a promising new antimyeloma agent with in vitro and in vivo activity mediated via imposition of oxidative stress . Blood.
2007; ; 109 : :2579.-2588. 27.
Tan
J
,
Yang
X
,
Zhuang
L
, et al.
Pharmacologic disruption of Polycomb-repressive complex 2-mediated gene repression selectively induces apoptosis in cancer cells . Genes Dev.
2007; ; 21 : :1050.-1063. 28.
Kubicek
S
,
O’Sullivan
RJ
,
August
EM
, et al.
Reversal of H3K9me2 by a small-molecule inhibitor for the G9a histone methyltransferase . Mol Cell.
2007; ; 25 : :473.-481. 29.
Cheng
D
,
Yadav
N
,
King
RW
, et al.
Small molecule regulators of protein arginine methyltransferases . J Biol Chem.
2004; ; 279 : :23892.-23899. 30.
Spannhoff
A
,
Machmur
R
,
Heinke
R
, et al.
A novel arginine methyltransferase inhibitor with cellular activity . Bioorg Med Chem Lett.
2007; ; 17 : :4150.-4153. |